丹参酮IIA聚乙二醇化纳米脂质载体的制备及理化性质研究
2018-01-31孙福娟于凡姚文琪李国转李旭吴孟陈卫东
★ 孙福娟 于凡 姚文琪 李国转 李旭 吴孟 陈卫东
(安徽中医药大学药学院 合肥 230012)
丹参酮ⅡA(tanshinone IIA,TA)是从中药丹参(SalviamiltiorrhizaBge.)的干燥根及根茎中提取分离的二萜醌类化合物,其具有广泛的生理活性,如抗肿瘤、保护心脑血管、抗氧化、抗菌、保肾保肝等作用[1-5],且不良反应较少。然而丹参酮IIA难溶于水,口服胃肠吸收差,生物利用度低,严重限制其疗效的发挥[6]。纳米脂质载体(nano structured lipid carrier,NLC)是在一定温度下将固态脂质和空间上不相容的液态脂质混合,在固体脂质纳米粒(solid lipid nano particles,SLN)的基础上发展而来的第二代脂质纳米载体。据报道,NLC已被视作是脂质体和SLN的优良替代物,其具有较强的药物保护作用,便于长期储存,可明显提高口服生物利用度,并改变药物在体内的分布[7-8]。但是,NLC进入体内循环系统会被单核细胞吞噬系统(MPS)视作异物进而被吞噬,大大缩短了纳米粒在体内的循环时间[9]。近年来,众多研究者选用含聚乙二醇(PEG)的材料对纳米粒表面进行修饰,从而躲避MPS的吞噬。同时,PEG还具有改善纳米粒亲水性从而达到长循环、提高纳米粒稳定性等优点[10-12]。
因此课题组从药剂学方面着手,结合长循环纳米载体的优点,制备丹参酮IIA聚乙二醇化纳米脂质载体,以期达到改善口服胃肠吸收,提高生物利用度的目的,为后续剂型的研究提供参考依据,扩大丹参酮IIA在临床方面的应用。
1 材料
1.1 仪器 LC-16C高效液相仪(日本岛津);AB135-S型十万分之一天平(德国梅特勒-托利多公司);DF-101B数显恒温磁力搅拌器(巩义市予华仪器有限责任公司);XW-80A微型涡旋混合器(上海沪西分析仪器厂有限公司);KQ-300B型超声波清洗器(昆山市超声仪器有限公司);LC-4016型低速离心机(安徽中科中佳科学仪器有限公司);超滤离心管(美国Milipore);Zetasizer Nano ZS 90粒度测定仪(英国马尔文公司);透射电子显微镜(TEM,JEM-100SX,日本JEOL公司)。
1.2 试剂 丹参酮IIA原料药(纯度≥98%,西安鸿生生物技术有限公司,批号 140320);丹参酮IIA标准品(中国食品药品检定研究院,批号 110766-200619);单硬脂酸甘油酯、聚乙二醇硬脂酸(湖南尔康制药股份有限公司);中链脂肪酸(广州市宏晟化工原料有限公司);蛋黄卵磷脂(安徽丰原医药公司);聚山梨酯-80(国药集团化学试剂有限公司);葡聚糖凝胶G-50(北京恒辉科技有限公司);甲醇(色谱纯,上海信可有限公司);无水乙醇(上海苏懿化学试剂有限公司);其余试剂均为分析纯。
2 方法与结果
2.1 NLC的制备 通过前期预实验考察,本实验最终选用乳化蒸发-低温固化法制备TA-P-NLC。操作如下:将处方量的GMS、PEG-SA、MCT、卵磷脂和TA溶于5mL无水乙醇中,水浴加热升温至70℃构成油相;再将一定量的T-80溶于15mL超纯水中,水浴加热至与油相同温,构成水相。用1mL注射器将水相缓慢匀速地注入到正在搅拌(1000r/min)的油相中,搅拌时间为2.5h。待有机溶剂完全挥发后,将乳液迅速转移至盛有20mL冰水的锥形瓶中,继续搅拌1.5h,即得TA-P-NLC。
2.2 TA分析方法的建立 经紫外扫描,确定检测波长为270nm。经优化确定色谱条件为:流动相为甲醇-水(85∶15),进样量20μL,流速1.0 mL/min,柱温30℃。该条件下,进行方法学考察。由实验结果可知,溶剂、辅料等对TA的测定无干扰,专属性较好;丹参酮IIA在0.1~32.0μg/mL与峰面积呈良好线性关系,回归方程为Y=136492X+50189(r=0.9992);低、中、高(0.10、1.0、10.0 μg/mL)3个质量浓度的日内精密度RSD分别为1.45%、0.53%、1.37%,日间精密度RSD分别为0.64%、1.38%、1.26%;1.6、2.0、2.5μg/mL 3种质量浓度的平均回收率为(100.02±0.94)%,RSD分别为1.65%、1.25%、1.66%;平行制备供试液6份并逐个进样,峰面积RSD值为1.28%,重复性良好;室温下溶液8h内稳定性较好(RSD=1.46%)。上述结果均符合方法学要求,表明该分析方法适合丹参酮IIA含量的测定。
2.3 包封率的测定 取活化好的葡聚糖凝胶(Sephadex G-50)适量,装入底部垫有两层滤纸片的注射器中。待水分自然流下,将其置于低速离心机中,梯度离心使凝胶柱失水皱缩,得到Sephadex G-50微型柱。取TA-P-NLC 500μL,上样于微柱顶部,3000r/min离心3 min,再于柱顶加相同体积的超纯水,连续洗脱4次并收集滤液,加甲醇破乳并定容到3 mL,进样分析并计算NLC内已包裹的TA的质量(M1)。另取未过柱的TA-P-NLC 500μL,先加0.8mL的超纯水,再加适量甲醇并定容到3mL,同法分析并计算体系中总的TA质量(M0)。
(包封率=M1/ M0×100%)。
2.4 正交试验 本实验筛选出3个主要影响因素:GMS与PEG-SA的质量比(A)、MCT占总脂质的质量分数(B)、卵磷脂质量浓度(C)。每个因素各取三个水平,根据正交试验设计的原理,以包封率作为评价指标,按照L9(34)正交表设计安排试验,因素水平表见表1,正交设计结果见表2。
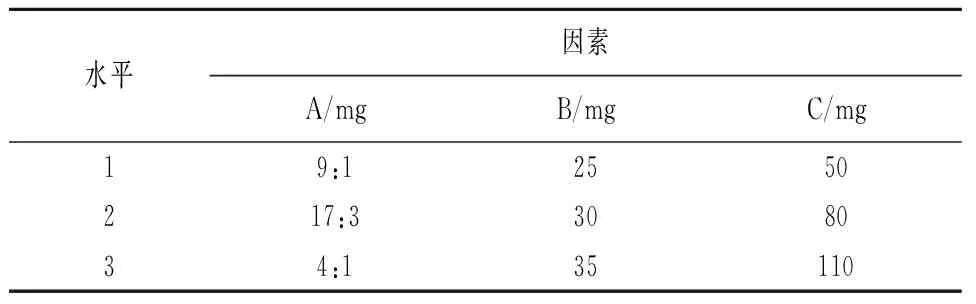
表1 正交试验因素水平表
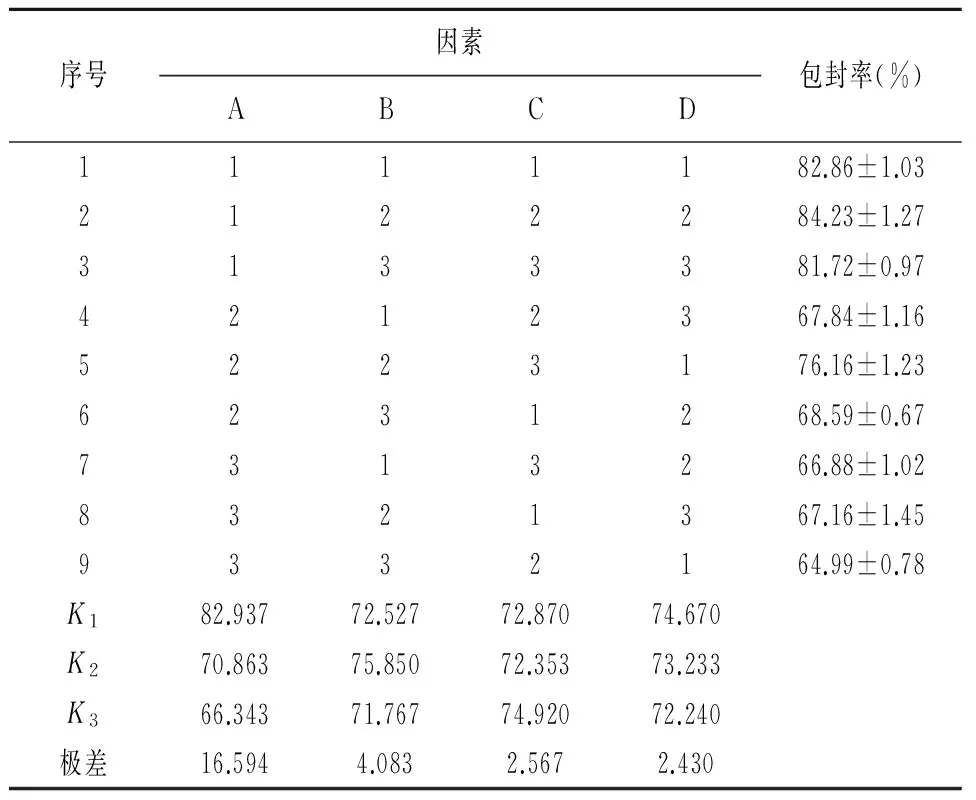
表2 正交设计包封率的结果(Mean±SD, n=3)
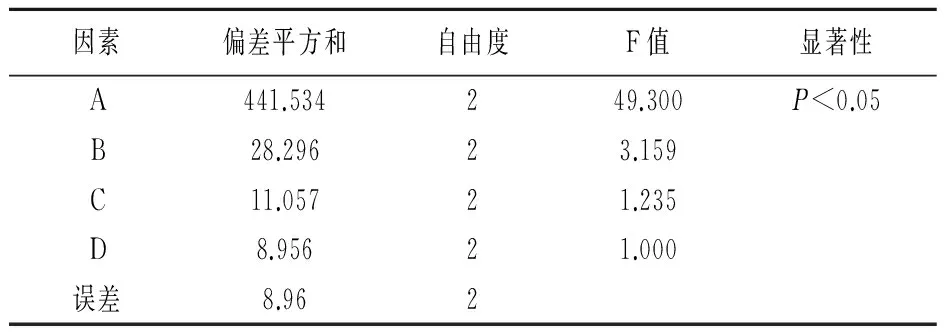
表3 方差分析
由表2可知,各因素对包封率的影响大小依次为A1>A2>A3,B2>B1>B3,C3>C1>C2;比较极差值可以发现,各因素对实验结果的影响大小顺序为A>B>C。同时分析表3可知,因素A对包封率影响显著。因此,最优处方组合为A1B2C3,即PEG-SA占总脂质质量的4%,MCT占总脂质质量的60%,卵磷脂用量为22g/L,T-80含量为2g/L。
2.5 验证试验 按照最优处方及工艺,平行制备3批TA-P-NLC,并按“2.2”下方法测定,包封率分别为83.49%、84.28%、85.37%。结果表明该工艺重复性较好。
2.6 TA-P-NLC理化性质研究
2.6.1 形态学考察 将所制得的TA-P-NLC溶液,滴加适量于铜网上,自然晾干后置于透射电镜下观察纳米粒显微形态。从图1可见,TA-P-NLC纳米粒呈较规则的球形,粒子之间无粘连。
2.6.2 粒径及Zeta电位的测定 在室温条件下,取TA-P-NLC溶液适量,用超纯水稀释10倍后,将其置于样品池中。使用纳米激光粒度仪测定粒径和Zeta电位,粒径分布及Zeta电位分别见图2~3。由图可知,TA-P-NLC平均粒径为218.8nm,且多分散系数小于0.3,说明纳米粒粒度分布均匀;胶体分散系统中常用Zeta电位评价其物理稳定性,一般来说,高表面电荷证明粒子之间具有较强的斥力,在水溶液中会更加稳定[13]。本实验制备的TA-P-NLC Zeta电位为-34.3mV,稳定性较好,利于储存。
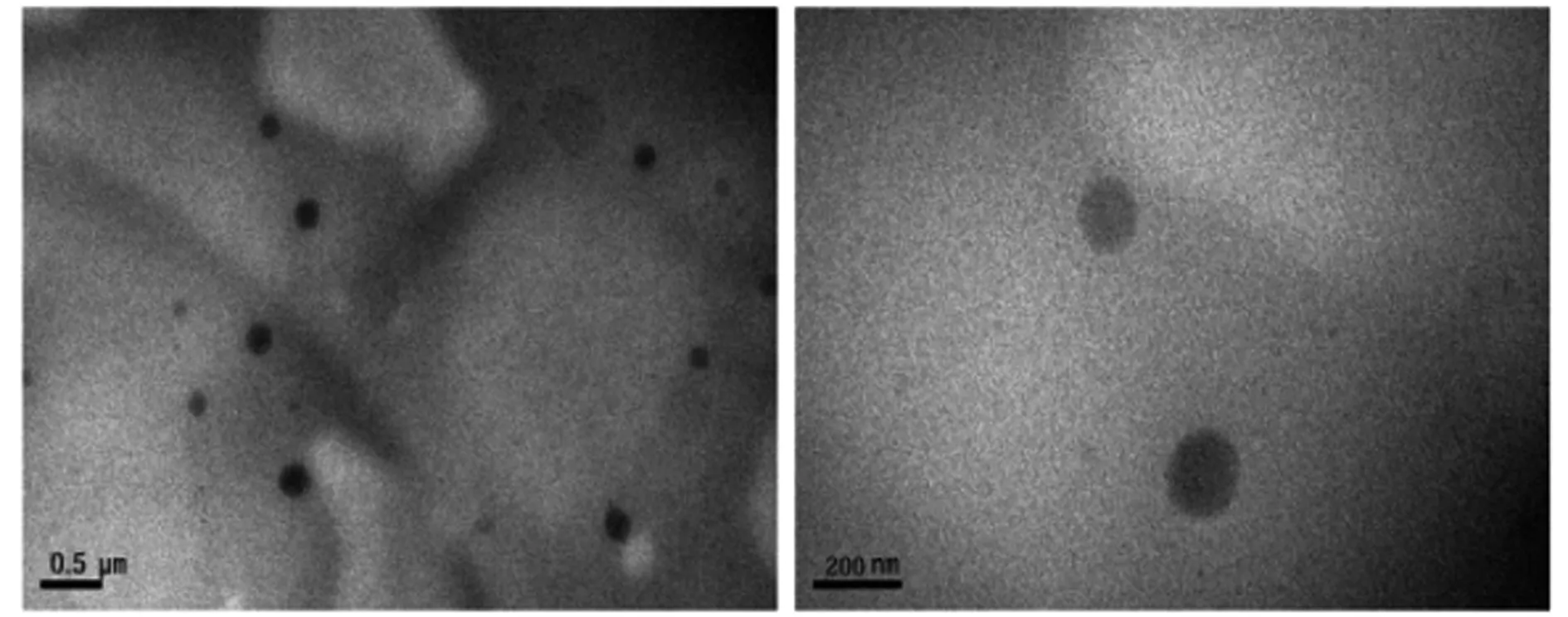
图1 TA-P-NLC的透射电镜图

图2 TA-P-NLC粒径分布

图3 TA-P-NLC Zeta电位
2.6.3 DSC分析 以空白铝锅作为对照,在氮气气氛下,以10℃/min的速率在一定温度范围内扫描,分别对TA、GMS、PEG-SA、TA-P-NLC进行DSC分析,使用Origin9.0软件分析数据,结果见图4。热解曲线显示,TA的特征吸热峰在207℃左右;GMS、PEG-SA的吸热峰分别为56.5、47.4 ℃;TA-P-NLC曲线图中,TA的吸热峰已消失,且无GMS、PEG-SA的吸热峰,而在110.4℃左右出现一新的吸热峰。由此说明,TA被NLC成功包载,纳米粒已经形成,构成一新的物相。

图4 热解曲线
2.6.4 体外释放度考察 精密量取TA-P-NLC和TA溶液各5mL置于预先处理好的透析袋中,将两端夹紧,放置在盛有50mL含1%吐温80的PBS(pH7.4)的溶出器皿中,温度为37℃,转速为100r/min,平行操作3份。分别在0,1,2,3,4,5,6,7,8,12,20,30,48h取样0.5mL,同时快速补加同温同体积的新鲜释放介质,过0.45μm微孔滤膜后进样分析,并计算累积释放量Q。Q=[Ci×V1+(C1+C2+…Ci-1)×V2]/M×100%。
式中C1、C2、Ci-1、Ci分别为第1、2、i-1、i等时间点释放介质中TA浓度;V1为释放介质的总体积,V2为取样体积。
结果见图5,TA溶液在24h时基本释放完全,TA-P-NLC在48h内累积释放量仅为45.63%,说明TA-P-NLC中TA的释放具有明显的缓释特性。
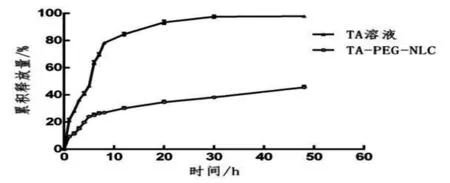
图5 体外释放曲线
3 讨论
包封率是制剂质量评价中最重要的指标之一,药物和辅料的不同导致包封率的测定方法也千差万别。本研究曾考虑采用超滤离心法,但进样分析发现滤液中并不能检测到TA。可能是在离心力的作用下,纳米粒吸附在滤膜中,游离的TA并不能透过,故检测不到。使用葡聚糖凝胶微柱离心法分离游离TA,进样分析结果表明该法能准确地测定包封率,且操作方便、重现性好、误差较小,故选择微柱离心法来测包封率。
在TA-P-NLC制备过程中,转速对实验结果有显著影响,转速较小导致粒径过大且分布不均匀,转速较大会产生大量泡沫,导致药物与辅料之间混合不充分,放置几天即有絮凝出现;乳化过程决定了整个制剂的成功与否,在水相注入油相时,要控制好注射速度,过快不利于二者的分散融合,过慢由于温度较高则会使油相因蒸发而损失。
本实验选择磷酸缓冲液(pH7.4)作为释放介质来模拟体内环境。由于TA难溶于水,故在释放介质中加入1%的吐温80以达到漏槽条件。分析体外释放曲线可知,TA-P-NLC释放过程可大致分为突释和缓释两部分。前12h左右为突释过程,累积释放量约30%,可能是纳米粒表面吸附的部分TA快速释放所致;随后的释放过程明显变慢,一方面可能是纳米粒骨架中的药物随脂质材料的溶蚀使释放趋于缓慢,另一方面可能是PEG包裹在纳米粒表面,从NLC内部释放出的药物受到其阻碍而变得缓慢。由于体外释放数据不能代表TA在人体中的释放过程,所以TA-P-NLC的释放行为应通过后续药动学、药效学研究进一步证实。
纳米药物递送系统具有广阔的发展前景,尤其在靶向给药方面极具优势与潜力。本实验成功制备TA-P-NLC,并对其理化性质进行研究。结果表明,以乳化蒸发-低温固化法制备的TA-P-NLC的粒径较小且分布均匀、包封率高、体外释放缓慢,其为丹参酮IIA的临床应用奠定了基础。
[1]李德川,鲍秀琦,孙华,等.丹参酮IIA对缺血性脑中风的神经保护作用研究进展[J].药学学报,2015,50 (6):635-639.
[2]Jun Xie,Jiahui Liu,Heng Liu,et al.The antitumor effect of tanshinone IIA on antiproliferation and decreasing VEGF/VEGFR2 expression on the human non-small cell lung cancer A549 cell line[J].Acta Pharmaceutica Sinica B,2015,5(6):554-563.
[3]郑言博.蒽醌类化合物抗菌及抗肿瘤生物活性的研究[D].武汉:湖北工业大学,2012.
[4]Chunming Jiang, Wei Zhu, Qiuyuan Shao,et al.Tanshinone IIA Protects Against Folic Acid-Induced Acute Kidney Injury[J].The American Journal of Chinese Medicine,2016,44(4):737-753.
[5]关翠雯,金晶,李佳,等.丹参酮IIA激活Nrf2/ARE通路保护雷公藤甲素所致急性肝损伤[J].药学学报,2013,48(9):1 397-1 402.
[6]丁冬梅,张振海,蒋艳荣,等.丹参酮IIA喷雾干燥粉体药剂学性质的研究[J].中草药,2014,45(10):1 398-1 401.
[7]Nirmal V. Shah, Avinash K. Seth, R. Balaraman,et al.Nanostructured lipid carriers for oral bioavailability enhancement of raloxifene: Design and in vivo study[J].Journal of Advanced Research, 2016,7(3):423-434.
[8]Feifei Feng, Dandan Zheng, Dianrui Zhang,et al.Preparation, characterization and biodistribution of nanostructured lipid carriers for parenteral delivery of bifendate[J].Journal of Microencapsulation,2011,28(4):280-285.
[9]Xiaoyun Zhang, Hua Qiao, Jianping Liu,et al.Dihydroartemisinin loaded nanostructured lipid carriers (DHA-NLC): Evaluation of pharmacokinetics and tissue distribution after intravenous administration to rats[J].Pharmazie,2010,65(9):670-678.
[10]Mohammed Anwar, Sohail Akhter, Neha Mallick,et al.Enhanced anti-tumor efficacy of paclitaxel with PEGylated lipidic nanocapsules in presence of curcumin and poloxamer: In vitro and in vivo studies[J].Pharmacological Research, 2016,113(Pt A) :146-165.
[11]汪杨,吴伟.隐形纳米粒的体内靶向性[J].中国药学杂志,2004,39(1):7-11.
[12]Qing Zhang, Haoyu Zhao, Dong Li,et al.A surface-grafted ligand functionalization strategy for coordinate binding of doxorubicin at surface of PEGylated mesoporous silica nanoparticles: Toward pH-responsive drug delivery[J].Colloids and Surfaces B: Biointerfaces,2017,149:138-145.
[13]Tiecheng Zhang,Jianian Chen,Yi Zhang,et al.Characterization and evaluation of nanostructured lipid carrier as a vehicle for oral delivery of etoposide[J].European Journal of Pharmaceutical Sciences,2011,43(3):174-179.
