山西老陈醋发酵阶段高产淀粉酶芽孢杆菌的筛选与鉴定
2018-01-31邢晓莹范振宇王如福
乔 羽,于 迪,邢晓莹,范振宇,王如福*
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
淀粉酶是催化淀粉、糖原、糊精中糖苷键水解的一类酶的统称,广泛用于食品加工、酿造、制药、纺织、饲料等领域[1]。淀粉酶广泛存在于自然界多种生物体中,其中微生物淀粉酶来源非常广泛,如真菌中的米曲酶和黑曲霉,细菌中的枯草芽孢杆菌、巨大芽孢杆菌和地衣芽孢杆菌等[2-3]。
山西老陈醋历史悠久,是我国传统的四大名醋之一,它以高粱为主要原料,以麸皮、谷糠和稻壳为辅料,利用大曲作为糖化发酵剂,经酒精发酵、醋酸发酵等工序酿制而成。其酿造过程从微生物的角度看,实质上是一个特定的微生物群体共代谢的过程[4]。除了起主要发酵作用的酵母菌、乳酸菌和醋酸菌,芽孢杆菌在大曲和整个发酵过程中始终存在。目前有研究报道,在大曲制作的最后阶段,芽孢杆菌成为占主导地位的菌群之一,这可能是由于其极强的抗逆性[5-7]。此外有研究发现芽孢杆菌在醋酸发酵阶段芽抱杆菌的活动规律及其数量变化曲线同醋酸菌基本一致,呈现先增后减的趋势,且它与醋酸菌协同参与发酵,对食醋酸度、风味形成具有一定的促进作用[8-9]。
芽孢杆菌代谢可产生淀粉酶,发酵过程中淀粉酶总活力的高低决定了老陈醋发酵过程中原辅料中淀粉的转化效率,进而影响最终醋的产量。因此在老陈醋发酵过程中,如果能对产淀粉酶芽孢菌合理的应用,则可能提高对淀粉原料的分解利用,进而提高出醋率,同时也能在一定程度上改善产品风味。本研究跟踪山西老陈醋的整个发酵过程,从不同发酵天数的酒醪和醋醅中筛选产淀粉酶的芽孢杆菌。通过对产淀粉酶芽孢杆菌的初筛、酶活力测定及耐受性分析,筛选高产淀粉酶且耐受性较好的优势芽孢杆菌,以期为后期高淀粉酶活力复合菌剂的研制提供菌种基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验样品
样品取自山西某醋厂。酒醪发酵时间为1 d、4 d、7 d、10 d;醋醅发酵时间为1 d、3 d、5 d、7 d、9 d。每个样品3份,置于4℃冰箱保存,备用。
1.1.2 试验试剂
细菌基因组DNA提取试剂盒:北京艾德莱生物科技有限公司;D2000 DNA Ladder、2×Taq聚合酶链反应(polymerase chain reaction,PCR)Master Mix:中科瑞泰(北京)生物科技有限公司;碘、碘化钾、蔗糖(分析纯):天津光复科技发展有限公司;盐酸四甲基对苯二胺:东京化成工业株式会社;无水葡萄糖(分析纯):天津市凯通化学试剂有限公司;可溶性淀粉(分析纯):天津市大茂化学试剂厂。
1.1.3 培养基
营养琼脂培养基:蛋白胨10 g、牛肉膏3 g、氯化钠5 g、琼脂15 g,定容至1 000 mL,121℃灭菌15 min,备用。
营养肉汤培养基:蛋白胨10 g、牛肉膏3 g、氯化钠5 g,定容至1 000 mL,121℃灭菌15 min,备用。
初筛培养基[10]:可溶性淀粉2 g、牛肉膏5 g、蛋白胨10 g、琼脂粉18g、氯化钠5g,定容至1000mL,121℃灭菌20min,备用。
改良发酵培养基[11]:高粱粉5 g、可溶性淀粉5 g、酵母膏5 g、蛋白胨10 g、葡萄糖1 g、KH2PO42 g、MgSO4·7H2O 0.5g、CaCl2·2H2O0.2g,定容至1000mL,121℃灭菌20min,备用。
1.2 仪器与设备
SPX-100B-Z生化培养箱:北京瑞科中仪科技有限公司;Neofuge 23R台式高速冷冻离心机:上海力申科学仪器有限公司;2100型分光光度计:大尼科(上海)仪器有限公司;LEICA CM750生物显微镜:德国徕卡显微系统有限公司;ZQPL-200立式全温振荡培养箱:天津莱玻特瑞设备有限公司;Centrifuge 5424R低速冷冻离心机:德国Eppendorf公司;DYY-6C型电泳仪:北京市六一仪器厂;凝胶成像分析系统:美国UVP公司。
1.3 试验方法
1.3.1 产淀粉酶芽孢杆菌的菌落数量测定
称取10g不同发酵天数的酒醪、醋醅样品置于装有90mL无菌水的三角瓶中,80℃水浴加热10 min富集芽孢菌,对富集液进行10倍梯度稀释;吸取100 μL不同稀释倍数的菌悬液涂布至初筛培养基上,每个梯度做三个平行;30℃恒温培养48 h后,加入一定量的卢氏碘液,染色5 min,选择菌落数量在15~300的平板,记录有明显透明圈菌落的个数。
1.3.2 产淀粉酶芽孢杆菌的初筛
选择有明显透明圈单个菌落,采用分区划线法连续纯化3代后,固体斜面4℃保存备用。将已纯化的芽孢杆菌再次点接于初筛培养基上,30℃培养48 h后,滴加卢氏碘液,使其均匀覆盖平板,用游标卡尺分别测量水解圈直径(D1)和菌落直径(D2),计算两者比值(D1/D2)大小,初步确定淀粉酶活力的高低并挑选出比值较大的菌株。
1.3.3 菌株复筛
经初筛纯化后的菌株挑取一环接种于营养肉汤培养基中,30℃摇床培养24h。按照2%接种量接种于装有50mL发酵培养基的锥形瓶中,37℃、180 r/min摇床培养48 h。将发酵液置于50 mL的离心管中,8 000 r/min离心10 min,收集上清液为待测粗酶液。采用3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS)测定待测粗酶液的淀粉酶活力,具体方法参考文献[12-13]。酶活力单位定义:在40℃、pH值为3.7的条件下,每毫升酶液每分钟水解可溶性淀粉产生1 μg葡萄糖为1个酶活力单位(U/mL)。
1.3.4 高产淀粉酶菌株的耐受性分析
耐乙醇能力分析:用接种环挑取一环菌接种于装有10 mL营养肉汤培养基的试管中,37℃、220 r/min摇床培养18 h,然后按2%的接种量接种于装有10 mL乙醇体积分数(V/V)分别为3%、6%、9%的营养肉汤培养基中,37℃、220 r/min摇床培养培养24 h,用分光光度计在波长600 nm条件下测定培养液的吸光度值。
耐酸能力分析:用接种环挑取一环菌接种于装有10mL营养肉汤培养基的试管中,37℃、220 r/min摇床培养18 h,按2%的接种量分别接种于装有10 mL用乙酸调节pH分别为3.5、4.5、5.5的营养肉汤培养基中,37 ℃、220 r/min摇床培养培养24 h,用分光光度计在波长600 nm处测定培养液的吸光度值。
不同温度的生长情况分析:用接种环挑取一环菌于装有10 mL营养肉汤培养基的试管中,37℃,220 r/min摇床培养18 h后,按2%的接种量接种于装有10 mL营养肉汤培养基中,分别在20℃、30℃、40℃、50℃培养温度下,220 r/min摇床培养24 h,用分光光度计在波长600 nm处测定培养液的吸光度值。
1.3.5 高产淀粉酶菌株的鉴定
(1)形态学鉴定:将菌株划线涂布于营养琼脂平板上,于37℃培养24h,观察菌落特征并描述。挑取单菌落进行革兰氏染色对菌株的细胞形态进行观察。
(2)生理生化鉴定:参照《伯杰细菌鉴定手册》第8版中芽孢杆菌属特征和《常见细菌系统鉴定手册》[14-15]进行部分生理生化特性鉴定。
(3)分子生物学鉴定:采用16S rDNA鉴定,利用细菌基因组DNA提取试剂盒对菌株的基因组DNA进行提取,采用细菌16S rDNA通用引物27F和1492R为上下游引物,以菌株的DNA基因组为模板,PCR扩增菌株16S rDNA的部分基因序列。PCR扩增条件:94℃预变性5 min;94℃变性30 s,53℃退火30 s,72℃延伸1.2 min,30次循环;72℃延伸7min。取4μL的PCR产物于2%琼脂糖凝胶中进行电泳,检测是否扩增成功。将扩增成功的PCR产物送至生工生物工程(上海)股份有限公司测序,测序结果在GenBank数据库中进行BLAST比对,下载同源性高的序列,利用Mega 6.0软件构建系统发育树。
2 结果与分析
2.1 山西老陈醋发酵过程中产淀粉酶芽孢杆菌的动态变化

图1 发酵过程中产淀粉酶芽孢杆菌的菌落数量变化曲线Fig.1 Change curve of the colony number of amylase-producing Bacillusduring fermentation
由图1可知,山西老陈醋发酵过程中产淀粉酶的芽孢杆菌的菌落数量呈现先下降后上升然后下降的趋势。在酒化阶段,随着发酵时间的推移,由于酒醪中酒精度的增加以及后期相对无氧的发酵环境,抑制了芽孢杆菌的生长,所以产淀粉酶芽孢杆菌的数量呈现下降的趋势,在酒化最后一天其数量达到最低为4.0×104CFU/g。在醋化阶段,随着辅料加入稀释了醋醅中的酒精浓度,并且醋醅处在一个开放的环境,产淀粉酶芽孢杆菌的数量呈现先上升后下降的趋势,在醋酸发酵第3天达到最大为1.1×105CFU/g。随后由于随着醋醅中酸的逐渐积累,芽孢杆菌的数量呈现下降的趋势,在醋酸发酵最后一天降至最低为3.3×104CFU/g。
2.2 产淀粉酶的芽孢杆菌初筛
从醋厂采集的不同发酵天数的酒醪和醋醅9份样品中,分离纯化得到60株产淀粉酶的芽孢杆菌。水解圈直径(D1)、菌落生长直径(D2)及其比值是表征菌株产酶能力高低的一个指标[16]。通过计算透明圈和菌落生长直径的比值,挑选出比值>4.5的16株芽孢杆菌。由表1可知,菌株JT10-9、CT32-3、CT73-6的D1/D2值都超过了9。说明其产淀粉酶的能力相对较高。

表1 产淀粉酶菌株初步筛选Table 1 Preliminary screening of amylase-producing strains
2.3 淀粉酶活力的测定
对挑选出来的16株产淀粉酶芽孢杆菌进行摇瓶发酵培养,对菌株粗酶液的淀粉酶活力进行测定。经发酵复筛,用软件Prism作柱形图并进行显著性差异分析。复筛结果如图2所示,16株芽孢杆菌的粗酶液在40℃、pH值为3.7的条件下,均有一定分解淀粉的能力,说明所选菌株具有产淀粉酶的能力。利用Prism对菌株淀粉酶活力大小进行显著性分析可知,菌株JT10-9、JT 10-8、JT1-3、JT4-4、CT32-3和CT73-6的淀粉酶活力都高于180 U/mL,并显著高于大部分菌株(P<0.05),其中菌株JT10-9的淀粉酶活力最高,达到228.73 U/mL。选取菌株JT10-9、JT 10-8、JT1-3、JT4-4、CT32-3和CT73-6进行下一步耐受性试验分析。

图2 分离菌株的淀粉酶活力Fig.2 Amylase activity of the isolated strains
2.4 产淀粉酶菌株的耐受性分析
2.4.1 耐乙醇能力分析

图3 产淀粉酶菌株的在不同乙醇体积分数培养基中的生长情况Fig.3 Growth status of amylase-producing strains at mediums with different ethanol concentrations
根据山西老陈醋实际生产情况可知,山西老陈醋酒化阶段初期(0~2d)酒醪的乙醇体积分数能够由0快速升高到6%左右,酒化结束时酒醪的乙醇体积分数能够达到9%[17]。通过测定菌株培养液的光密度值,可反映菌株在不同乙醇体积分数的环境中的生长情况,进而可推断菌株是否能应用在实际的生产环境中。由图3可知,菌株JT10-9、JT10-8、JT1-3、JT4-4、CT32-3、CT73-6在乙醇体积分数为3%的培养基中生长良好。当乙醇体积分数升高至6%时,所有菌株培养液的OD600nm值都有所下降。当乙醇体积分数升高至9%,所有菌株培养液的OD600nm值下降明显,但是菌株在乙醇体积分数为9%的环境中都能有所生长。因此,分离得到的6株产淀粉酶菌株均可耐受体积分数9%的乙醇,其中菌株JT10-9耐乙醇能力较强。
2.4.2 耐酸能力分析

图4 产淀粉酶菌株在不同pH培养基中的生长情况Fig.4 Growth status of amylase-producing strains at mediums with different pH
根据山西老陈醋实际生产情况及本实验室前期对发酵过程中pH变化测定结果,调节培养基的pH,考察菌株在pH 3.5~5.5环境中的生长状况,结果见图4。由图4可知,各菌株在pH5.5的环境中生长较好。随着pH的降低至3.5时,产淀粉酶菌株的生长情况受到不同程度的抑制。菌株JT10-8和菌株JT1-3的OD600nm值降到了0.1以下,几乎停止生长。菌株JT10-9、CT32-3、CT73-6的生长虽然受到抑制,但均能在pH3.5的环境中生长。说明菌株JT10-9、CT32-3和CT73-6的耐酸能力较好。
2.4.3 温度耐受能力分析

图5 产淀粉酶菌株不同培养温度下的生长情况Fig.5 Growth status of amylase-producing strains at different culture temperatures
根据山西老陈醋实际生产情况,选取在20℃、30℃、40℃和50℃温度下培养高产淀粉酶的菌株,考察温度对产淀粉酶菌株生长状况的影响,结果见图5。由图5可知,高产淀粉酶菌株均在30℃条件下生长良好,在此温度下所有菌株的OD600nm值达到最大,30℃条件下各菌株的生长量远高于其它培养温度下的生长量。在40℃条件下,各菌株的OD600nm值高于20℃条件下的OD600nm值,并且显著高于50℃条件下的OD600nm值。说明菌株在30~40℃环境中可以较好的生长。在50℃条件下,菌株CT73-6几乎停止生长,说明其耐高温能力较差。其他5株菌都可在50℃条件下的环境中生长,说明菌株JT10-9、JT10-8、JT1-3、JT4-4、CT32-3能够适应大曲制作及山西老陈醋生产的环境。
2.5 菌株个体及菌落形态观察结果
综合所筛选菌株的耐受性分析可知,菌株JT10-9可完全适应山西老陈醋的发酵环境,所以对菌株JT10-9进行了个体形态和菌落形态的观察,结果见图6。由图6可知,菌株JT10-9的菌体形态为杆状,革兰氏染色阳性,芽孢中生,孢囊不膨大。菌落直径为2.20~3.10 mm,呈乳白色,不透明,隆起,边缘不规则。
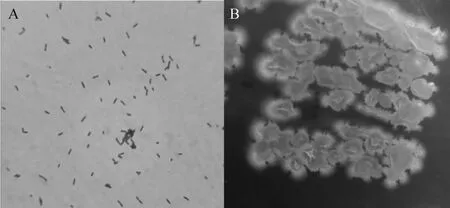
图6 菌株JT10-9的细胞形态(A)及菌落特征(B)Fig.6 Cell morphology(A)and colony characteristics(B)of strain JT10-9
2.6 生理生化特性鉴定
菌株JT10-9菌株的生理生化鉴定结果见表2。由表2可知,菌株JT10-9的生理生化特征与《常见细菌系统鉴定手册》中芽孢杆菌属特征相符,进一步确定菌株JT10-9属于芽孢杆菌属(Bacillussp.)。

表2 菌株JT10-9的生理生化鉴定结果Table 2 Physiological and biochemical identification results of strain JT10-9
2.7 菌株16SrDNA鉴定结果
以菌株JT10-9基因组DNA为模板,进行PCR扩增,如图7所示,菌株的PCR扩增产物经2%琼脂糖凝胶电泳检测出在大约1500bp处存在一条特异性条带。获得的PCR产物经测序为1416 bp长度的序列。测序结果输入到GenBank数据库中通过Blast比对进行同源性比较。利用Mega 6.0软件构建系统发育树,结果如图8所示。由图8可知,菌株JT10-9在系统发育树上与Bacillus amyloliquefaciens同属于一个分支,通过Blast比对该菌株序列与已知多株Bacillus amyloliquefaciens16S rDNA的同源性高达99%以上。因此,结合菌株JT10-9的菌落形态、细胞形态、生理生化鉴定结果,初步确定菌株JT10-9为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。

图7 菌株JT10-9基因的16S rDNA扩增PCR电泳结果Fig.7 Electrophoretic results of PCR amplification of 16S rDNA of strain JT10-9 gene

图8 菌株JT10-9的系统发育进化树Fig.8 Phylogenetic tree of strain JT10-9
2.8 讨论
本试验从山西老陈醋的不同发酵天数的酒醪和醋醅中分离产淀粉酶的芽孢杆菌,初筛采用的水解圈法,虽易于直观的分离出淀粉酶产生菌,但初筛结果可能会受到平板pH、平板厚度不均一等因素的影响,水解圈法不能准确判断菌株的淀粉酶活力的大小,所以采用DNS法对菌株的淀粉酶活力进一步的测定。本研究是在40℃,pH 3.7条件下测得菌株JT10-9的淀粉酶酶活力为228.73 U/mL,其作为野生土著细菌菌株,在酸性的条件下表现出的淀粉酶活力还是比较高的,而且芽孢杆菌能克服霉菌发酵中产生带颜色的菌丝和孢子的缺点[13]。接下来可针对该菌株的酶学特性做进一步的研究分析。
3 结论
本试验对山西老陈醋酒化阶段和醋化阶段产淀粉酶芽孢杆菌进行了分离筛选,得一株淀粉酶活力较高且耐受性较好的菌株JT10-9。对菌株JT10-9的菌落形态、细胞形态、生理生化鉴定以及16S rDNA鉴定,最后鉴定出菌株JT10-9为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。后期可采用生物技术手段对BacillusamyloliquefaciensJT10-9进行定向改造,以提高其在酸性条件下的淀粉酶活力。从而将其用于强化酒化发酵和醋化发酵以及酶制剂的研制,这对提高淀粉质原料的分解利用及耐酸型淀粉酶制剂的开发具有良好的应用前景。
[1]PANDEY A,NIGAM P,SOCCOL C R,et al.Advances in microbial amylases[J].Biotechnol Appl Biochem,2000,31(2):135.
[2]刘杰雄,陈 号,陆 雯,等.淀粉酶高产菌株的筛选及其酶活的测定[J].食品工程,2010(1):45-47.
[3]刘 欣.食品酶学[M].北京:中国轻工业出版社,2006:35-40.
[4]吕艳歌,马海乐,李云亮,等.山西老陈醋产酸菌的分离鉴定及系统分析[J].中国食品学报,2013,13(12):163-171.
[5]ZHENG X W,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter(Fen-Daqu),revealed by culture-dependent and culture-independent methods[J].Food Microbiol,2012,31(2):293-300.
[6]NIE Z Q,ZHENG Y,DU H F,et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiol,2015,47:62-68.
[7]王进龙.山西老陈醋大曲中芽孢杆菌的分离鉴定及特性研究[D].晋中:山西农业大学,2016.
[8]弓晓艳.老陈醋酿造过程中微生物群落结构与功能研究[D].太原:山西大学,2010.
[9]赵洪源.凉州熏醋传统酿造过程高产四甲基吡嗪微生物筛选及其代谢机理初探[D].兰州:甘肃农业大学,2015.
[10]鲁 珍,魏姜勉,谌馥佳,等.高温大曲中高产α-淀粉酶菌株分离鉴定及其产酶性能研究[J].农业研究与应用,2016(2):5-11.
[11]李 力,刘冬梅,罗淑萍,等.高淀粉酶蛋白酶活力枯草芽孢杆菌菌株的筛选及鉴定[J].渔业现代化,2008,35(2):15-18.
[12]赖玉城.产多酶体系混菌固态发酵酒糟生产蛋白饲料[D].福州:福建师范大学,2014.
[13]张 琳,张 也,王如福,等.大曲中高产糖化酶菌株的筛选及环境耐受性分析[J].山西农业大学学报:自然科学版,2016,36(10):740-744.
[14]布坎南,R.F.伯杰细菌鉴定手册[M].北京:科学出版社,1984:15-19.
[15]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:25-28.
[16]冯瑞章,庞建义,王 涛,等.浓香型白酒产糖化酶菌株筛选及产酶条件研究[J].中国酿造,2013,32(10):81-84.
[17]吴光明,杨林娥,张 磊,等.山西老陈醋生产过程中酒精度变化规律研究[J].山西农业科学,2015,43(4):450-451.
