STR分型技术鉴定后两株U87胶质瘤细胞系生物学特性评价
2018-01-30张文丽孔凡虹董成亚王雅杰
张文丽 孔凡虹 何 露 董成亚 王雅杰,3*
(1.首都医科大学附属北京天坛医院检验科,北京 100050;2.首都医科大学附属北京天坛医院临床医学研究实验室,北京 100050;2.首都医科大学附属北京天坛医院临床医学研究实验室,北京 100050;3. 首都医科大学附属北京地坛医院检验科,北京 100015)
脑胶质瘤是一种颅内最常见的恶性肿瘤,特别是胶质母细胞瘤,恶性程度最高,呈浸润性生长,预后最差,对多种治疗方案具有高耐受性[1-4]。胶质瘤细胞的增生、迁移和侵袭造成胶质瘤的浸润性生长,难以与周围组织分清界限,并侵袭重要神经血管,在肿瘤的进展中发挥重要作用[5]。U87细胞系是恶性胶质瘤细胞系,广泛应用于胶质瘤的科学研究中[6]。
美国典型培养物保藏中心(American Type Culture Collection, ATCC) 和美国国立卫生研究院(National Institutes of Health, NIH)等机构建立在实验前对所使用细胞系进行准确鉴定[7-8]。在本课题组[9]前期研究中,利用人类细胞系鉴定金标准——短串联重复序列(short tandem repeats,STR)分型检测技术对实验室现有的3株U87细胞系进行了鉴定,筛选出2株真正的U87胶质瘤细胞系,分别为ATCC数据库中U-87MG Glioblastoma-Astrocytoma Human细胞、德国微生物菌种保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen,DSMZ)数据库中U-87MG细胞,两细胞株未出现污染现象,细胞株来源的患者性别不同,其他用于鉴定的STR位点一致[10]。然而,两株U87胶质瘤细胞系生物学特性以及是否能够应用于后续的科研实验尚未确定。
本研究采用CCK-8法、划痕实验、Transwell实验等方法,对两细胞系进行细胞生物学特性的比较。
1 材料与方法
1.1 实验材料
1)脑胶质瘤细胞系:U87-A:ATCC数据库中U-87 MG Glioblastoma-Astrocytoma Human;U87-D:DSMZ数据库中U-87 MG。
2)仪器设备:多气体培养箱(型号MAO-18M,日本三洋公司),离心机(型号DZ47-63,北京白洋医疗器械有限公司),ESCO OptiMair®垂直流超净工作台(型号ACB-4A1,新加坡ESCO公司),倒置显微镜(型号Axiovert 40,德国ZEISS公司),多功能酶标仪(型号SpectraMax M5,美国Molecular Devices公司)。
3)主要试剂:DMEM、胎牛血清(美国Gibco公司),0.25%(质量分数)胰蛋白酶、PBS缓冲液(美国Hyclone公司),CCK-8试剂(日本同仁化学),Transwell小室(美国Costar公司),Matrigel胶(美国 BD公司)。
1.2 细胞生长特性以及形态特征观察
分别复苏1支U87-A、U87-D冻存细胞于T25培养瓶中,做好标记,使用含10%(体积分数)胎牛血清的DMEM培养基,5%CO2(体积分数)、37 ℃培养箱中培养。细胞培养过程中使用倒置显微镜观察细胞的一般形态及生长速度。复苏后24 h及培养72 h拍照。实验重复3次。
1.3 细胞生长曲线(CCK-8法)
取对数生长期细胞,用DMEM培养基制成2.5×104/mL单细胞悬液,接种至96孔板中(100 μL/孔,即2.5×103个细胞/孔),将培养板放在培养箱中预培养[37 ℃、5%(体积分数) CO2]。培养6、24、48、72 h,每个时间段5个重复,向每孔加入10 μL CCK-8溶液,将培养板继续在培养箱内孵育1~4 h后,用酶标仪测定450 nm处的吸光度。实验重复3次,取平均值。以时间为横坐标,A值为纵坐标拟合细胞生长曲线。
1.4 划痕实验
先用Marker笔在6孔板背后,均匀划横线,大约每隔0.5~1.0 cm划一道,横穿过孔。在孔中加入约1×106个细胞,待细胞铺满时,用枪头尽量垂直于背后的横线划痕。用PBS洗涤细胞,去除划下的细胞,加入无血清培养基。继续放入37 ℃、5%(体积分数)CO2培养箱培养。划痕后0 h和继续培养24 h后拍照。设3个重复孔,实验重复3次。结果用迁移率表示,迁移率=(划痕0 h距离-划痕24 h后距离)/划痕0 h距离。
1.5 Transwell迁移、侵袭实验
1)迁移实验:取对数生长期细胞,用无血清DMEM培养基将细胞密度稀释为5×104个/mL。在Transwell小室的内室加入100 μL的上述细胞混悬液,外室内加入600 μL含20%(体积分数)血清的DMEM培养基,置于37 ℃、5%(体积分数)CO2培养箱中培养。24 h后终止培养,弃去外室的培养液,PBS洗涤后,用4%(质量分数)多聚甲醛固定细胞约20 min,0.1%(质量分数)结晶紫常温染色30 min。弃去内室液体,PBS洗2遍,用棉签轻轻擦拭内室上室面的细胞。风干后置于显微镜下,每个小室随机选取3个视野拍照,计数穿到下室的细胞数量,取均值,以迁移细胞的相对数目来表示肿瘤细胞的迁移能力。设3个平行小室,实验重复3次。
2)侵袭实验:将50 mg/L Matrigel用无血清DMEM培养基将其按1∶8比例稀释混匀,取40μL包被Transwell小室底部膜的上室面,置于37 ℃、5%(体积分数)CO2培养箱中,2 h后待用,待Matrigel胶凝为胶状时可开始加样。其他步骤同迁移实验。设3个平行小室,实验重复3次。
1.6 统计学方法

2 结果
2.1 细胞生长特性以及形态特征
U87-A与U87-D细胞生长特性以及形态特征较为相似,两细胞系均为贴壁型,细胞多呈扁平不规则形,中间有圆形细胞核,细胞彼此紧密相连成单层,有长短不一的突起。复苏约2 d后生长呈网状,3~4 d可传代。经液氮或-150 ℃低温冻存后复苏仍能继续增生,显微镜下形态见图1。

图1 两细胞系显微镜下形态Fig.1 Microscope morphology of the two cell lines
A:morphology of U87-A after 24 h recovery;B:morphology of U87-A after 72 h recovery;C:morphology of U87-D after 24 h recovery;D:morphology of U87-D after 72 h recovery.
2.2 细胞生长曲线
CCK-8法检测细胞的生长增生能力,结果提示U87-A在4个时间点吸光度值分别为:0.395±0.009、0.878±0.027、1.949±0.127、2.192±0.085,U87-D在4个时间点吸光度值分别为:0.397±0.006、0.777±0.022、1.748±0.081、1.909±0.086。细胞生长曲线显示U87-A较U87-D生长速度稍快,但差异无统计学意义(P>0.05)。两株细胞连续培养72 h,均达到对数生长期且生长良好,可用于进一步实验(图2)。
2.3 划痕实验
划痕实验检测细胞的迁移能力,结果提示U87-A和U87-D细胞划痕24 h后细胞迁移率分别为 0.42±0.05、0.39±0.03,差异无统计学意义(P>0.05,图3)。

图2 细胞生长曲线Fig.2 Cell growth curve

图3 划痕实验检测细胞迁移能力Fig.3 Migration ability of cell detected by scratch test(40×)
A:0 h after the U87-A scratch test;B:24 h after the U87-A scratch test;C:0 h after the U87-D scratch test;D:24 h after the U87-D scratch test.
2.4 Transwell实验
U87-A和U87-D细胞迁移到下室的细胞数分别为269.33±17.39、239.00±13.74,差异无统计学意义(P>0.05,图4)。
U87-A和U87-D细胞侵袭到下室的细胞数分别为182.33±8.74、214.00±13.53,差异具有统计学意义(P<0.05),U87-D细胞侵袭能力高于U87-A细胞(图5)。
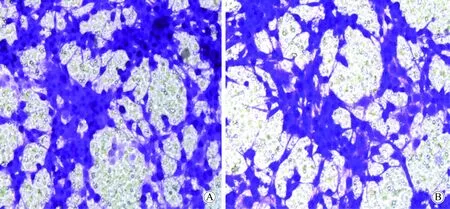
图4 Transwell实验检测细胞迁移能力Fig.4 Migration ability of cell detected by Transwell assay(100×)A:Cells of U87-A cell line were migrated to the lower chamber;B:Cells of U87-D cell line were migrated to the lower chamber.
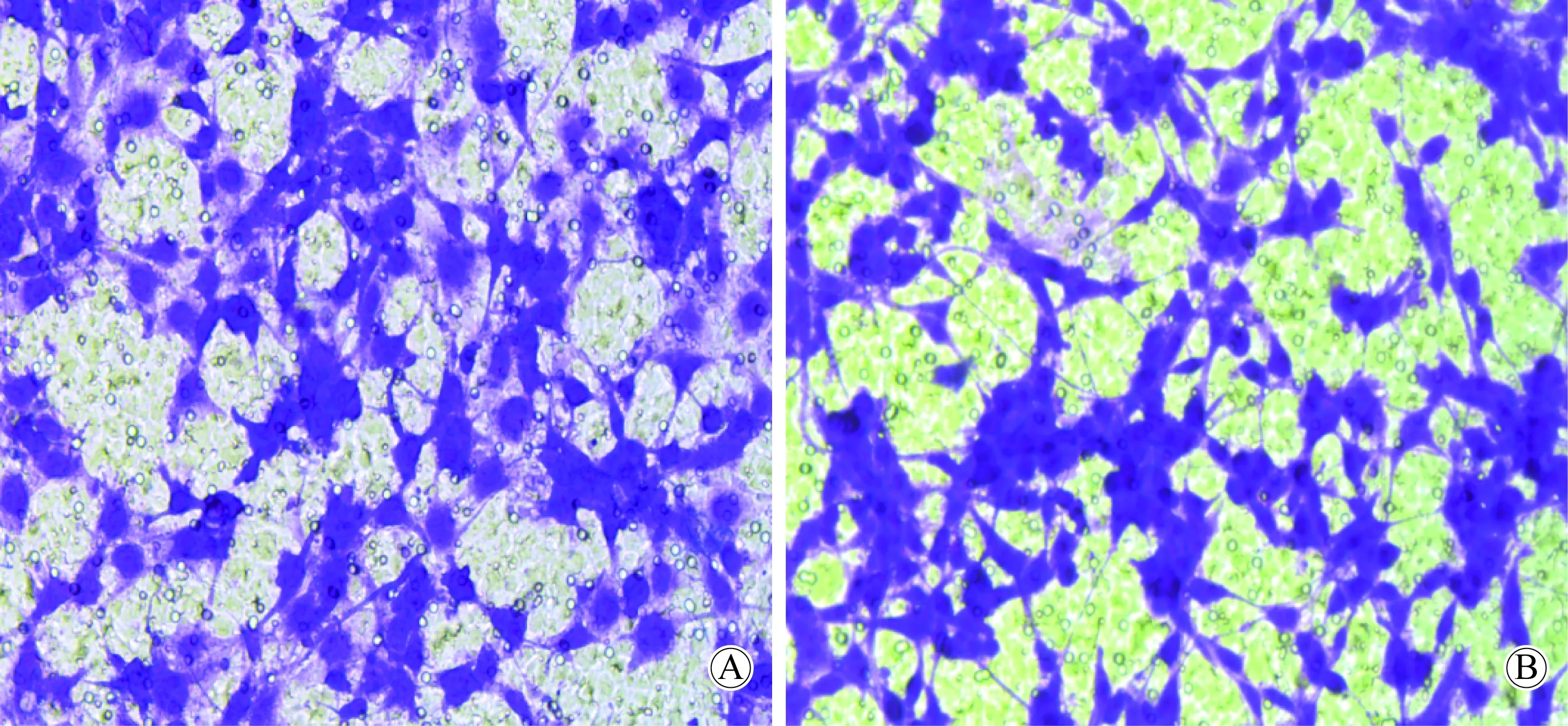
图5 Transwell实验检测细胞侵袭能力Fig.5 Invasion ability of cell was detected by Transwell assay(100×)A:Cells of U87-A cell line were invaded to the lower chamber;B:Cells of U87-D cell line were invaded to the lower chamber.
3 讨论
科研实验中对细胞系进行质量控制,去除错误和发生交叉污染的细胞,能够保证后续研究的准确性[7,11]。在本课题组[9]前期研究中,利用STR分型检测技术筛选出了两株U87胶质瘤细胞系,但对于两细胞系生物学特性了解甚少。进行实验前,了解使用细胞系的生物学特性对实验的成败同样至关重要。
肿瘤细胞与体内正常细胞相比,在形态、生长增生、迁移以及侵袭等方面具有显著不同。其在体内和体外培养均表现为不受控增生性,具有无限的复制能力,在低血清中仍能生长。肿瘤细胞的迁移和侵袭能力造成了肿瘤组织的浸润和转移,并能促进血管生成[12-13]。
本研究利用体外细胞培养方法,采用各种细胞学实验,并结合显微镜下形态学特征,评价两U87细胞系的生物学特性。两细胞系复苏后生长良好,均可用于进一步实验,显微镜下无明显形态学差异。CCK-8增生实验未发现细胞增生能力的差异,划痕实验结果提示两细胞系迁移能力差异无统计学意义(P>0.05),后通过Transwell实验验证其迁移能力,结果同划痕实验。而Transwell侵袭实验显示U87-D细胞侵袭能力高于U87-A。综上所述,两细胞系在形态学、生长增生及迁移能力方面差异无统计学意义(P>0.05),仅侵袭能力方面差异有统计学意义(P<0.05)。
U87细胞系能够反应脑胶质瘤的生物学特性,目前已广泛应用于胶质瘤的研究[14]中,对胶质瘤发生、发展各项机制的研究具有重要意义。本研究着眼于细胞应用的实际需求,通过评价两U87细胞系的生物学特性,对其各个方面有了更好的了解,对于细胞系的后续应用具有重要价值。为相关领域的研究提供了选择细胞系的实验依据,可根据不同的实验目的选择合适的细胞系,有助于后续研究的顺利开展。
[1] Morgan L L. The epidemiology of glioma in adults: a “state of the science” review[J]. Neuro-oncology, 2015,17(4): 623-624.
[2] Ahmed R, Oborski M J, Hwang M, et al. Malignant gliomas: current perspectives in diagnosis, treatment, and early response assessment using advanced quantitative imaging methods[J]. Cancer Manag Res, 2014, 6:149-170.
[3] 李连进, 佟建洲,崔敬,等.脑胶质瘤组织AKT和PTEN的测定意义[J].中华肿瘤防治杂志,2016,23(S1):24-25.
[4] 李岩, 石蕊,陈建新,等.VM-26和DDP联合化疗对复发高级别脑胶质瘤的治疗体会[J].中华肿瘤防治杂志,2015,22(5):786-790.
[5] Xie Q, Mittal S, Berens M E. Targeting adaptive glioblastoma:an overview of proliferation and invasion[J]. Neuro Oncol, 2014, 16(12): 1575-1584.
[6] Kanno H, Sato H, Yokoyama T A, et al. The VHL tumor suppressor protein regulates tumorigenicity of U87-derived glioma stem-like cells by inhibiting the JAK/STAT signaling pathway[J]. Int J Oncol, 2013, 42(3):881-886.
[7] Barallon R, Bauer S R, Butler J, et al. Recommendation of short tandem repeat profiling for authenticating human cell lines, stem cells, and tissues[J]. In Vitro Cell Dev Biol Anim,2010,46(9): 727-732.
[8] Masters, J R. Cell-line authentication: End the scandal of false cell lines[J]. Nature, 2012, 492(7428): 186.
[9] Dirks W G, Drexler H G. STR DNA typing of human cell lines: detection of intra-and interspecies cross-contamination[J]. Methods Mol Biol,2013,946:27-38.
[10] 张文丽,孔凡虹,贺文艳,等.细胞培养实验中细胞系鉴定及质量控制重要性探讨[J]. 标记免疫分析与临床, 2017, 24(1): 84-87.
[11] Masters, J R. Cell-line authentication: End the scandal of false cell lines[J]. Nature, 2012, 492(7428): 186.
[12] Lazebnik Y. What are the hallmarks of cancer?[J]. Nat Rev Cancer, 2010, 10(4): 232-233.
[13] Hanahan D, Weinberg R A. Hallmarks of cancer: the next generation[J]. Cell, 2011,144(5):646-674.
[14] 王维娜,梁月勉,赵春兰.多灶性脑胶质瘤伴肺转移一例报告[J].中华肿瘤防治杂志,2015,22(4):312-314.
