脓毒症相关急性肾损伤患者肾功能转归的临床研究
2018-01-30于淑婧刘景峰冀晓俊段美丽
于淑婧 刘 培 林 瑾 刘景峰 冀晓俊 刘 壮 董 磊 段美丽*
(1.首都医科大学附属北京友谊医院重症医学科,北京 100050; 2.首都医科大学附属同仁医院重症医学科, 北京 100730)
急性肾损伤是重症监护病房(intensive care unit,ICU)常见危重病,其发病率逐年升高且伴随病死率逐年上升[1-4]。急性肾损伤(acute kidney injury,AKI)是脓毒症常见且较严重的合并症,病死率明显高于脓毒症未合并AKI的患者,也高于非脓毒性AKI患者。
当前,AKI 的早期发现和预后评价临床主要依据为血肌酐和尿量值,但血肌酐除受肾小球及肾小管的自身因素影响外,还与大小、身体质量变化、人种、饮食成分、基础代谢、机体容量状况、肾毒性药物的使用及有效循环血容量等外在因素相关,具有一定的滞后性。
目前对AKI生物标志物的研究已成为当前探讨的热点。但是,当今多数研讨多着重于大手术后AKI生物标志物早期发现及预后方面,但对脓毒症合并AKI肾功能预后判断方面的探究较少。而肾功能预后判断对脓毒症患者最终结局具有非常重要的意义。本研究对首都医科大学附属北京友谊医院ICU 2016年1月1日至2016年12月31日收入的脓毒症合并AKI患者进行临床指标分析,了解脓毒症AKI患者肾功能转归及相关临床指标,并观察早期AKI生物标志物与肾功能转归的相关性。
1 对象与方法
1.1 研究对象
对2016年1月1日至2016年12月31日在首都医科大学附属北京友谊医院ICU住院的患者进行筛查,诊断为脓毒症且发展为AKI的成年患者纳入研究。排除尿毒症、肾移植、 24 h内转出或因严重基础疾病导致死亡的患者。
1.2 相关标准
脓毒症:存在感染且全身性感染相关性器官功能衰竭(Sepsis-related Organ Failure Assessment, SOFA)评分≥2分。急性肾损伤的诊断标准:符合2012年改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes, KDIGO)重新修订的AKI诊断标准[5]。满足以下任一项者即可明确诊断:肾功能的突然减退(在48 h内),表现为血肌酐升高绝对值≥0.3 mg/dL(≥26.4 mmol/L),或血肌酐较基础值升高≥50%,或尿量减少(尿量<0.5 mL·kg-1·h-1),时间超过6 h。基础肌酐浓度:入院前3个月肌酐水平或者入院后肌酐最低值。肾功能恢复是AKI诊断标准不再满足。器官功能障碍定义为SOFA该项器官功能评分≥2分。
1.3 研究方法
1.3.1 临床观察指标
人口统计学资料、基础疾病、入ICU原因、原发疾病、脓毒症感染部位、合并器官功能衰竭数目,记录诊断脓毒症相关AKI 24 h内的一般临床资料的最差值,包括一般情况、生命体征、血常规、血生物化学指标、动脉血气分析等指标,根据24 h最差值进行急性生理和慢性健康评分Ⅱ(Acute Physiology and Chronic Health EvaluationⅡ, APACHEⅡ)评分、SOFA评分及Glasgow昏迷评分,并记录其诊断前2周及3月内肾毒性药物应用情况,前7 d每日尿量、是否肾脏替代治疗治疗、每日治疗模式及治疗量,28 d内及90 d内肾功能恢复及最终结局等指数,并对其进行APACHEⅡ 评分,并统计其器官功能衰竭数目,进行SOFA评分,以期判断入组患者病情危重程度。
1.3.2 观察时间
凡符合入组标准的患者,从诊断脓毒症相关AKI之日起观察28 d、90 d,记录其28 d、90 d肾功能恢复及最终结局情况。患者因基础疾病严重合并症死亡,随访时间可以不足28 d,但需超过48 h,也可入组观察。
1.3.3 研究分组
根据患者转出或出院前肾功能恢复情况及生存情况分为肾功能恢复组、肾功能未恢复组。
1.3.4 标本收集与保存
入选患者共49例,入组即刻及之后连续6 d每日晨采用含有促凝剂的密封真空采血管采取静脉血4 mL,同时用无菌尿管留取患者血液透析治疗前尿液5 mL,室温下静置30 min内以3 000 r/min离心5 min,分别提取血清和尿液的上清液保存于EP管内,密封并依次编码后保存于-80 ℃冰箱冷冻保存待用。应避免样本的反复冷冻和融化。操作期间所有样本统一放在37.0 ℃固定温度水浴锅中融化。尿和血样本的收集距离检测急性肾损伤生物标志物的平均时间约为1年,遵从样本试剂盒说明书进行无菌实验完成检测。
1.4 统计学方法

2 结果
2.1 患者入选流程
首都医科大学附属北京友谊医院ICU 2016年1月1日至2016年12月31日共收治638名患者,其中77名患者符合入选标准,排除16名尿毒症患者、12名进入ICU 24 h内死亡或转出患者,最终入选49名患者。49名患者分为肾功能恢复组(24名)和肾功能未恢复组(25名),详见图1。
2.2 肾功能恢复单因素分析
2.2.1 基线资料与肾功能恢复相关性分析
本研究对重症患者年龄、性别、基础疾病情况与28 d及90 d内肾功能完全恢复情况做相关性分析(表1),结果提示年龄、有心功能不全及高血压疾病史在两组患者间有差异。

图1 研究对象入选及排除过程Fig.1 Study participants selection and exclusion process
ICU:intensive care unit.
2.2.2 临床资料与肾功能恢复相关性
对两组患者诊断脓毒症AKI 24 h内临床资料及治疗措施进行组间对比,得出结论(表2)。其中,诊断脓毒症AKI后24 h APACHEⅡ 评分、肾外器官SOFA评分、KDIGO分期、脏器衰竭个数≥3个、血小板计数、乳酸浓度、肺部感染、合并呼吸衰竭、少尿、机械通气、应用血管活性药物、入组即刻血尿入组即刻尿组织金属蛋白酶抑制剂-2(tissue inhibitor of metalloproteinase-2, TIMP-2)、胰岛素样生长因子结合蛋白-7(insulin-like growth factor binding protein-7, IGFBP-7)、血中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)浓度差异有统计学意义。

表1 基线资料对比分析Tab.1 Baseline data comparison analysis

表2 肾功能恢复组与未恢复组临床资料对比分析Tab.2 Comparison of clinical data between recovery and unrecovered group
2.2.3 肾功能恢复的多因素分析
将单因素分析及人口学资料中影响肾功能恢复的因素作为协变量,以肾功能是否恢复作为因变量进行条件Logistic回归分析,逐层分析得出机械通气、APACHE Ⅱ 评分、KDIGO分期、少尿型、入组即刻血NGAL及尿TIMP-2为影响肾功能恢复的危险因素,详见表3。
2.2.4 预测肾功能恢复的ROC曲线模型
将影响肾功能恢复的危险因素作为预测肾功能恢复的指标,分别建立ROC曲线模型,曲线下面积、P值及最佳拐点如表4所示,APACHEⅡ、SOFA评分、KDIGO分期、入组即刻血NGAL、尿TIMP-2浓度可预测肾功能恢复。
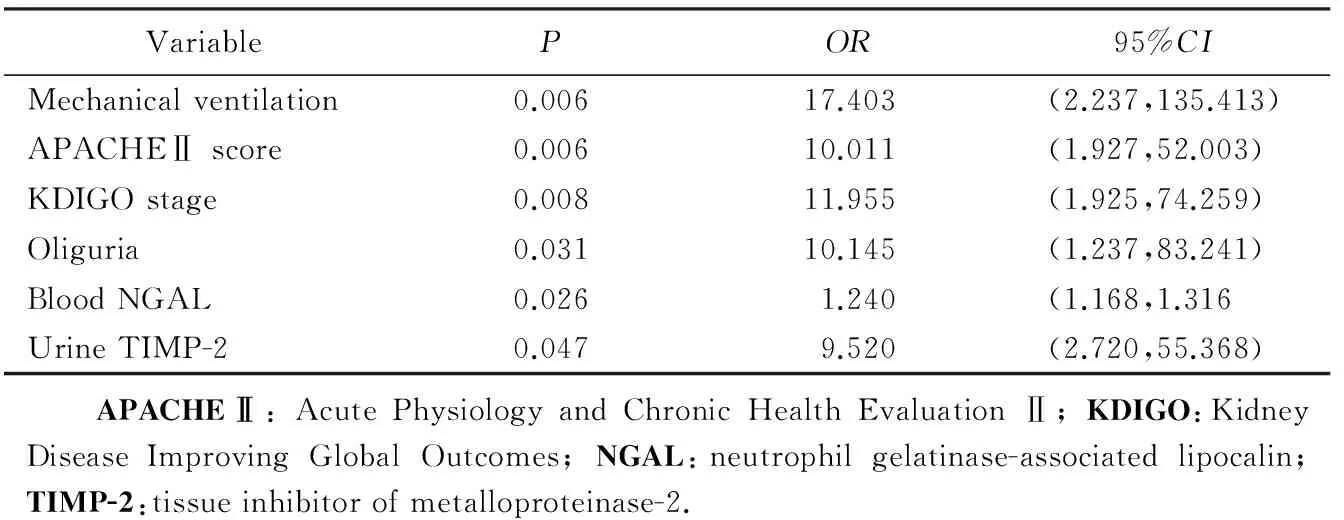
表3 肾功能恢复多因素Logistic回归分析Tab.3 Multivariate Logistic regression analysis of renal function recovery
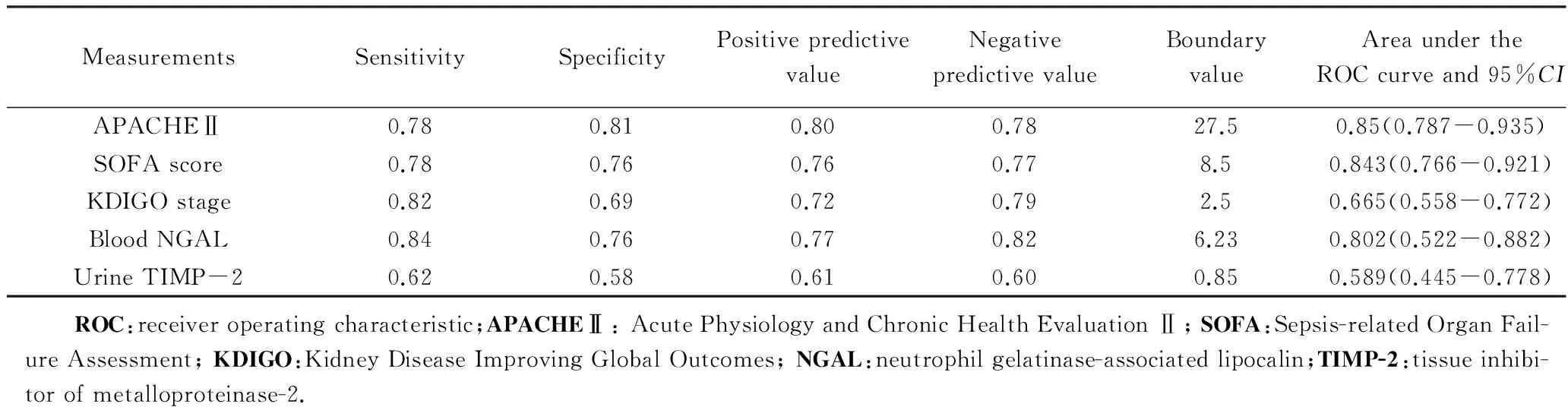
表4 肾功能恢复指标ROC曲线模型Tab.4 Renal function recovery measurements ROC curve model
3 讨论
ICU内脓毒症相关AKI发生率高,肾功能恢复率低,患者最终结局差。观察性研究[6]显示ICU内脓毒性AKI患者病死率高于非脓毒性AKI患者和单纯脓毒性患者。本研究中整体肾功能恢复率为51%,肾功能恢复的患者中超过一半以上的患者因整体病情重而最终结局为死亡。所入选的患者中,超过一半以上为急诊收入,其次为病房转入;原发感染灶中肺部感染占65%,其次为腹腔感染占33%,其中肺部感染患者肾功能恢复率相对较差。
本研究中,男女比例在肾功能恢复与未恢复组间差异无统计学意义,而年龄为肾功能恢复的独立危险因素,与其他研究[7-8]结果相似,高龄患者自身抵抗力差、肾功能有所退化可能为影响肾功能完全恢复的主要原因。但也有研究者[9]得出了相反结论,认为年龄与肾功能恢复无明显相关性。故年龄因素对肾功能转归的影响尚需更进一步研究。
APACHEⅡ 评分、SOFA评分及肾外脏器衰竭个数在本研究证实为肾功能恢复的相关因素,这已被多项研究[10-11]证实。本研究结果表明APACHEⅡ 评分、脏器衰竭个数≥3个是脓毒症相关AKI肾功能恢复的危险因素,在脏器衰竭中,若存在呼吸衰竭,则肾功能恢复率明显降低。APACHEⅡ 评分的ROC曲线模型提示其能较好地预测肾功能的恢复,当APACHEⅡ 评分≤27时,肾功能恢复的可能性较大,上述因素均反映全身疾病的严重程度,疾病越严重,肾功能恢复性越小。因此,入ICU时的APACHEⅡ 评分可以帮助临床医生对于患者肾功能恢复做出提前预测。
有研究[12]显示少尿为肾功能恢复的独立危险因素,本研究也得出相似的结果:脓毒症相关AKI非少尿型患者肾功能恢复率明显高于少尿型患者,少尿是影响肾功能恢复的危险因素。同时,本研究表明应用利尿剂并不能改善肾功能恢复,这可能与利尿剂使用使患者尿量增加、掩盖AKI严重程度而延迟肾脏替代治疗有关。近些年,越来越多的人[13-15]主张早期性肾替代治疗,也许其可以改善患者的生存率或者促进肾功能恢复。但本研究多因素Logistic回归结果显示:肾脏替代治疗并非肾功能恢复的影响因素,考虑可能与本研究样本量较小存在一定偏倚有关。本研究采用2012年KDIGO标准[5],分析表明患者肾功能分级越差、肾功能恢复率越低,经多因素Logistic回归分析得出KDIGO分期Ⅲ期为影响患者肾功能恢复的危险因素。
近来有学者[16]提出体内液体过多是AKI患者死亡的独立危险因素,特别是对于已行复苏的患者是非常有害的。Chen等[17]研究亦表明行连续性肾脏治疗时治疗前容量状态与临床转归有关。严重脓毒症患者,尤其是脓毒性休克患者补充容量以增加肾脏灌注是保护肾脏免受损伤的重要治疗手段之一,但AKI患者的肾脏排泄功能受损,容易出现容量负荷过重,而容量负荷过重会导致肾静脉压升高、肾间质水肿、肾灌注降低,并且会激活肾素-血管紧张素统,进而损伤肾组织,同时容量负荷过重会加重肺等肾外多脏器功能不全。这些均会加重AKI患者的病情,不利于肾功能的恢复。研究[18]显示 72 h内存在24 h液体负平衡>500 mL组患者病死率明显低于液体正平衡组,但肾功能恢复率差异无统计学意义。本研究同样根据72 h内是否存在24 h液体负平衡>500 mL分为负平衡组与非负平衡组,但两组间肾功能恢复率差异无统计学意义,分析得出72 h内液体负平衡不是影响患者肾功能恢复的危险因素。
NGAL、肝脂肪酶结合蛋白(liver fatly acid binding protein, LFABP)、IGFBP-7及TIMP-2为近年发现较新的临床标志物,有报道[19]提示这些生物标志物为 AKI 的早期诊断和治疗提供可能,对AKI预后同样存在一定预测价值,但多局限于大手术后,本研究将脓毒症AKI患者作为研究对象,对脓毒症AKI肾功能转归进行研究。
NGAL是脂质运载蛋白超家族中的一员,最早从人的中性粒细胞中发现,以共价形式与中性粒细胞明胶酶相结合, 可在人体的很多组织器官低水平表达,比如肾脏、胸腺、支气管、胃肠道、肺、胰腺等[20]。与既往多项研究[21-23]类似,本项研究表明血NGAL在恢复组患者早期浓度明显高于未恢复组。但尿NGAL在与肾功能恢复方面无明显相关性。
LFABP属于脂肪酸结合蛋白家族,在肝脏、肾脏等多个脏器均可表达,由于LFABP相对分子质量较小,于近端肾小管细胞损伤后膜通透性改变时可快速溢出,因此在早期肾损害时其血尿浓度即可迅速增高,在肾脏损伤和修复中扮演重要角色。既往研究[24-25]提示LFABP有预测AKI患者预后的能力。本研究提示该标志物浓度与肾功能恢复无明显相关性,考虑与样本量小、偏差较大有关。
TIMP-2、IGFBP-7第一次在一项两阶段多中心研究中发现并证实为标志物,既往研究[26-27]证实这两项指标在AKI的早期发现及预后方面均有重要价值,本研究结果表明尿TIMP-2对肾功能恢复有良好的预测性,但尿IGFBP-7则无明显预测价值。
但本课题属于小样本的单中心研究。多数患者入ICU时已非脓毒症AKI早期,多已进入少尿或无尿阶段需紧急行血滤治疗,入ICU即刻的化验选点本身存在一定差异,结果可能存在一些误差,且尚需更多大样本量、多中心的研究来进一步证明生物标志物联合临床指标是否更能准确地预测急性肾损伤患者的预后情况。
本课题提示年龄、有心功能不全及高血压疾病史、诊断脓毒症AKI内24 h APACHEⅡ 评分、肾外器官SOFA评分、KDIGO分期、脏器衰竭个数≥3个、血小板计数、乳酸浓度、肺部感染、合并呼吸衰竭、少尿、机械通气、应用血管活性药物、入组即刻血尿TIMP-2、IGFBP-7、血NGAL浓度均与肾功能恢复有关,其中早期APACHEⅡ 评分、肾外SOFA评分、诊断脓毒症AKI即刻血NGAL、尿TIMP-2浓度可有效预测肾功能恢复。
[1] Hsu C Y, McCulloch C E, Fan D, et al. Community-based incidence of acute renal failure[J].Kidney Int,2007,72(2):208-212.
[2] Zeng X, McMahon G M, Brunelli S M, et al. Incidence, outcomes, and comparisons across definitions of AKI in hospitalized individuals[J]. Clin J Am Soc Nephrol, 2014, 9(1):12-20.
[3] Shinjo H, Sato W, Imai E, et al. Comparison of kidney injury network criteria for assessing patients in intensive care units[J]. Clin Exp Nephrol,2014,18(5):737-745.
[4] Fang Y, Ding X, Zhong Y,et al. Acute kidney injury in a Chinese hospitalized population[J].Blood Purif,2010,30(2):120-126.
[5] KDIGO Acute Kidney Injury Working Group. Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for acute kidney injury[J]. Kidney Int Suppl, 2012,2:1-138.
[6] Hoste E A, Lameire N H, Vanholder R C,et al. Acute renal failure in patients with sepsis in a surgical ICU:predictive factors,incidence,comorbidity,and outcome[J].J Am See Nephrol, 2003,14:1022-1030.
[7] Macedo E,Mehta R L.Renal recovery after acute kidney injury[J].Contrib Nephrol,2016,187: 24-35.
[8] 张丽琴,邢昌赢,解林花. 重症急性肾损伤患者经连续性肾脏替代治疗后肾功能恢复的影响因素[J].现代医学生物进展,2014,14(8):1490-1493.
[9] Schiffl H, Fischer R. Five-year outcomes of severe acute kidney injury requiring renal replacement therapy[J]. Nephrol Dial Transplant,2008,23(7):2235-2241.
[10] Lins R L, Elseviers M M, Daelemans R, et al. Re-evaluation and modification of the stuivenberg hospital acute renal failure (SHARF) scoring system for the prognosis of acute renal failure: an independent multicentre, prospective study[J].Nephrol Dial Transplant, 2004,19(9):2282-2288.
[11] Lopes J A, Jorge S, Resina C, et al. Acute kidney injury in patients with sepsis:a contemporary analysis[J].Int J Infect Dis, 2009,13(2):176-181.
[12] Abelha F J, Botelho M, Fernandes V,et al.Determinants of postoperative acute kidney injury[J].Crit Care,2009,13(3):R79.
[13] Demirkiliç U, Kuralay E, Yenicesu M, et al. Timing of replacement therapy for acute renal failure after cardiac surgery[J].J Card Surg,2004,19(1):17-20.
[14] Piccinni P, Dan M, Barbacini S, et al. Early isovolaemic haemofiltration in oliguric patients with septic shock[J].Intensive Care Med,2006,32(1):80-86.
[15] Bagshaw S M, Uchino S, Bellomo R, et al. Timing of renal replacement theraphy and clinical outcomes in critically ill patients with severe acute kidney injury[J].J Crit Care,2009,24(1):129-140.
[16] Oppert M, Engel C, Brunkhorst F M, et al.Acute renal failure in patients with severe sepsis and septic shock a significant independent risk factor for mortality:results from the german prevalence study[J].Nephrol Dial Transplant, 2008,23(3):904-909.
[17] Chen H, Wu B, Gong D, et al. Fluid overload at start of continuous renal replacement therapy is associated with poorer clinical condition and outcome: a prospective observational study on the combined use of bioimpedance vector analysis and serum N-terminal pro-B-type natriuretic peptide measurement[J].Crit Care,2015,19:135.
[18] Bagshaw S M, George C, Bellomo R. Early acute kidney injury and sepsis:a multicentre evaluation[J].Crit Care, 2008,12(2):R47.
[19] Endre Z H. Recovery from acute kidney injury: the role of biomarkers[J]. Nephron Clin Pract, 2014,127(1-4):101-105.
[20] Singer E, Markó L, Paragas N, et al. Neutrophil gelatinase-associated lipocalin:Pathophysiology and clinical applications[J]. Acta Physiol, 2013,2007(4):663-672.
[21] Mårtensson J, Bell M, Oldner A, et al.Neutrophil gelatinase-associated lipocalin in adult septic patients with and without acute kidney injury[J]. Intensive Care Med,2010,36( 8) : 1333-1340.
[22] Srisawat N, Murugan R, Lee M, et al. Plasma neutrophil gelatinase-associated lipocalin predicts recovery from acute kidney injury following community-acquired pneumonia[J].Kidney International,2011,80(5): 545-552.
[23] Park S O, Ahn J Y, Lee Y H, et al. Plasma neutrophil gelatinase-associated lipocalin as an early predicting biomarker of acute kidney injury and clinical outcomes after recovery of spontaneous circulation in out-of-hospital cardiac arrest patients[J].Resuscitation, 2016,101:84-90.
[24] Parr S K, Clark A J, Bian A, et al. Urinary L-FABP predicts poor outcomes in critically ill patients with early acute kidney injury[J].Kidney Int,2015,87(3) : 640-648.
[25] Doi K, Noiri E, Maeda-Mamiya R, et al. Urinary L-type fatty acid-bindingprotein as a new biomarker of sepsis complicated with acute kidney injury[J].Crit Care Med,2010,38(10) : 2037-2042.
[26] Hoste E A, McCullough P A, Kashani K, et al. Derivation and validation of cutoffs for clinical use of cell cycle arrest biomarkers[J].Nephrol Dial Transplant, 2014,29(11):2054-2061.
[27] Bihorac A, Chawla L S, Shaw A D, et al. Validation of cell-cycle arrest biomarkers for acute kidney injury using clinical adjudication[J]. Am J Respir Crit Care Med, 2014,189(18):932-939.
