复方阿苯达唑/伊维菌素及其单药的体内外致突变性研究
2018-01-29邓林龚玲杨家书赖诗韵陈阳林居纯
邓林,龚玲,杨家书,赖诗韵,陈阳,林居纯
四川农业大学动物医学院, 成都 611130
复方阿苯达唑/伊维菌素作为生猪养殖上常用的寄生虫病防治药物,具有良好的药效,能驱杀大部分的线虫、绦虫及节肢动物,其主要成分为阿苯达唑和伊维菌素。其中,伊维菌素主要对各种线虫和节肢动物具有良好的驱杀作用[1],而阿苯达唑则主要对线虫和绦虫等具有明显的驱杀作用[2]。相关的毒理学研究显示,伊维菌素通过与哺乳动物中枢神经系统中的门控氯离子通道结合增加γ-氨基丁酸的释放,从而产生中枢毒性[3-4]。而阿苯达唑则能与细胞中的微球蛋白结合阻断微丝的形成,或者干扰糖原的合成[5-6]。Gao等[7]发现土壤中残留的阿苯达唑及其代谢产物能影响生态环境中的哨兵动物——蚯蚓的繁殖,表明其具有一定程度的环境危害。目前,关于复方阿苯达唑/伊维菌素的毒理学研究较少。为了解阿苯达唑和伊维菌素组成复方后致突变性的变化情况,同时也为兽医临床使用和环境危害评估提供参考。通过Ames试验、小鼠骨髓微核试验、小鼠精子畸变试验对复方阿苯达唑/伊维菌素及其单药进行了体内外的致突变性研究。
1 材料与方法(Materials and methods)
1.1 受试系统
健康昆明种小鼠,SPF级,购自成都达硕生物科技有限公司,动物合格号:0016916。组氨酸缺陷型鼠伤寒沙门氏菌株TA97、TA98、TA100、TA102,由中国农业大学国家新兽药安全评价中心惠赠。
1.2 受试药物
伊维菌素,纯度≥95.4%,批号:CN01315;阿苯达唑,纯度≥99.0%,批号:140928,以上药物由拜耳(四川)动物保健有限公司惠赠。复方阿苯达唑/伊维菌素按拜耳(四川)动物保健有限公司提供配方制备,其中阿苯达唑和伊维菌素比例为24:1。用0.5%羧甲基纤维素钠溶液将阿苯达唑和伊维菌素按比例配成不同浓度的复方阿苯达唑/伊维菌素混悬液备用。
1.3 试剂
敌克松,纯度>98%,购自Sigma-Aldrich上海(贸易)有限公司;二氨基芴,纯度>98%,购自Sigma-Aldrich上海(贸易)有限公司;1,8-二羟基蒽醌,纯度>96%,购自Sigma-Aldrich上海(贸易)有限公司;叠氮钠,纯度>99.5%,购自博大泰克生物技术有限公司;注射用环磷酰胺,购自江苏恒瑞医药股份有限公司;二甲亚砜,分析纯,购自西陇化工股份有限公司;甲醇,分析纯,购自西陇化工股份有限公司;灭活小牛血清,购自浙江天杭生物科技有限公司;羧甲基纤维素钠,分析纯,购自成都市科龙化工试剂厂;吉姆萨染色液和2%伊红染液为自配。S9为本实验室通过多氯联苯(PCB)诱导大鼠获得的肝脏匀浆上清液,且经鉴定合格[8]。
1.4 Ames试验
采用组氨酸缺陷型鼠伤寒沙门氏菌的TA97、TA98、TA100、TA102作为本次试验的检测菌株。根据预实验结果,用二甲亚砜分别溶解伊维菌素、阿苯达唑和复方阿苯达唑/伊维菌素并配制成50.00 mg·mL-1的溶液。以该浓度为最高浓度,将3种受试药物溶液分别按5倍比例稀释成10.00 mg·mL-1、2.00 mg·mL-1、0.40 mg·mL-1、0.08 mg·mL-1系列浓度,溶剂对照组为二甲亚砜,不加S9的TA97、TA98、TA102的标准阳性对照为敌克松(每个培养皿中50.00 μg)、不加S9的TA100标准阳性对照为叠氮钠(每个培养皿中1.50 μg)、加S9的TA97、TA98、TA100的标准阳性对照为二氨基芴(每个培养皿中10.00 μg),加S9的TA102的标准阳性对照为1,8-二羟基蒽醌(每个培养皿中50.00 μg)。另设空白对照以观察自发回变菌落数。分别取0.1 mL增菌液和受试药物加入2 mL顶层培养基中混匀后,倒入底层培养基并均匀覆盖。于37 ℃生化培养箱中经过48 h培养后,计数每皿回变菌落数。试验将在含有S9不含S9 这2种不同代谢活化条件下进行,每个剂量3个平行[8]。
1.5 骨髓细胞微核试验
70只体重在18~22 g的健康昆明小鼠按体重随机分为7组,每组10只,雌雄各半。根据先前急性毒性试验结果(半数致死量,LD50=1 501.18 mg·kg-1)设复方阿苯达唑/伊维菌素组高、中、低剂量分别为360.28/15.01 mg·kg-1(1/4LD50),180.14/7.51 mg·kg-1(1/8LD50)和90.07/3.75 mg·kg-1(1/16LD50),并以高剂量组各成分对应的剂量分别作为伊维菌素单药组(15.01 mg·kg-1)和阿苯达唑单药组(360.28 mg·kg-1)的剂量,以比较单药与复方的毒性差异。用0.5%的羧甲基纤维素钠溶液将药物制备成混悬液。另设阴性对照组(0.5%的羧甲基纤维素钠溶液)和环磷酰胺(CP)阳性对照(40.00 mg·kg-1)。
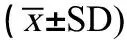
表1 复方阿苯达唑/伊维菌素Ames试验各组菌落计数Table 1 The bacteria counting of compound albendazole and ivermectin groups in Ames test (±SD)
注: “/”表示不加S9的TA97、TA98、TA102,其标准阳性对照敌克松剂量为50.00 μg·皿-1;不加S9的TA100,其标准阳性对照叠氮钠剂量为1.50 μg·皿-1;加S9的TA97、TA98、TA100,其标准阳性对照二氨基芴的剂量为10.00 μg·皿-1;加S9的TA102,其标准阳性对照1,8-二羟基蒽醌的剂量为50.00 μg·皿-1。
Note: “/” in the table indicated Dexon, the positive control of TA97, TA98 and TA102 without S9, added into the plate was 50.00 μg·plate-1; NaN3, the positive control of TA100 without S9, added into the plate was 1.50 μg·plate-1; 2-Aminofluorene, the positive control of TA97, TA98 and TA100 with S9, added into the plate was 10.00 μg·plate-1; 1,8-Dihydroxyanthraquinone, the positive control of TA102 with S9, added into the plate was 50.00 μg·plate-1.
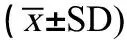
表2 伊维菌素Ames试验各组菌落计数Table 2 The bacteria counting of ivermectin groups in Ames test (±SD)
注: “/”表示不加S9的TA97、TA98、TA102,其标准阳性对照敌克松剂量为50.00 μg·皿-1;不加S9的TA100,其标准阳性对照叠氮钠剂量为1.50 μg·皿-1;加S9的TA97、TA98、TA100,其标准阳性对照二氨基芴的剂量为10.00 μg·皿-1;加S9的TA102,其标准阳性对照1,8-二羟基蒽醌的剂量为50.00 μg·皿-1。
Note: “/” in the table indicated Dexon, the positive control of TA97, TA98 and TA102 without S9, added into the plate was 50.00 μg·plate-1; NaN3, the positive control of TA100 without S9, added into the plate was 1.50 μg·plate-1; 2-Aminofluorene, the positive control of TA97, TA98 and TA100 with S9, added into the plate was 10.00 μg·plate-1; 1,8-Dihydroxyanthraquinone, the positive control of TA102 with S9, added into the plate was 50.00 μg·plate-1.
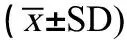
表3 阿苯达唑Ames试验各组菌落计数Table 3 The bacteria counting of albendazole groups in Ames test (±SD)
注:“/”表示不加S9的TA97、TA98、TA102,其标准阳性对照敌克松剂量为50.00 μg·皿-1;不加S9的TA100,其标准阳性对照叠氮钠剂量为1.50 μg·皿-1;加S9的TA97、TA98、TA100,其标准阳性对照二氨基芴的剂量为10.00 μg·皿-1;加S9的TA102,其标准阳性对照1,8-二羟基蒽醌的剂量为50.00 μg·皿-1。
Note: “/” in the table indicated Dexon, the positive control of TA97, TA98 and TA102 without S9, added into the plate was 50.00 μg·plate-1; NaN3, the positive control of TA100 without S9, added into the plate was 1.50 μg·plate-1; 2-Aminofluorene, the positive control of TA97, TA98 and TA100 with S9, added into the plate was 10.00 μg·plate-1; 1,8-Dihydroxyanthraquinone, the positive control of TA102 with S9, added into the plate was 50.00 μg·plate-1.

表4 复方阿苯达唑/伊维菌素及其单药对小鼠骨髓微核率的影响(n=10)Table 4 The effect of the combination and its components of albendazole and ivermectin on micronucleus rate in mice (n=10)
注: “*”表示与阴性对照组比较,差异显著(0.01 Note: “*” indicated significant difference (0.01 各组均采用经口灌胃染毒,灌胃容积为0.2 mL·(10 g)-1。采用30 h染毒法,于末次染毒后6 h处死小鼠。取小鼠股骨,去除两端骨骺,用小牛血清反复吹洗骨髓于玻片上,常规涂片并自然干燥后经甲醇固定,吉姆萨染色,油镜下计数嗜多染红细胞微核率、嗜多染红细胞与正染红细胞比值(PCE/NCE)[9,11]。 35只体重在25~30 g的健康雄性昆明小鼠按体重随机分为7组,每组5只。给药组(复方阿苯达唑/伊维菌素、伊维菌素、阿苯达唑)、阴性对照组的剂量设置与给药途径同小鼠骨髓微核试验,给药频率为每日1次,连续给药5 d。CP阳性对照腹腔注射一次,剂量为50.00 mg·kg-1。在首次染毒后第35天处死小鼠,取两侧附睾制成涂片,经甲醇固定后,伊红染色,光镜下计数精子总数及各类畸形精子数。每只小鼠检查1 000个精子,计算精子畸形率及畸形类型构成比[10-11]。 Ames试验中,如在背景菌苔生长良好条件下,受试回变菌落数增加一倍以上,并有剂量反应关系或至少某一测试点超过对照2倍以上有可重复的并有统计学意义的阳性反应,即可认为该受试物为诱变阳性[8]。 微核试验和精子畸变试验的数据使用SAS 9.0软件FREQ程序对给药各组与阴性对照组微核率和精子畸变率进行差异性分析和趋势检验。对微核试验中的PCE/NCE比值进行t检验。PCE/NCE大于或等于1,说明受试物对骨髓细胞没有毒性,反之则有毒性;PCE/NCE小于0.05则结果不可信[9-10]。 对培养48 h的平板进行观察,发现所有平板上均可见生长良好的背景菌苔,在加S9和不加S9条件下,复方阿苯达唑/伊维菌素及其单药组任何浓度中均未发现回复突变菌落数超过阴性对照组2倍以上,同时,每株菌在加S9和不加S9的情况下也并未表现出明显的量效关系。以上表明,复方阿苯达唑/伊维菌素及其单药对TA97、TA98、TA100、TA102菌株均无诱发突变作用(见表1,表2)。 小鼠骨髓微核试验结果表明,CP阳性对照组微核率明显高于阴性对照组(P≤0.01),显示阳性结果,PCE/NCE >0.05表明实验结果可靠。复方组3个剂量下均引起嗜多染红细胞微核率的升高,但只有高、中剂量组与阴性对照组具有统计学差异(P≤0.01)。伊维菌素和阿苯达唑单药组均明显提高了微核率(P≤0.01),但仅有阿苯达唑单药组的微核率明显高于相对应的复方高剂量组(P≤0.01)。阴性对照组和阳性对照组PCE/NCE均大于1,复方各组及两单药组PCE/NCE均小于1,并明显低于阴性对照组,说明了伊维菌素、阿苯达唑及其复方均对骨髓细胞有一定抑制作用(见表3,表4)。 表5 复方阿苯达唑/伊维菌素及其单药对小鼠精子畸形率的影响(n=5)Table 5 The effects of the combination and its components of albendazole and ivermectin on the sperm abnormalities of mice (n=5) 注:“*”表示与阴性对照组比较,差异显著(0.01 Note: “*” indicated significant difference (0.01 复方阿苯达唑/伊维菌素致小鼠精子畸变试验结果见表5、6。由表5可见,CP阳性对照组精子畸形率明显高于阴性对照,表明实验结果可靠。复方各组小鼠精子畸形率逐渐升高,其中高、中剂量组精子畸形率明显高于阴性对照组(P≤0.01)有量效关系。两单药组的精子畸形率也明显高于阴性对照组(P≤0.01),在单药组和复方组的比较中也发现,伊维菌素单药组(0.01 Ames试验是一种经典的体外遗传毒性评价方法,并以出现基因突变为试验终点,常用于检测受试物是否具有致基因出现点突变能力[12]。已有的研究显示,伊维菌素和阿苯达唑没有致突变作用[6,13]。本次研究结果表明,在加与不加S9条件下,伊维菌素和阿苯达唑对TA97、TA98、TA100、TA102菌株均无诱发突变作用,与已有报道一致。而由二者按1:24形成的固定剂量复方也表现出与单药一致的致突变阴性,表明伊维菌素与阿苯达唑在此比例下形成的复方其诱变性未发生改变。 微核是存在于胞浆中独立的核小体,它是由染色体断裂产生无着丝粒的断片或由于纺锤丝断裂造成一条或一组染色体滞留在胞质中而形成,可由外界因素诱导或自发性产生[14]。小鼠骨髓微核试验结果表明,复方组总剂量高于187.65 mg·kg-1时能明显提高小鼠骨髓嗜多染红细胞的微核率,且各剂量组PCE/NCE比值均小于1,表明复方阿苯达唑/伊维菌素对骨髓细胞有抑制作用。伊维菌素单药组和阿苯达唑单药组均明显提高了微核率,与Ermler等[15]和Ashmawy等[16]的报道相一致。阿苯达唑作为一种已知的纺锤体抑制剂,其作用靶标为纺锤丝[17],显然能造成微核的形成。体外试验发现伊维菌素能造成单股DNA断裂[18]。因此,推测复方阿苯达唑/伊维菌素可能从纺锤体和DNA两方面产生致突变作用,从而增强毒性。然而,对比复方组和单药组的微核率发现,阿苯达唑单药组的微核率明显高于复方组,而伊维菌素单药组的微核率与复方组之间无统计学差异,可见复方阿苯达唑/伊维菌素不但没出现毒性增强,相较于单药其毒性反而下降。 表6 复方阿苯达唑/伊维菌素及其单药对小鼠精子畸形类型构成的影响(n=5)Table 6 The effects of the combination and its components of albendazole and ivermectin on the sperm abnormality types of mice (n=5) 小鼠精子致畸试验结果显示,复方组总剂量高于187.65 mg·kg-1时精子畸形率明显高于阴性对照组(P≤0.01),且具有明显的量效关系,说明复方阿苯达唑/伊维菌素对小鼠雄性生殖细胞具有致突变性。然而,在Otubanjo和Mosuro[19-20]等进行的阿苯达唑精子致畸试验中并未观察到阳性结果,同时在他们进行的伊维菌素的精子致畸试验中仅观察到精子畸形率的轻度增高,但并未明显高于阴性对照且无剂量相关性。本次研究中,阿苯达唑和伊维菌素的剂量均高于Otubanjo和Mosuro的研究剂量,说明了在高剂量情况下,阿苯达唑和伊维菌素均能对小鼠雄性生殖细胞产生毒性。从复方和单药精子畸形率差异可知,复方诱导的小鼠精子畸形率明显低于两单药组。由此可见,复方毒性相较于单药有所降低,同时畸形种类分布上也有较大差异,其机制有待进一步研究。 伊维菌素和阿苯达唑按1:24的比例形成的复方在Aems试验中表现出同单药一样的致突变阴性,而在小鼠骨髓微核试验和小鼠精子畸变试验中却表现出较单药更低的毒性,显示了复方的优越性,其原因可能是伊维菌素和阿苯达唑在药动学上的相互作用,并且已有大量的研究表明伊维菌素和阿苯达唑联合应用会导致各自药动学参数的改变。虽然,复方阿苯达唑/伊维菌素表现出了较单药更低的毒性,但是,其仍然是一种能引起小鼠骨髓微核率和精子畸变率升高的致突变阳性药物。鉴于其在农业生产上应用广泛,需警惕该药物的食品残留问题及对生态环境的危害。 [1] 李铭, 冯伟, 崔玉, 等. 阿维菌素类药物毒理学研究进展[J]. 安徽农学通报, 2013, 19(20): 29-32 Li M, Feng W, Cui Y, et al. Research advances of avermectins toxicology [J]. Anhui Agriculture Science Bulletin, 2013, 19(20): 29-32 (in Chinese) [2] 陈常青. 阿苯达唑的临床应用[J]. 中外健康文摘, 2013, 10(38): 153-154 Chen C Q. Clinical application of albendazole [J]. The Chinese and Foreign Health Abstract, 2013, 10(38): 153-154 (in Chinese) [3] 董仲生, 李顺存, 邓妮娟, 等. 家畜伊维菌素中毒的研究[J]. 中国畜牧兽医, 2009, 36(8): 150-153 Dong Z S, Li S C, Deng N J, et al. Research on ivermectin toxicosis of domestic animal [J]. China Animal Husbandry and Veterinary Medicine, 2009, 36(8): 150-153 (in Chinese) [4] 李力, 徐颖, 杨卫超, 等. 阿维菌素类近期毒理学研究进展[J]. 医学动物防制, 2010, 7(26): 608-610 Li L, Xu Y, Yang W C, et al. Recent advances in toxicology of avermectins [J]. Chinese Journal of Pest Control, 2010, 7(26): 608-610 (in Chinese) [5] 张吉丽, 李冰, 周绪正, 等. 动物抗寄生虫药物作用机理研究进展[J]. 中国畜牧兽医, 2016, 43(1): 242-247 Zhang J L, Li B, Zhou X Z, et al. Research progress on action mechanism of animal anti-parasitical drugs [J]. China Animal Husbandry and Veterinary Medicine, 2016, 43(1): 242-247 (in Chinese) [6] Dayan A D. Albendazole, mebendazole and praziquantel. Review of non-clinical toxicity and pharmacokinetics [J]. Acta Tropica, 2003, 86(2-3): 141-159 [7] Gao Y H, Xue M L, Guo J J, et al. Reproductive responses of the earthworm (Eiseniafetida) to antiparasitic albendazole exposure [J]. Chemosphere, 2015, 120: 1-7 [8] 中华人民共和国国家质量监督检验检疫总局. GB15193.4—2003 鼠伤寒沙门氏菌/哺乳动物微粒体酶试验[S]. 北京: 中国标准出版社, 2003 General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB15193.4—2003Salmonellatyphimurium/mammals microsomal enzyme test [S]. Beijing: Standards Press of China, 2003 (in Chinese) [9] 王心如. 毒理学实验方法与技术[M]. 北京: 人民卫生出版社, 2003: 70-71 Wang X R. Experimental Methods and Techniques of Toxicology [M]. Beijing: People's Medical Publishing House, 2003: 70-71 (in Chinese) [10] 袁伯俊, 廖明阳, 李波. 药物毒理学试验方法与技术[M]. 北京: 化学工业出版社, 2007: 294-296 Yuan B J, Liao M Y, Li B. Drug Toxicological Method and Technic [M]. Beijing: Chemical Industry Press, 2007: 294-296 (in Chinese) [11] 农业部兽药评审中心. 兽药研究技术指导原则汇编2006-2011年[M]. 北京: 化学工业出版社, 2012: 200-207 Veterinary Drug Center for Drug Evaluation of the Ministry of Agriculture. Compilation of guidelines for veterinary drug research 2006-2011 [M]. Beijing: Chemical Industry Press, 2012: 200-207 (in Chinese) [12] 范玉明, 李毅民, 张舒, 等. 药物安全性评价[M]. 北京: 化学工业出版社, 2006: 162-169 Fan Y M, Li Y M, Zhang S, et al. Drug Safety Evaluation [M]. Beijing: Chemical Industry Press, 2006: 162-169 (in Chinese) [13] Novik T S, Baru R V, Riabova V A, et al. Assessment of the mutagenic activity of aversectin C [J]. Antibiotics and Chemotherapy, 1999, 44(7): 16-20 [14] 彭双清, 郝卫东. 药物安全性评价关键技术[M]. 北京: 军事医学科学出版社, 2013: 601-602 Peng S Q, Hao W D. Key Technologies of Drug Safety Evaluation [M]. Beijing: Military Medical Science Press, 2013: 601-602 (in Chinese) [15] Ermler S, Scholze M, Kortenkamp A. Seven benzimidazole pesticides combined at sub-threshold levels induce micronucleiinvitro[J]. Mutagenesis, 2013, 28(4): 417-426 [16] Ashmawy I M, Nahas A F, Bayad A E. Teratogenic and cytogenetic effects of ivermectin and its interaction with P-glycoprotein inhibitor [J]. Research in Veterinary Science, 2011, 90(1): 116-123 [17] Tweats D J, Johnson G E, Scandale I, et al. Genotoxicity of flubendazole and its metabolitesinvitroand the impact of a new formulation oninvivoaneugenicity [J]. Mutagenesis, 2016, 31: 309-321 [18] Molinari G, Soloneski S, Reigosa M A, et al.Invitrogenotoxic and cytotoxic effects of ivermectin and its formulation ivomec on Chinese hamster ovary (CHOK1) cells [J]. Journal of Hazard Materials, 2009, 165(1-3): 1074-1082 [19] Otubanjo O A, Mosuro A A, Ladipo T F. Aninvivoevaluation of induction of abnormal sperm morphology by ivermectin MSD (Mectizan) [J]. Pakistan Journal of Biological Sciences, 2007, 10(1): 90-95 [20] Otubanjo O A, Mosuro A A. Aninvivoevaluation of induction of abnormal sperm morphology by some anthelmintic drugs in mice [J]. Mutation Research, 2001, 497(1-2): 131-1381.6 小鼠精子畸变试验
1.7 数据统计分析及结果判定
2 结果(Results)
2.1 Ames试验结果
2.2 骨髓细胞微核试验结果
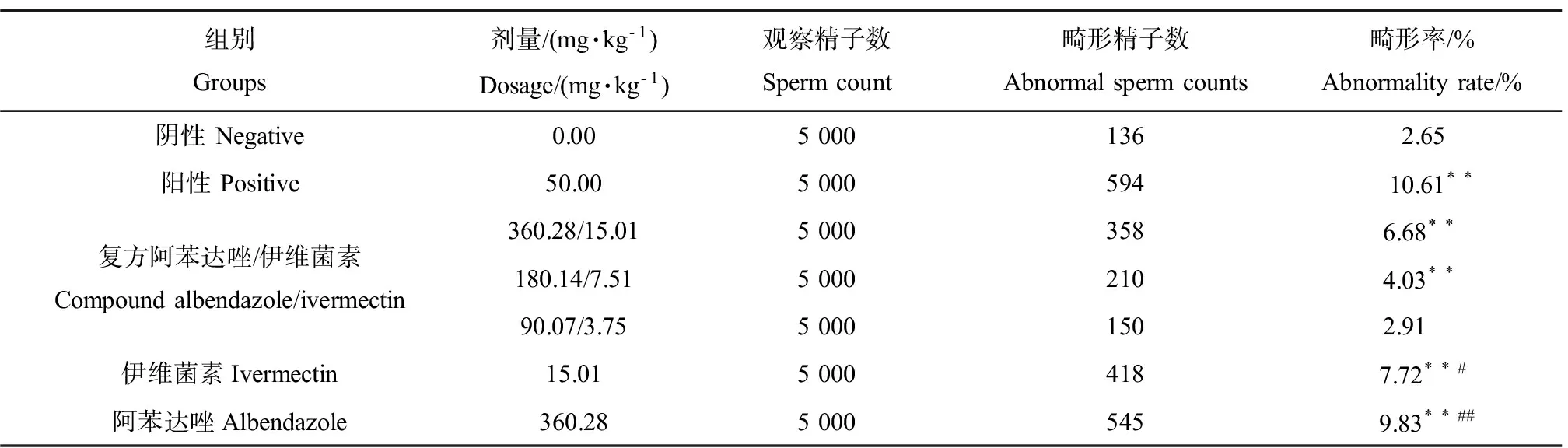
2.3 小鼠精子畸变试验
3 讨论(Discussion)

