甲基异噻唑啉酮对斑马鱼胚胎的急性毒性和机制研究
2018-01-29吕鹏吴巍刘丽丽张家禹许雷闫艳春
吕鹏,吴巍,刘丽丽,张家禹,许雷,闫艳春
中国农业科学院研究生院,生化与分子生物学实验室,北京 100081
近年来,我国从欧洲引进了一种新型杀菌剂甲基异噻唑啉酮(methylisothiazolinone,MIT),是异噻唑啉酮类衍生物,和其他同类衍生物相比毒性较弱[1-2]。MIT是一种高效、广谱、药效持久且相对安全的杀菌剂,广泛应用于工业生产,如涂料、胶水、造纸业、橡胶、感光胶片及洗涤用品等[2-5]。优点是有效用量少,极易混合在各类配方中,能很好地抑制微生物的生长,因此MIT被广泛添加进化妆品和个人护理品制剂中,以延长保存期[1-3, 7-9]。生产的工业废水、生活污水中大量MIT随地下水循环系统等途径进入环境水体中,已有研究者在污水口和河流中检测到了相当量的MIT存在[8, 10-11]。尽管也有报道显示MIT在水体中含量为ng·L-1级,且在自然环境中半衰期很短[11],然而持续排放入水体而残留下来的MIT是否危害水生生物的生存,影响水生生态的健康,需要进一步研究。
文献报道,MIT对黑斑蛙胚胎的96 h-LC50和半数致畸浓度(96 h-TC50)分别为5.30 mg·L-1和2.36 mg·L-1,最小生长抑制浓度(MCIG)为2.59 mg·L-1,对蝌蚪的96 h-LC50为7.58 mg·L-1 [12],对草鱼肝脏肾脏器官的细胞,在48 h后,温度分别为15 ℃和25 ℃下的LC50范围为0.53 mg·L-1和0.41 mg·L-1[13],对卤虫无节幼体96 h-LC50为10.4 mg·L-1 [14]。还有研究表明MIT对小鼠表皮和呼吸系统的免疫应答有强烈刺激作用,接触2.5%的MIT处理液就能引起小鼠皮肤过敏反应和刺激性皮肤炎[15-16]。随着异噻唑啉酮类其他衍生物控制力度的加大,使异噻唑啉酮类物质的危害淡出了人们的视线,且MIT对鱼类毒性数据还很欠缺,所以对于水体中残留的MIT对鱼类的影响评价不足。但是MIT作为目前最广泛使用的异噻唑啉酮类物质,其在水中残留和对鱼类的威胁也应该引起重视[7,9,15]。
斑马鱼作为毒理学模式动物,具有遗传背景清晰,体型小,产卵量大,胚胎发育迅速,早期透明,可清晰看到发育各阶段,便于观察和显微操作等特点。斑马鱼胚胎也广泛应用于急性毒性实验中,评价各种化学物质的毒性作用[17-20]。本研究以斑马鱼胚胎为模型,根据OECD实验标准(OECD Guidelines for the Testing of Chemicals)[21],进行急性毒性实验,评价MIT对斑马鱼胚胎的毒性效应,为MIT的环境污染管控提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
AB品系斑马鱼购自国家斑马鱼资源中心(China Zebrafish Resource Center, CZRC)。
仪器设备:斑马鱼养殖系统(爱生科技发展有限公司,北京);雷磁PHS-3D型pH计(精密科学仪器有限公司,上海);电导度测试仪(哈纳公司,意大利);BPC-250 F型生化培养箱(一恒科学仪器有限公司,上海);荧光显微镜X83(奥林巴斯,日本);Heal Force超纯水系统(力康集团,香港);一次性吸管和培养皿(康健华医疗用品有限公司,江苏);塑料六孔细胞培养板(耐思生物科技有限公司,无锡);精密型pH试纸(sigma公司,美国)。
试剂药品:甲基异噻唑啉酮(MIT, CAS NO: 2682-20-4; 99%,百灵威,中国);吖啶橙(acridine orange, CAS: 10127-02-3,索莱宝,中国);霉链蛋白酶(protease,CAS: 37259-58-8, Qiagen公司,德国);三卡因甲磺酸盐麻醉剂(tricaine methanesulfonate, TMS, CAS: 886-86-2, Sigma公司,美国);氯化钠、碳酸氢钠等化学药品均为分析纯,购自国药集团化学试剂有限公司。
1.2 实验生物
斑马鱼的养殖方法:实验用AB品系斑马鱼在自动水循环养殖系统中进行饲养,系统自动维持养鱼水的电导度在500~550 μS·cm-1之间,pH 为7.0~7.5,溶解氧>6.0 mg·L-1,水温控制在(28±0.5) ℃,饲养环境光周期为光:暗=14 h:10 h。每天喂食新鲜丰年虫幼虫2~3次,幼虫由丰年虫卵(Aquamaster公司,中国台湾)孵化得到。孵化时,将丰年虫卵放于25 g·L-1氯化钠溶液中,水温(28±0.5) ℃,持续通气,连续光照32 h即可孵化,收集幼虫后去除杂质并用清水洗去过多盐分,可短期存放于4 ℃冰箱,或于-20 ℃下冻存[22]。
斑马鱼胚胎的收集方法:于前一天晚上将成年种鱼按照雌雄比例2:2装入交配盒中,并用隔板将雌雄鱼分开。第2天早上光照开始时(10 h后)将隔板抽出,待雌雄鱼追尾交配30 min后收集发育时期一致的健康胚胎[18, 24-25]。将收集到的胚胎混合均匀,换干净的养鱼水于培养皿中,作实验材料。
1.3 实验方法
1.3.1 斑马鱼胚胎毒性实验
为保证对照组胚胎死亡率小于5%,排除未受精及异常胚胎对毒性评价的干扰,本实验选择在受精后3 h (3 hours post-fertilization,3 hpf)开始暴露染毒。收集到胚胎3 h后,去除异常和死胚,并在倒置显微镜下挑出正常分裂的胚胎。MIT浓度范围根据预实验结果设置,将提前配制的1.0 g·L-1MIT储备液用养鱼水依次稀释到1.52、3.71、5.43、7.12、9.48 mg·L-1,包含1个对照组,各制备500 mL处理液(避光保存)。每个处理组包含3个生物学重复,20个胚胎为一个重复。实验在6孔板中进行,每孔加入10个健康的3 hpf胚胎,尽量去除水分之后再分别加入不同浓度的处理液10 mL,对照组加入等体积养鱼水。采用半静态方式进行暴露处理,将培养皿置于恒温生化培养箱中,暴露总时间为96 h(即从3 hpf~99 hpf),培养箱孵化温度为(28±0.5) ℃,处理液pH维持在7.0,电导率约510 μs·cm-1,溶氧量>6 mg·L-1,保持胚胎处理过程中光:暗=14 h:10 h。本实验处理条件比较稳定,预实验中对处理液监测和高效液相色谱分析结果显示,换水前后处理液性质和MIT浓度保持恒定,所以采用换水式对斑马鱼胚胎进行毒性实验[18-19, 24],即每24小时更换一次处理液,及时挑出死亡的胚胎。每24小时对斑马鱼胚胎进行一次镜检观察,测量不同时期的各项生理指标和死亡、畸形等数据,进行记录。
1.3.2 细胞凋亡吖啶橙染色
吖啶橙染色用于检测细胞凋亡情况,实验流程参照文献[20, 25]。
具体方法为:选取半致死浓度1/10左右的浓度作为处理起始浓度,依次设置MIT浓度为0.5 mg·L-1、0.75 mg·L-1、1.0 mg·L-1、2.0 mg·L-1。处理72 h后,收集存活胚胎,用养鱼水清洗2~3次后,对没脱膜的胚胎使用5 mg·mL-1链蛋白酶在25 ℃下脱膜2 min,再用养鱼水清洗2~3次,显微镜下选出存活、完整的胚胎放于培养皿中,以备染色。
染色方法:将提前配好的吖啶橙1 g·L-1储备液用养鱼水稀释到2 mg·L-1,将脱膜后的胚胎转移到2 mg·L-1的吖啶橙溶液中,避光染色30~60 min,定时观察,当胚胎出现死亡时可以终止染色。染色终止后用养鱼水润洗胚胎2~3次。清洗完毕后,使用0.1 g·L-1Tricaine麻醉剂处理5~10 min。待胚胎麻醉,在荧光显微镜下观察并拍照,所有照片拍摄条件均相同,观察带有黄绿色荧光标记的凋亡细胞。
1.3.3 统计分析
在急性毒性实验过程中,每24小时记录一次胚胎死亡数,24 h时记录胚胎自主抽动次数,48 h后统计孵化胚胎数,96 h后统计存活的幼鱼数量,以及存活胚胎的畸形数,并在显微镜下观察畸形状况,测量正常幼鱼72 h时的心率、96 h体长等生理特征,并分析胚胎-幼鱼运动、反应等行为学特征。
毒理学数据统计:斑马鱼胚胎的孵化从48 hpf开始,本实验统计处理后48 h(51 hpf)胚胎的孵化率。并以处理浓度为自变量x,胚胎孵化率为因变量y,使用SPSS 22软件,用单因素方差分析(one-way ANOVA)法分析处理组和对照组之间孵化率差异的显著性。采用Origin Pro 15软件处理96 h死亡率和畸形率数据,由logistic非线性回归分析,得到“剂量-效应”曲线方程,计算MIT的96 h-LC50和96 h-TC50及95%的置信区间。
形态和生理特征分析:选取72 h存活的幼鱼,在体视显微镜下统计胚胎心率,处理到96 h后观察幼鱼运动行为和应激反应情况,用0.1 g·L-1Tricaine麻醉剂处理5~10 min,每个处理组测量30个胚胎的体长,取平均值,使用SPSS 22中的T检验分析其最小生长抑制浓度和最低毒性效应剂量。
吖啶橙染色分析:选取不同角度,将处理组图片与对照组进行比对,找到凋亡细胞差异区域,排除本底荧光的干扰,分析处理组中凋亡细胞富集的范围,从而判断MIT的毒性作用区域。
2 结果(Results)
2.1 斑马鱼胚胎毒性实验
2.1.1 MIT对胚胎孵化率的影响
MIT处理液暴露48 h时,对斑马鱼胚胎的孵化率进行了统计。研究发现较低浓度的MIT对胚胎孵化就有抑制作用,在梯度浓度(0.5、1.0、2.0、4.0、6.0、8.0 mg·L-1)的MIT处理下,孵化率随浓度增大而降低。对照组孵化率为31.96%,MIT浓度大于1.0 mg·L-1时,孵化率显著下降,当浓度大于4.0 mg·L-1后,孵化率低于15%,使用SPSS 22软件进行单因素方差分析((one-way ANOVA),得到不同处理浓度下孵化率之间差异显著性(图1所示)。

图1 甲基异噻唑啉酮(MIT)处理48 h后对胚胎孵化率的影响注:A. MIT不同浓度处理组胚胎孵化率,数据表示为平均值±SE(n = 3, 每个生物重复20个胚胎),差异显著性用星号表示, *P<0.05, ** P<0.01, *** P<0.001;B. 孵化胚胎占存活胚胎的比例。Fig. 1 Effects of methylisothiazolinone (MIT) on hatching rate after 48 h exposure Note: A. Hatching rate at different concentration of MIT, values are presented as mean ± SEM (n = 3, 20 embryos in each replicate); * P < 0.05, ** P < 0.01; *** P < 0.001; B. Percentage of hatched embryos in survival embryos.
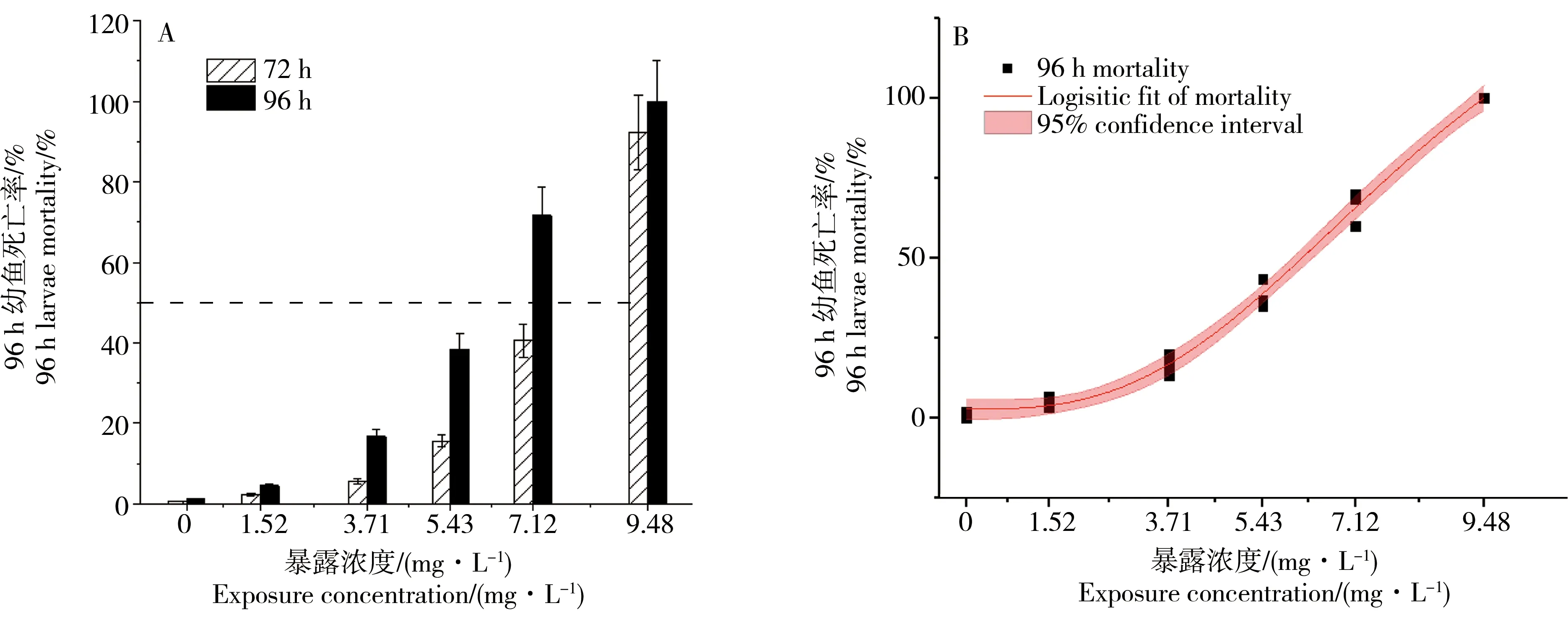
图2 MIT在72 h和96 h时对斑马鱼胚胎的致死率统计注:A. 致死率随浓度和处理时间递增,B. 96 h致死率logistic拟合,R2为0.9988(3个平行试验,n=3)。Fig. 2 Mortality of zebrafish embryos exposed to MIT after 72 h and 96 hNote: A. Mortality increased with time and concentration increasing; B. logistic nonlinear fitting of 96 h mortality, R2=0.9988 (three parallel tests, n=3).
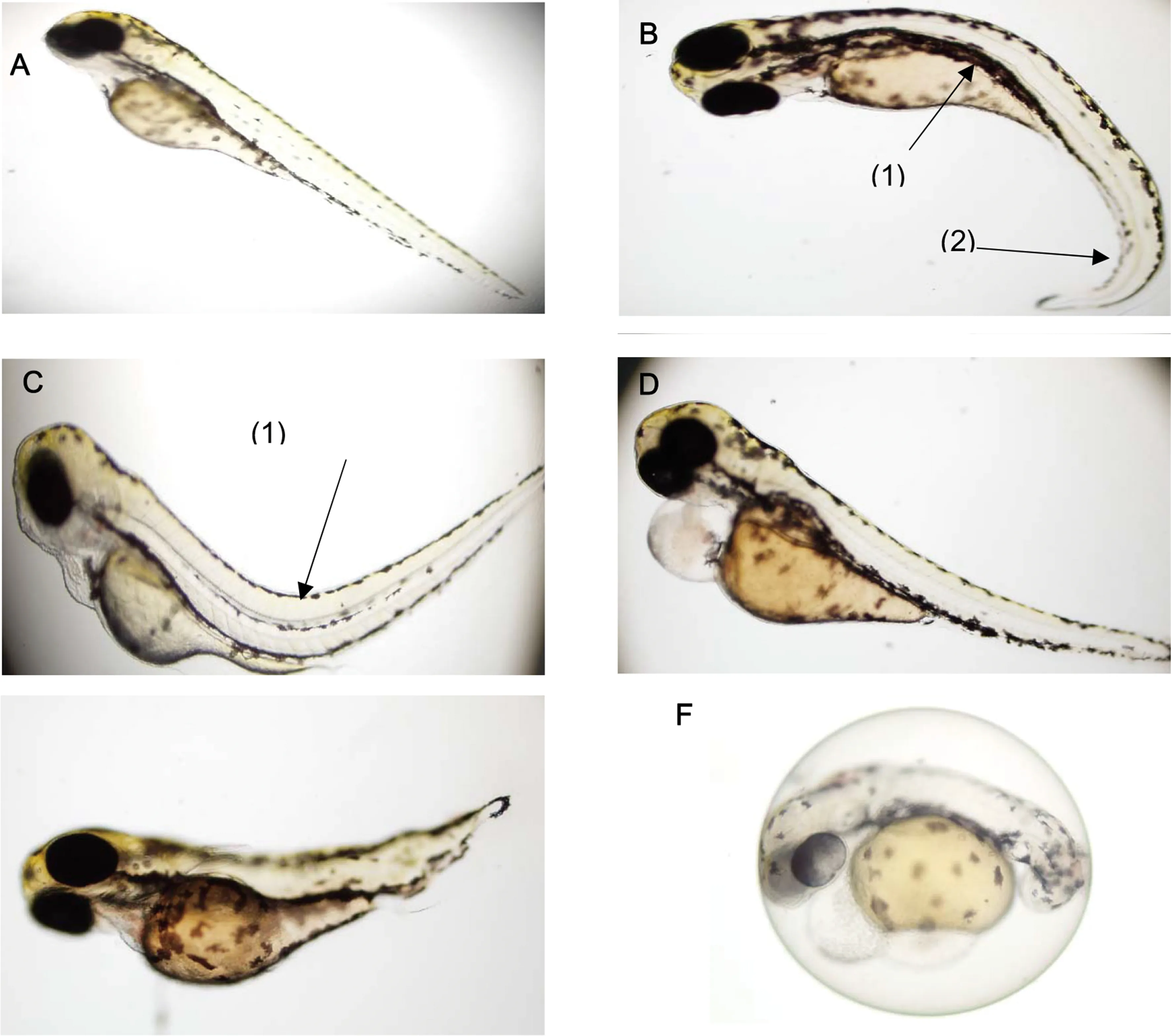
图3 MIT的致畸效应 注:A为96 h发育正常的幼鱼; B为体轴向内弯曲(1)和尾部畸形(2); C为体轴向外弯曲(1);D为心包囊肿和卵黄囊水肿;E为尾部发育不良;F为发育迟缓胚胎的畸形胚胎。Fig. 3 Teratogenesis effect of MITNote: A. normal control; B. body axon incurve (1) and tail dysmorphia (2); C. body axon outcurve (1); D. pericardial edema and yolk edema; E. tail dysontogenesis; F. embryos developmental retardation.
2.1.2 MIT对胚胎死亡率的影响
根据预实验结果,确定急性毒性实验MIT处理组浓度范围为1.52~9.48 mg·L-1。48 h前未孵化胚胎的死亡率比较低,到72 h后处理组胚胎开始出现死亡,且随处理浓度递增,到96 h后,9.48 mg·L-1浓度下幼鱼全部死亡。对死亡率进行logistic非线性拟合,呈S型“效应-剂量”曲线,根据拟合方程得到96 h-LC50为6.15 mg·L-1,95%置信区间为(4.97, 7.34),对鱼类高毒,其安全浓度采用通用算法:96 h-LC50×0.01=0.06 mg·L-1(图2所示)。
2.1.3 MIT对胚胎畸形率的影响
MIT处理96 h后,使用奥林巴斯IX 83显微镜观察斑马鱼形态以及运动特征,统计孵出幼鱼中畸形个体数。观察发现MIT引起3种主要的畸形形态:体轴弯曲(包含尾部弯曲)、心包水肿和卵黄囊水肿(图3所示),3种畸形中,体轴弯曲的个体占大多数。畸形率随MIT处理浓度梯度提高而升高,在较低浓度时就有明显的致畸效应,1.0 mg·L-1的浓度下畸形率就达到了18.4%,可见MIT对胚胎发育有很大影响。统计得到96 h畸形率后,通过Origin Pro 15进行非线性拟合分析。得到96 h-TC50为3.89 mg·L-1,95%置信区间为(2.96, 4.82)(图4所示)。
2.1.4 MIT对斑马鱼胚胎生理特性的影响
经显微镜观察发现,MIT对斑马鱼生长具有抑制作用,主要体现在幼鱼心率的降低和体长缩短。在MIT梯度浓度暴露下,72 h时不同处理组斑马鱼幼鱼心率随处理浓度提高而降低,对照组中幼鱼心脏搏动有力,平均心房率为(175±4) beats·min-1,处理浓度达到1.52 mg·L-1时,心率与对照组相比显著下降(表3所示)。测量96 h幼鱼体长数据显示,浓度大于2.31 mg·L-1的处理组中胚幼鱼长与对照组存在显著差异,显著性分析可判断MIT对斑马鱼幼鱼生长的最小抑制浓度(MCIG)为2.31 mg·L-1(表4所示)。

图4 MIT对斑马鱼幼鱼96 h的致畸率以及96 h致畸率logistic拟合注:A为致畸率随浓度升高显著增大,B为96 h时3个平行实验拟合,R2为0.9933。Fig. 4 Zebrafish embryo deformity exposed to MIT after 96 h and its logistic nonlinear fittingNote: A, Increase of deformity with the increase of MIT concentration; B, Three parallel experiments fitting, R2=0.9933.


表4 MIT 96 h暴露对斑马鱼幼鱼体长的影响Table 4 Effects of MIT on the body length of zebrafish larvae after 96 h exposure
注:*表示处理组与对照组相比存在显著差异(P<0.05)。
Note:*Indicates significant difference between exposed groups and the control group (P< 0.05).

图5 MIT暴露下细胞凋亡分析注:在MIT暴露72 h后,对斑马鱼胚胎进行吖啶橙染色;(A)和(B)为对照组和0.25 mg·L-1处理组,没有凋亡细胞;(C)和(D)为1.0 mg·L-1处理组,在尾部有大量凋亡细胞存在;(E)和(F)为1.0 mg·L-1的处理组,观察到有大量凋亡细胞存在于脑部;(G)和(H)为2.0 mg·L-1处理组,有大量凋亡细胞分布在脑部和鳃部。图中用白色箭头标记凋亡细胞分布。Fig. 5 MIT-induced apoptosis analysis Note: After exposure to MIT for 72 h, the zebrafish embryos were stained with acridine orange (AO); (A) and (B), No apoptotic cells were observed in the control and 0.25 mg·L-1 MIT treated groups; (C) and (D), A large number of apoptotic cells were observed in tail in the 1.0 mg·L-1 MIT treated groups; (E) and (F), A small area of apoptotic cells were observed in the brain in the 1.0 mg·L-1 MIT treated groups; (G) and (H), In 2.0 mg·L-1 groups, a lot of apoptotic cells were observed in gill and brain. Apoptotic cells were indicated by white arrowheads.
2.2 细胞凋亡AO染色
AO染色检测MIT暴露下胚胎细胞凋亡情况,MIT梯度暴露浓度为0.25、0.75、1.0、2.0 mg·L-1,72 h的暴露胚胎脱膜后染色,在荧光显微镜下观察发现,对照组和0.25 mg·L-1的处理组中没有明显的凋亡细胞群体,当处理浓度达到1.0和2.0 mg·L-1后,能够在高倍镜下观察到凋亡细胞,主要出现在胚胎脑部和尾部(图5所示)。
3 讨论(Discussion)
由于个人护理产品、日用品和涂料在生活中无处不在,而且近年来一些由这些物品导致的过敏、疾病,使人们开始关注其中防腐剂的危害。甲基异噻唑啉酮是其中使用最广泛的防腐剂和抗菌剂,随着国际社会对MIT毒性的逐渐认识,对其毒性评价也开始逐渐开展。
本文首次研究了MIT对斑马鱼胚胎的急性毒性,根据高效液相色谱分析,在实验条件下,72 h内处理液中MIT浓度和性质都能保持稳定[6]。MIT对胚胎孵化有很强的抑制作用,当浓度大于等于1.0 mg·L-1时,就能显著抑制胚胎孵化,不能顺利孵化的胚胎在96 h后全部死亡,药物可能对胚胎早期发育相关基因或对胚胎早期生理代谢有影响,导致胚胎发育后期孵化酶分泌和活性降低而不能分解卵壳,暴露可能干扰了孵化酶的结构和功能,具体的抑制机理有待于进一步研究[26-27]。暴露浓度为1.52 mg·L-1时,96 h后幼鱼的死亡率明显上升,当浓度达到9.48 mg·L-1时96 h幼鱼全部死亡,得到了MIT对斑马鱼胚胎96 h的半致死浓度为6.15 mg·L-1,这对水生生物而言是高毒。暴露浓度为0.5 mg·L-1时畸形胚胎数量相比对照组显著增多,暴露的胚胎在96 h的半致畸浓度为3.89 mg·L-1。同时,统计MIT暴露96 h的幼鱼体长数据后,得到了最小生长抑制浓度为2.31 mg·L-1,值得注意的是,在2.31 mg·L-1的浓度下,多数胚胎都已产生畸形。与骨骼发育相关的畸形,如体轴弯曲占畸形比率较大,而且幼鱼体长显著变化。一方面,MIT暴露干扰了Wnt、Notch和Tgf-8等信号通路,影响胚胎靶器官的发育;另一方面可能是通过干扰发育重要基因的表达调控,如nbtps、nkx2.5和tbxl6等,进而影响随后的胚胎靶器官的发育,从而导致胚胎畸形发育[19,24]。在对胚胎生理特性和行为观察中发现,暴露于1.52 mg·L-1以上浓度的MIT就能使胚胎心率显著降低,心率降低在某种程度上也体现了MIT的心脏毒性[28-29]。关于斑马鱼神经系统发育的研究表明,24 h后胚胎神经系统已经基本发育成熟,自主抽动次数小于等于1次[30-31],实验观察到MIT浓度大于1.52 mg·L-1的暴露组,24 h胚胎每分钟自主抽动次数大于1次,表明神经系统的发育受到影响。进一步观察72 h和96 h幼鱼的行为,发现MIT浓度大于1.52 mg·L-1的暴露组胚胎自主活动能力下降,且触碰反应迟钝,这表明它们的神经系统发育受到了影响[31-34]。综上所述,实验中大量数据和现象都表明,MIT对斑马鱼胚胎产生了比较显著的毒性作用,包括孵化抑制、致畸性、发育抑制、心脏毒性、神经毒性,充分说明MIT对水生物的毒害作用不容忽视,同时也为毒性机理的研究提供了依据。
本研究显示MIT对斑马鱼胚胎具有高毒,由此看来MIT对水生生物的毒性已经不容忽视。MIT主要通过污水排放系统进入环境中,广泛分布于地表水中,环境监测一般水体中MIT含量通常在ng·L-1,而在污水排放口附近的河流处含量为μg·L-1[8,11]。MIT在环境中的降解主要受光照、温度、pH、金属离子、溶液介质等因素的影响,有研究表明,光照、碱性、含铁离子和强亲核试剂,如硫化物的溶液能显著加速异噻唑啉酮的光降解[35]。这些都导致了MIT的环境浓度远低于实验中的毒性效应浓度,但在局部水环境中也会有过量MIT,且长期暴露于MIT污染的环境中,也可能在生物体中富集,且根据安全系数分析,长期暴露于低浓度MIT下也会对鱼类产生不良影响[36]。
[1] Williams T. Efficacy of chloromethyl-methylisothiazolone (CMIT/MIT) biocide versus legionella and protozoa [R]. Houston: NACE International, 2007: 11-15
[2] Reinhard E, Waeber R, Niederer M, et al. Preservation of products with MCI/MI in Switzerland [J]. Contact Dermatitis, 2001, 45(5): 257-264
[3] Fewings J, Menné T. An update of the risk assessment for methylchloroisothiazolinone/methylisothiazolinone (MCI/MI) with focus on rinse-off products [J]. Contact Dermatitis, 1999, 41(1): 1-13
[4] Oono H, Hatai K, Aikawa H, et al. Effects of 2-methyl-4-isothiazolin-3-one (MT) and bronopol against fungal infection control of ayu and rainbow trout eggs and the toxicity to their fingerlings [J]. Aquaculture Science, 2008, 56(6): 559-565
[5] Rossi J C. Method for installing a flooring surface on a concrete slab or deck base coated with a sealing material: US20140360126 [P]. 2014-12-11
[6] 简龙海, 闻宏亮, 孙健, 等. 液相色谱-串联质谱法同时测定化妆品中的甲基异噻唑啉酮和甲基氯异噻唑啉酮[J]. 中国卫生检验杂志, 2011(11): 2652-2653
Jian L H, Wen H L, Sun J, et al. Simultaneous determination of methylisothiazolinone and chloromethylisothiazolinone in cosmetics by LC-MS/MS [J]. Chinese Journal of Health Laboratory Technology, 2011(11): 2652-2653 (in Chinese)
[7] Pascal M. 个人护理用表面活性剂的可持续发展[C]. 北京: 首届皮肤营养与健康护理产业国际高峰论坛论文集, 2010
Pascal M. Sustainable development of surfactants for personal care [C]. Beijing: The 1stSkin Nutrition and Health Care Industry Forum, 2010 (in Chinese)
[8] Amat A M, Arques A, López-Pérez M F, et al. Effect of methylisothiazolinone on biological treatment: Efficiency of SBRs and bioindicative studies [J]. Environmental Engineering Science, 2015, 32(6): 479-485
[9] Hahn S, Schneider K, Gartiser S, et al. Consumer exposure to biocides - identification of relevant sources and evaluation of possible health effects [J]. Environmental Health, 2010, 9(1): 1-11
[10] Schwensen J F, Lundov M D, Bossi R, et al. Methylisothiazolinone and benzisothiazolinone are widely used in paint: A multicentre study of paints from five European countries [J]. Contact Dermatitis, 2015, 72(3): 127-138
[11] Rafoth A, Gabriel S, Sacher F, et al. Analysis of isothiazolinones in environmental waters by gas chromatography-mass spectrometry [J]. Journal of Chromatography A, 2007, 1164(1-2): 74-81
[12] 付旭锋, 李圆圆, 苏红巧, 等. 异噻唑啉酮类杀菌剂对黑斑蛙胚胎和蝌蚪的急性毒性[J]. 生态毒理学报, 2014, 9(6): 1097-1103
Fu X F, Li Y Y, Su H Q, et al. Acute toxicity of isothiazolinone biocides toPelophylaxnigromaculatusembryos and tadpoles [J]. Asian Journal of Ecotoxicology, 2014, 9(6): 1097-1103 (in Chinese)
[13] Hu K, Li H R, Ou R J, et al. Tissue accumulation and toxicity of isothiazolinone inCtenopharyngodonidellus, (grass carp): Association with P-glycoprotein expression and location within tissues [J]. Environmental Toxicology & Pharmacology, 2014, 37(2): 529-535
[14] Seidle T, Prieto P, Bulgheroni A. Examining the regulatory value of multi-route mammalian acute systemic toxicity studies [J]. Altex, 2011, 28(2): 95-102
[15] Thyssen J P, Sederberg-Olsen N, Thomsen J F, et al. Contact dermatitis from methylisothiazolinone in a paint factory [J]. Contact Dermatitis, 2006, 54(6): 322-324
[16] Devos F C, Pollaris L, Broucke S V D, et al. Methylisothiazolinone: Dermal and respiratory immune responses in mice [J]. Toxicology Letters, 2015, 235(3): 179-188
[17] Hermsen S A B, Brandhof E J V D, Ven L T M V D, et al. Relative embryotoxicity of two classes of chemicals in a modified zebrafish embryotoxicity test and comparison with theirinvivo, potencies [J]. Toxicology in Vitro, 2011, 25(3): 745-753
[18] 张家禹, 刘丽丽, 李国超, 等. 毒死蜱对斑马鱼胚胎氧化应激效应研究[J]. 中国环境科学, 2016, 36(3): 927-934
Zhang J Y, Liu L L, Li G C, et al. Oxidative stress effects of chlorpyrifos on zebrafish embryos [J]. China Environmental Science, 2016, 36(3): 927-934 (in Chinese)
[19] 徐永学, 刘丽丽, 王健, 等. β-氯氰菊酯对斑马鱼胚胎的发育毒性[J]. 中国药理学与毒理学杂志, 2013, 27(2): 256-262
Xu Y X, Liu L L, Wang J, et al. Developmental toxicity of insecticide beta-cypermethrin on zebrafish embryos [J] Chinese Journal of Pharmacology and Toxicology, 2013, 27(2): 256-262 (in Chinese)
[20] Tucker B, Lardelli M. A rapid apoptosis assay measuring relative acridine orange fluorescence in zebrafish embryos [J]. Zebrafish, 2007, 4(2): 113-116
[21] OECD. OECD Guidelines for the Testing of Chemicals [R]// Methods in Molecular Biology. Paris: OECD, 2013, 947: 37-56
[22] 解相林, 刘振华, 王秀敏, 等. 温度对卤虫休眠卵孵化及对无节幼虫生长和开口的影响[J]. 河北渔业, 2007(11): 32-33
Xie X L, Liu Z H, Wang X M, et al. The temperature effect on the incubation ofArtemiaparthenogeneticaeggs and the growth of the larvae [J]. Hebei Fisheries, 2007(11): 32-33 (in Chinese)
[23] Liu L, Yan Y, Wang J, et al. Generation of mt: egfp transgenic zebrafish biosensor for the detection of aquatic zinc and cadmium [J]. Environmental Toxicology and Chemistry, 2016, 35(8): 2066-2073
[24] Yu K, Li G, Feng W, et al. Chlorpyrifos is estrogenic and alters embryonic hatching, cell proliferation and apoptosis in zebrafish [J]. Chemico-Biological Interactions, 2015, 239: 26-33
[25] 陈衍晨, 赵丹, 卿娣, 等. 缺氧再灌注斑马鱼胚胎脑部细胞凋亡及c-fos基因的表达[J]. 中国组织工程研究, 2013, 17(37): 6613-6619
Chen Y C, Zhao D, Qing D, et al. Zebrafish embryonic brain cell apoptosis and c-fos gene expression after hypoxia reperfusion [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(37): 6613-6619 (in Chinese)
[26] Cheng J, Emmanuel F, Han C S. Effect of carbon nanotubes on developing zebrafish (Daniorerio) embryos [J]. Environmental Toxicology and Chemistry, 2007, 26(4): 708-716
[27] 刘红云, 白伟, 张智勇, 等. 纳米氧化物对斑马鱼胚胎孵化率的影响[J]. 中国环境科学, 2009, 29(1): 53-57
Liu H Y, Bai W, Zhang Z Y, et al. Effects of several nano-oxides on the hatching rate of zebrafish embryos [J]. China Environmental Science, 2009, 29(1): 53-57 (in Chinese)
[28] 张利军, 史慧勤, 苑晓燕, 等. 多柔比星斑马鱼胚胎心脏发育毒性表现[J]. 中国药理学与毒理学杂志, 2013, 27(3): 429-433
Zhang L J, Shi H Q, Yuan X Y, et al. Cardiotoxicity of doxorubicin on embryonic zebrafish [J]. Chinese Journal of Pharmacology and Toxicology, 2013, 27(3): 429-433 (in Chinese)
[29] Braun P, Schmidt S, Crouse M, et al. Triclosan Effects on Zebrafish Heart Rate [C]. Pella, IA: Proceedings of The National Conference on Undergraduate Research (NCUR), 2013
[30] Lee J, Freeman J L. Zebrafish as a model for investigating developmental lead (Pb) neurotoxicity as a risk factor in adult neurodegenerative disease: A mini-review [J]. Neurotoxicology, 2014, 43(3): 57-64
[31] Hendricks M, Jesuthasan S. Form and Function in the Zebrafish Nervous System [M]// Gong Z Y, Korzh V. Fish Development and Genetics: The Zebrafish and Medaka Models. New Jersey: World Scientfic Publish, 2015: 164-184
[32] Zhang D L, Hu C X, Li D H, et al. Zebrafish locomotor capacity and brain acetylcholinesterase activity is altered by Aphanizomenon flos-aquae, DC-1 aphantoxins [J]. Aquatic Toxicology, 2013, 138-139(8): 139-149
[33] Carmean V, Ribera A B. Genetic analysis of the touch response in zebrafish (Daniorerio) [J]. International Journal of Comparative Psychology, 2010, 23(1): 91-102
[34] 黄玉莎, 程燕, 陈小辉, 等. 牛磺酸对缺氧/复氧性脑损伤斑马鱼幼鱼脑组织葡萄糖调节蛋白78、生长停滞与DNA损伤可诱导蛋白34表达的影响[J]. 中华实用儿科临床杂志, 2016, 31(6): 457-461
Huang Y S, Cheng Y, Chen X H, et al. Effect of taurine on the expression of glucose regulated protein 78 and growth arrest and DNA damage-in-ducible protein 34 in zebrafish larvae brain after hypoxia/reoxygenation brain injury [J]. Chinese Journal of Applied Clinical Pediatrics, 2016, 31(6): 457-461 (in Chinese)
[35] 张春燕, 于良民, 张志明. 异噻唑啉酮类化合物的降解及生态毒理行为研究进展[J]. 上海涂料, 2008, 46(11): 34-36
Zhang C Y, Yu L M, Zhang Z M. Progress in the research on the degradation and the ecological toxicity behavior of isothiazolinones [J]. Shanghai Coatings, 2008, 46(11): 34-36 (in Chinese)
[36] Kovács R, Bakos K, Urbányi B, et al. Acute and sub-chronic toxicity of four cytostatic drugs in zebrafish[J]. Environmental Science and Pollution Research, 2016, 23(15): 1-12
