运动对2,3,7,8-TCDD持续染毒大鼠肝脏LXRa蛋白、ACC1、FAS、SCD1 mRNA表达的影响
2018-01-29蔡爱芳陆一帆
蔡爱芳,陆一帆
1. 山东体育学院, 济南250102 2. 北京体育大学, 北京100084
伴随着全球工业化进程的加速,大量化学物质被排放到环境中,造成了严重的环境污染。具有亲脂性、生物富集性、难降解、高毒性等特点的持久性有机污染物(persistent organic pollutants, POPs),对人体健康和生态系统造成了严重的危害。二噁英类(dioxins)就是一种典型的持久性有机污染物,其中毒性最强的是2,3,7,8-四氯二苯并二噁英(2,3,7,8-tetrachlorodibenzo-p-dioxin, 2,3,7,8-TCDD),因其来源多、分布广、毒性强等特点,成为二噁英家族中最受人们关注的一种环境污染物。最近越来越多的研究指出二噁英类可改变不同发育阶段、不同细胞类型和组织中的一些激素系统,引起内分泌系统、免疫系统、生殖系统、骨骼系统等的紊乱,从而导致多种疾病[1-8]。目前全球代谢性疾病处于高发阶段,大规模的流行病学调查发现,2,3,7,8-TCDD与胰岛素抵抗及糖尿病发生显著相关,并有调查发现接触2,3,7,8-TCDD的工人体内2,3,7,8-TCDD含量与高水平甘油三酯、胆固醇相关性极高,接触工人在随后的35年内严重受到高血脂、动脉粥样硬化、缺血性心脏病的干扰[9-13]。
健康是人类生存、发展的基本要素,运动作为一种生活方式对健康的促进起着重要的作用。运动可以改善胰岛素抵抗、血脂代谢、提高心肺耐力,能够有效防治心脑血管及代谢性疾病[14-17]。目前,人体少量、持续接触有机污染物的现象比较常见,2,3,7,8-TCDD 低剂量持续暴露对人体的潜在影响更为突出。但2,3,7,8-TCDD是否通过影响脂质合成代谢从而导致代谢性疾病的发病并没明确,因此本研究拟通过研究2,3,7,8-TCDD染毒大鼠肝脏脂质合成代谢关键酶:脂肪酸合成酶(fatty acid synthetsae, FAS)、乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase, ACC)、硬脂酰辅酶A去饱和酶(stearyl coenzyme A desaturase, SCD) mRNA表达,转录因子肝X受体a(liver X receptor A, LXRa)蛋白表达,探讨代谢性疾病发病机制,并对2,3,7,8-TCDD染毒大鼠进行运动干预,试图发现运动这种健康的生活方式能否改变二噁英类环境污染物对脂质合成代谢的影响,为探索环境健康风险的有效控制方法和手段提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验动物与分组
7周龄VAF/SPF级雄性SD大鼠24只,体重(235.45±12.28)g,购自北京维通利华实验动物中心(许可证编号:SCXK(京)2012-0001),实验获得北京体育大学动物福利伦理委员会批准(批准号:201210035)。北京体育大学实验动物房分笼饲养,每笼4只,室温(22.15±1.65) ℃,相对湿度(55.25%±8.65%),昼夜交替时间12 h,国家标准啮齿类动物常规饲料喂养,自由饮水(高压灭菌)、饮食。24只SD大鼠适应性喂养并适应性运动1周后按体重随机分为3组:对照组(C组)、染毒组(T组)、运动染毒组(ET组),每组8只。
1.2 实验染毒剂量及运动方案
将2,3,7,8-TCDD(纯度>99.5%;Cambridge Isotope Laboratory,Andover,MA,USA)溶于玉米油中,T组、ET组按6.4 μg·kg-1(以单位体重计)的剂量给予腹腔注射,C组给予腹腔注射等量的玉米油。之后每隔1周给予上述剂量的21%持续染毒[18],连续7周。ET组尾部5%体重[19]负重进行游泳运动,每周游泳5 d,每次游泳30 min,游泳池体积为 140 cm×54 cm×43 cm,水深35 cm,游泳池水温(30±2) ℃。在游泳过程中,时刻观察大鼠游泳状态,发现有沉水,捞出水面休息十几秒放入水中继续游泳。C组、T组在ET组进行游泳训练的同时在水中自由浸泡 30 min,水深15 cm,水温(30±2) ℃。
1.3 动物组织取材
实验第8周末前一天给予大鼠禁食8 h,取材前称重,用20%的乌拉坦以5 mL·kg-1剂量进行腹腔麻醉。腹主动脉取血处死,快速分离肝脏组织,用生理盐水冲洗干净,滤纸吸干,称重并记录,手术剪分割成200 mg左右小块,锡纸包裹,投入液氮保存,取材结束后转移至-80 ℃冰箱备用。
1.4 测试指标及方法
1.4.1 肝脏甘油三酯(triglyceride,TG)测定
取大鼠肝脏0.5 g,剪碎,置于装有3倍体积甲醇的离心管中,用组织匀浆器粉碎,后向匀浆中加入6倍体积的氯仿,充分混匀,静置18 h后,3 000 r·min-1离心10 min,小心抽取下层脂质相,用组织TG试剂盒(中国中生北控生物科技有限公司),全自动生化分析仪(COBAS6000,德国罗氏公司)测定。
1.4.2 肝脏组织ACC1、FAS、SCD1 mRNA表达测定
用超纯RNA提取试剂盒(CWbio.Co.Ltd,Cat#CW0581)提取肝脏样本中总RNA。通过OD260/230、 OD260/280来判定RNA纯度,OD260/280在1.9~2.1之间RNA纯度较好。常规琼脂糖凝胶电泳成像,28S和18S条带完整,并28S条带的量是18S条带的2倍,说明RNA完整性较好。用DNase1(CWbio. Co. Ltd, Cat# CW2090)对RNA进行处理,以消化RNA中含有的基因组DNA。用HiFi-MMLVcDNA第一链合成试剂盒(CWbio.Co.Ltd,Cat#CW0744A)进行反转录,用UltraSYBR Mixture(CWbio.Co.Ltd,Cat#CW0956D)进行扩增,扩增产物取5 μL进行电泳,扩增产物为单一目的条带,说明扩增产物的特异性非常好。
引物设计:在pubmed网站搜索相应脂代谢基因的mRNA序列,应用引物设计软件Primer Premier5.0进行引物设计,所有引物均由上海生工生物工程技术服务有限公司合成,引物序列如下。
ACC1(169 bp) F:5'GATTTTTTGATTATGGCTCTTTCTC3',R: 5'TTGGCTTCAGAATCCAGGTTTG3';FAS(128 bp) F:5'GGCATTATCTTGGAAGCGATGGGTA3',R: 5'AAACTGCTCAGGACTGCGTGGG3';SCD1(199 bp) F: 5'ACACGCCGACCCTCACAACTC3',R: 5' CAGTGTGGGCAGGATGAAGCA3';β-actin(150 bp) F: 5' GGAGATTACTGCCCTGGCTCCTA3',R: 5'GACTCATCGTACTCCTGCTTGCTG3'。
扩增程序:95 ℃,10 min;(95 ℃,15 s;60 ℃,60 s)×40个循环。数据分析:采用相对定量法2-△△CT计算各基因mRNA的表达水平,目的基因相对变化倍数=2-△△CT,2-△△CT=[(CT靶基因-CT内参基因)实验组-(CT靶基因-CT内参基因)对照组]。
1.4.3 肝脏组织LXRa蛋白测定
Western blot检测蛋白表达,蛋白抽提试剂盒(Sinoble公司)进行组织蛋白抽提,BCA蛋白定量试剂盒(Sinoble公司)进行蛋白浓度测定。根据目的蛋白的分子量配制8%分离胶,5%浓缩胶,进行上样、电泳、转膜、封闭、一抗孵育LXRa(Sinoble Mouse LXRa antibody ab41902,Abcam公司,抗体稀释比例1:4 000,4 ℃过夜)、洗膜、二抗孵育(山羊抗小鼠IgG,Jackson公司,稀释比例1:10 000)、洗膜、曝光。胶片扫描,采用Image Pro Plus图像分析系统测定目的条带的光密度值(OD),GAPDH校正,计算目的蛋白表达的相对值。
1.5 数据统计学分析
实验数据用均数±标准差(Mean±SD)表示,SPSS 17.0软件进行统计分析。实验数据分析前进行正态分布Kolmogorov-Smirnov检验,非正态分布数据用Box-Cox转换为近似正态分布。各组之间的比较分析采用Compare Means中One-Way ANOVA。P<0.05为具有统计学差异。
2 结果(Results)
2.1 大鼠体重、肝脏相对重量
大鼠体重、肝脏相对重量如表1所示,与C组相比,T组、ET组体重明显降低,差异有统计学意义(P<0.01)、肝脏相对重量明显增加,差异有统计学意义(P<0.01)。
2.2 大鼠肝脏组织TG含量
大鼠肝脏TG含量如图1所示,与C组相比,T组肝脏TG含量明显增高,差异有统计学意义(P<0.01),与T组相比,ET组肝脏TG含量明显降低,差异有统计学意义(P<0.01)。
2.3 大鼠肝脏脂质合成代谢相关酶ACC1、FAS、SCD1 mRNA表达
大鼠肝脏脂质合成代谢相关酶mRNA表达如图2所示,2,3,7,8-TCDD持续染毒8周,T组、ET组脂质合成代谢相关酶ACC1、FAS、SCD1 mRNA表达与C组比较均升高,差异有统计学意义(P<0.01)。持续8周游泳运动并伴有2,3,7,8-TCDD染毒ET组脂质合成代谢相关酶ACC1、FAS、SCD1 mRNA表达与T组比较均降低,差异有统计学意义(P<0.01)。
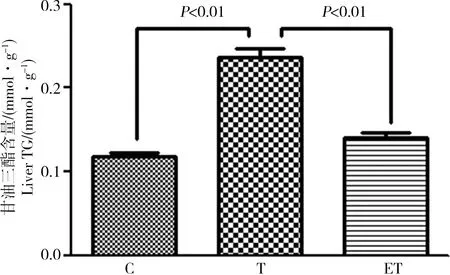
图1 运动对TCDD染毒大鼠肝组织甘油三酯(TG)含量的影响Fig. 1 The effect of exercise on the level of liver triglyceride (TG) of rats after exposure to TCDD

图2 运动对TCDD染毒大鼠肝组织脂质合成代谢相关酶ACC1、FAS、SCD1 mRNA表达相对值的影响Fig. 2 The effect of exercise on the relative expression of the crucial enzymes during liver lipid metabolism of rat after exposure to TCDD
2.4 大鼠肝脏脂质合成代谢转录因子LXRa蛋白相对表达
大鼠肝脏LXRa蛋白相对表达如图4所示,持续8周2,3,7,8-TCDD染毒T组、ET组大鼠肝脏LXRa蛋白相对表达与C组比较均增加,差异有统计学意义(P<0.01),ET组大鼠肝脏LXRa蛋白相对表达与T组比较降低,差异有统计学意义(P<0.01)。

图3 大鼠肝组织LXRa、内参GAPDH蛋白电泳条带示例Fig. 3 The sample of electrophoretic bands of liver LXRa, GAPDH protein of rats
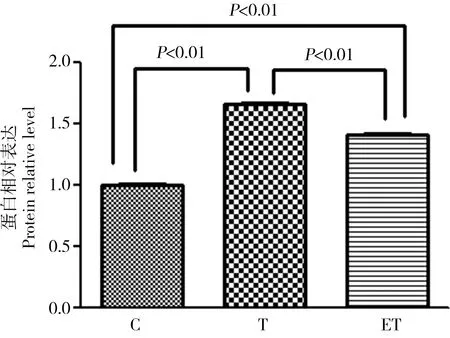
图4 运动对TCDD染毒大鼠肝组织脂质合成代谢转录因子LXRa蛋白相对表达的影响Fig. 4 The effect of exercise on the relative level of the transcriptional factor LXRa protein during liver lipid metabolism of rats after exposure to TCDD

表1 各组大鼠体重、肝脏相对重量Table 1 The body weight and relative liver weight of rats
注:C, 对照组; T, 染毒组; ET, 运动染毒组。与C组相比,**P<0.01。
Note: C, Control group; T, Toxic group; ET, Exercise toxic group. Compared with C group,**P<0.01.
3 讨论(Discussion)
目前环境污染问题日益严重,环境因素对身体健康的影响逐渐引起人们更多的关注。二噁英这类难降解、并具有生物富积性的环境污染物对人类健康的影响逐渐被研究者证实。大规模流行病学调查发现二噁英类作为一种持久性有机污染物,增加了代谢性疾病的发病风险[20-24]。
3.1 运动对2,3,7,8-TCDD染毒大鼠体重、肝脏相对重量的影响
Ciftci等[25]研究发现2 μg·kg-1(以单位体重计)2,3,7,8-TCDD就可以明显减缓Wistar 大鼠体重的增长。本研究结果显示2,3,7,8-TCDD染毒8周后,T组、ET组大鼠体重比正常对照组C组大鼠体重低,差异有统计学意义(P<0.01),这与前人文献报道一致,充分说明了2,3,7,8-TCDD能够改变大鼠体重的自然增长趋势。据文献报道,适宜强度的有氧运动可减控大鼠体重[26-29],本研究结果ET组大鼠体重最低,认为这是运动和2,3,7,8-TCDD双重作用的结果。
肝脏肿大是简易评价肝脏毒性的一个指标,大量研究证实2,3,7,8-TCDD染毒后以肝脏肿大、实质细胞增生与肥大为共同肝脏毒性特征[30-32]。本研究8周末处死动物时发现C组大鼠肝脏颜色鲜红,大小无异常,而T组、ET组大鼠肝脏明显增大,触之有油腻感。并且T组、ET组肝脏相对重量与C组比较显著增加,有统计学差异(P<0.01)。这与前人文献报道肝毒性特征一致。2,3,7,8-TCDD染毒大鼠出现肝脏毒性的组织表观表现,势必会影响到肝脏生理功能。而肝脏是脂质从头合成的主要部位,可能会影响到肝脏中脂质代谢的合成。
3.2 运动对2,3,7,8-TCDD染毒大鼠肝脏组织甘油三酯的影响
肝脏、脂肪组织及小肠是合成甘油三酯、胆固醇的主要场所,以肝脏的合成能力最强。肝细胞能合成脂肪,但不能储存脂肪。甘油三酯合成后,与磷脂、胆固醇结合,与载脂蛋白B100、C等生成极低密度脂蛋白(VLDL),再分泌入血运输至肝外组织,提供给其他组织器官利用。肝脏合成甘油三酯的量超过了其合成和分泌VLDL的能力,甘油三酯便积存在肝内。2,3,7,8-TCDD染毒8周后, T组肝脏甘油三酯明显高于C组、ET组,差异有统计学意义(P<0.01)。C组、ET组肝脏甘油三酯无明显差异(P>0.05)。分析认为2,3,7,8-TCDD持续染毒会诱导肝脏合成甘油三酯,超过了肝脏代谢能力促使多余的甘油三酯存积在肝脏组织中。而ET组虽然也持续染毒,但由于规律持续的运动,甘油三酯在肝脏中积聚量相对较少,说明游泳运动对2,3,7,8-TCDD染毒大鼠肝脏甘油三酯沉积有一定的干预作用。
3.3 运动对2,3,7,8-TCDD染毒大鼠肝脏组织LXRa的影响
LXRa是肝脏脂肪代谢的主要推动者,大量研究发现LXRa可通过调节胆固醇7a-羟化酶、ATP结合盒转运蛋白G5、ATP结合盒转运蛋白G8、ATP结合盒转运蛋白A1、磷酸酰转移蛋白、载脂蛋白E、固醇调节元件结合蛋白(sterol regulatory element binding protein, SREBP)等基因表达水平[33-36],对维持体内脂代谢平衡起重要作用。Peet等[37]首次报道LXRa缺乏,小鼠肝内SREBP1c及其靶基因FAS、SCD1的表达都减少。随后陆续有研究者发现LXR对ACC、FAS、SCD1基因可以不通过SREBP1来介导,ACC、FAS、SCD1基因启动子上均含有LXRs结合位点,可直接接受LXR的调控[38-39]。LXR可引起生脂基因表达上调,增加脂肪酸的合成并使肝内聚集大量的甘油三脂,提高血浆中甘油三酯的水平[40]。
本实验研究结果显示T组、ET组肝脏组织中LXRa蛋白表达均明显增高,与C组比较有统计学差异(P<0.01),表明2,3,7,8-TCDD持续染毒可以诱导LXRa蛋白表达的增加,增高的LXRa作为脂肪合成代谢的推动者,能够通过LXR-SREBP1c途径进而促进下游脂质合成代谢关键酶ACC、FAS、SCD1的基因和蛋白表达,或直接促进其靶基因ACC、FAS、SCD1的表达,从而使脂肪合成增加,积聚在肝脏组织中。肝脏合成的甘油三酯主要由VLDL运输到肝外组织,VLDL的甘油三酯在脂蛋白酯酶(LPL)的作用下逐步水解,可见能够影响LPL活性的因素都会影响到肝脏甘油三酯的代谢。Angptl3(Angiopoietin-like 3)是一种肝特异性分泌蛋白,能够抑制LPL活性,从而延缓甘油三酯代谢。Inaba等[41]发现Angptl3是LXR的直接靶点,LXR能增加肝脏合成Angptl3,增加的Angptl3通过抑制LPL 活性参与脂代谢的调节,延缓甘油三酯分解代谢。本研究T组、ET组肝脏组织中LXRa蛋白表达明显高于C组(P<0.01),可能通过合成更多Angptl3,致使LPL活性抑制,使得T组、ET组大鼠肝脏甘油三酯明显增高。虽2,3,7,8-TCDD染毒造成T组、ET组肝脏组织中LXRa蛋白表达均明显增高,但T组、ET组之间LXRa蛋白表达还是有明显差异,ET组大鼠肝脏LXRa蛋白表达相对较低(P<0.01)。有关运动对LXRa蛋白表达的报道很少,结果也不尽一致, Rocco等[42]报道胆固醇酯转运蛋白(CETP)转基因小鼠进行6周有氧运动,能够明显提高胆固醇的逆向转运,但肝脏中LXR蛋白表达水平没有变化。但Kazeminasab等[43]报道雄性Wistar大鼠进行耐力训练可以使肝脏中LXR mRNA表达明显升高,提高胆固醇的逆向转运,对预防动脉粥样硬化有积极的作用。本研究发现运动可以降低2,3,7,8-TCDD染毒大鼠脂质合成代谢关键转录因子LXRa蛋白表达,我们分析可能是运动下调了LXRa蛋白表达,从而使的甘油三酯的合成代谢相对T组延缓,对LPL活性抑制作用也较T组减弱,使得ET组大鼠肝脏甘油三酯含量低于T组大鼠(P<0.01)。
3.4 运动对2,3,7,8-TCDD染毒大鼠肝脏LXRa蛋白靶基因ACC1、FAS、SCD1 mRNA表达的影响
ACC、FAS 和 SCD1是肝脏脂质从头合成的3个重要的关键酶。ACC催化丙二酰单酰辅酶A生成,是脂肪酸合成的第一步反应。FAS是动物体内长链脂肪酸合成的最后一步关键酶。SCD是肝细胞合成单不饱和脂肪酸的限速酶,具有催化饱和脂肪酸的脂酰辅酶A脱氢的作用。本研究结果显示,T组、ET组大鼠肝脏ACC1、FAS、SCD1 mRNA表达升高,与C组比较有统计学差异(P<0.01),分析认为2,3,7,8-TCDD染毒导致上游的LXRa蛋白表达增高,从而出现LXRa蛋白靶基因ACC1、FAS、SCD1 mRNA表达升高。
许多学者研究发现,ACC、FAS在多种癌组织中呈高表达。Yahagi等[44]研究发现,小细胞肝癌组织中脂肪酸合成异常活跃,检测显示脂肪酸合成的关键酶ACC、FAS mRNA表达增高,并呈协同作用。动物实验已证实二噁英具有很强的致癌性,国际癌症研究机构已把二噁英列为一级致癌物。SCD的表达量会改变生物膜磷脂的组成,生物膜的流动性、通透性和完整性在细胞间物质转运和生物信号传导过程中起着非常重要的作用。大量研究认为,生物膜磷脂组分发生改变往往与肥胖、脂肪肝、糖尿病及癌症等许多慢性疾病状态相关。SCD的正常表达和调控对维持机体的生理状态和体内脂质内环境的稳定具有重要作用。本实验T组、ET组大鼠肝脏ACC1、FAS、SCD1 mRNA表达升高是由8周2,3,7,8-TCDD持续染毒造成的异常表达。
Rector等[45]研究发现肥胖大鼠进行16 周运动,脂肪酸氧化明显增加,脂肪酸从头合成的关键酶ACC1 mRNA表达降低70%,FAS mRNA表达降低35%。Yasari等[46]发现大鼠进行8周运动训练,肝脏中SCD mRNA和蛋白表达均降低。这说明进行长期、持续的运动锻炼有利于减少脂肪的合成。ET组肝脏ACC1、FAS、SCD1 mRNA表达明显低于T组(P<0.01),表明8周规律游泳运动可以抵抗2,3,7,8-TCDD染毒引起肝脏中ACC1、FAS、SCD1 mRNA表达的加强,减少脂肪合成。
综上所述,2,3,7,8-TCDD持续染毒8周可上调脂质合成代谢关键酶ACC1、FAS、SCD1 mRNA的表达及转录因子LXRa蛋白的表达,从而造成脂质代谢紊乱,肝脏甘油三酯沉积。而8周有氧运动降低了ACC1、FAS、SCD1 mRNA、LXRa蛋白表达,有效改善了脂质代谢的紊乱,降低了甘油三酯在肝脏中的沉积,提示运动干预可以改善二噁英类污染物造成的肝脏脂质代谢紊乱。
致谢:感谢华南师范大学体育科学学院李婷博士后在文章修改中给予的帮助。
[1] Bock K W. 2,3,7,8-Tetrachlorodibenzo-p-dioxin (TCDD)-mediated deregulation of myeloid and sebaceous gland stemprogenitor cell homeostasis [J]. Archives of Toxicology, 2017, 91: 1-7
[2] Boyd S A, Sallach J B, Zhang Y, et al. Sequestration of TCDD by activated carbon eliminates bioavailability and the suppression of immune function in mice [J]. Environmental Toxicology and Chemistry, 2017, 36(10): 2671-2678
[3] Yun C, Weiner J A, Chun D S, et al. Mechanistic insight into the effects of aryl hydrocarbon receptor activation on osteogenic differentiation [J]. Bone Reports, 2017, 16(6):51-59
[4] Iszatt N, Stigum H, Govarts E, et al. Perinatal exposure to dioxins and dioxin-like compounds and infant growth and body mass index at seven years: A pooled analysis of three European birth cohorts [J]. Environment International, 2016, 94: 399-407
[5] Sofo V, Götte M, Laganà A S, et al. Correlation between dioxin and endometriosis: Anepigenetic route to unravel the pathogenesis of the disease [J]. Archives of Gynecology and Obstetrics, 2015, 292(5): 973-986
[6] Fukushi J, Tokunaga S, Nakashima Y, et al. Effects of dioxin-related compounds on bonemineral density in patients affected by the Yusho incident[J]. Chemosphere, 2016, 145: 25-33
[7] Chevrier J, Warner M, Gunier R B, et al. Serum dioxin concentrations and thyroid hormone levels in the seveso women's health study [J]. American Journal of Epidemiology, 2014, 180(5): 490-498
[8] Birnbaum L S. Developmental effects of dioxins and related endocrine disrupting chemicals[J]. Toxicology letters, 1995, 82: 743-750
[9] Ngwa E N, Kengne A P, Tiedeu-Atogho B, et al. Persistent organic pollutants as risk factors for type 2 diabetes[J]. Diabetology and Metabolic Syndrome, 2015, 7: 41-56
[10] Charles J, Olivia M. Associationsof exposure to dioxins and polychlorinated biphenyls with diabetes: Based on epidemiological findings[J]. Environmental Research, 2012, 118(10): 107-111
[11] Kim M J, Pelloux V, Guyot E, et al. Inflammatory pathway genes belong to major targets of persistent organic pollutants in adipose cells [J]. Environmental Health Perspectives, 2012, 120(4): 508-514
[12] Lee D, Lee I, Song K, et al. Astrong dose-response relation between serum concentrations of persistent organic pollutants and diabetes results from the national health and examination survey 1999-2002[J]. Diabetes Care, 2006, 29(7): 1638-1644
[13] Pelclová D, Fenclova Z, Preiss J, et al. Lipid metabolism and neuropsychological follow-up study of workers exposed to 2, 3, 7, 8-tetrachlordibenzo-p-dioxin [J]. International Archives of Occupational and Environmental Health, 2002, 75: 60-66
[14] Lockard B, Earnest C P, Oliver J, et al. Retrospective analysis of protein- and carbohydrate-focused diets combinedwith exerciseon metabolic syndrome prevalence in overweight and obese women [J]. Metabolic Syndrome and Related Disorders, 2016, 14(4): 228-237
[15] Heald A,Sein K,Anderson S,et al. Diet,exercise and the metabolic syndrome in Schizophrenia: A cross-sectional study [J]. Schizophrenia Research, 2015, 169(1-3): 494-495
[16] Lee S, Norheim F, Gulseth H L, et al. Interaction between plasma fetuin-A and free fatty acids predicts changes in insulin sensitivity in response to long-term exercise [J]. Physiological Reports, 2017, 5(5): 1-14
[17] Zhao J, Su Z, Qu C, et al. Effects of 12 weeks resistance training on serum irisin in older male adults [J]. Frontiers in Physiology, 2017, 8: 171-175
[18] Croutch C R, Lebofsky M, Schramm K, et al. 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin (TCDD) and 1, 2, 3, 4, 7, 8-hexachlorodibenzo-p-dioxin (HxCDD) alter body weight by decreasing insulin-like growth factor I (IGF-I) signaling [J]. Toxicological Sciences, 2005, 85(1): 560-571
[19] 严翊, 谢敏豪. 大鼠游泳运动的最大乳酸稳态负荷的确定——乳酸最小试验[J]. 北京体育大学学报, 2010, 33(9): 43-45
Yan Y, Xie M H. The selection of rat swimming training load in maximal lactate steady state-lacate minimum test [J]. Journal of Beijing Sport University, 2010, 33(9): 43-45 (in Chinese)
[20] Ngwa E N, Kengne A P, Tiedeu-Atogho B, et al. Persistent organic pollutants as risk factors for type 2 diabetes [J]. Diabetology and Metabolic Syndrome, 2015, 7(1): 1-15
[21] Singh K, Chan H M. Persistent organic pollutants and diabetes among Inuit in the Canadian Arctic [J]. Environmental International, 2017, 101: 183-189
[22] Thibault V, Bélanger M, Leblanc E, et al. Factors that could explain the increasing prevalence of type 2 diabetes among adults in a Canadian Province: A critical review and analysis[J]. Diabetology and Metabolic Syndrome, 2016, 8(1): 71-81
[23] Lee D H, Porta M, Jacobs D R Jr, et al. Chlorinated persistent organic pollutants, obesity, and type 2 diabetes[J]. Endocrine Reviews, 2014, 5(4): 557-601
[24] Taylor K W, Novak R F, Anderson H A, et al. Evaluation of the association between persistent organic pollutants (POPs) and diabetes in epidemiological studies: A national toxicology program workshop review[J]. Environmental Health Perspectives, 2013, 121(7): 774-783
[25] Ciftci O, Tanyildizi S, Godekmerdan A. Protective effect of curcumin on immune system and body weight gain on rats intoxicated with 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin (TCDD)[J]. Immunopharmacology and Immunotoxicology, 2010, 32(1): 99-104
[26] Medina-Contreras J M, Colado-Velázquez J, Gómez-Viquez N L. Effects of topical capsaicin combined with moderate exercise on insulin resistance, body weight and oxidative stress in hypoestrogenic obese rats[J]. International Journal of Obesity, 2017, 41(5): 750-758
[27] Machado M V, Vieira A B, Nascimento A R, et al. Physical exercise restores microvascular function in obese rats with metabolic syndrome [J]. Metabolic Syndrome and Related Disorders, 2014, 12(9): 484-492
[28] 魏冰, 白厚增, 靳一哲, 等. 运动、EGCG和肉碱对肥胖大鼠体重、内脏脂肪及肝脏CPT1表达的影响[J]. 中国运动医学杂志, 2012(4): 331-335, 352
Wei B, Bai H Z, Jin Y Z, et al. Exercise combined with administration of egcg and l-carnitine affects the weight,visceral fat and cpt1 expression in obese rats [J]. Chinese Journal Sports Medicine, 2012(4): 331-335,352 (in Chinese)
[29] 张颢, 卜淑敏, 朱一力, 等. 跑台运动对去卵巢大鼠体重、腹腔内脂肪重量以及血清瘦素和脂联素含量的影响[J]. 中国运动医学杂志, 2009(2): 175-178
Zhang H, Bu S M, Zhu Y L, et al. Effects of treadmill exercise on body weight, intraabdominal fat, serum leptin and adiponedtin levels in ovariectomized rats[J]. Chinese Journal Sports Medicine, 2009(2): 175-178 (in Chinese)
[30] Ohbayashi H, Sasaki T, Matsumoto M, et al. Dose-and time-dependent effects of 2,3,7,8-tetrabromodibenzo-p-dioxin on rat liver [J]. The Journal of Toxicological Sciences, 2007, 32(1): 47-56
[31] Korenaga T, Fukusato T, Ohta M, et al. Long-term effects of subcutaneously injected 2,3,7,8-tetrachlorodibenzo-p-dioxin on the liver of Rhesus monkeys [J]. Chemosphere, 2007, 67(9): 399-404
[32] Du J L, Cao L P, Liu Y J, et al. A study of 2,3,7,8-tetrachlorodibenzo-p-dioxin induced liver injury in Jian carp (Cyprinuscarpiovar. Jian) using precision-cut liver slices[J]. Bulletin of Environmental Contamination and Toxicology, 2016, 96(1): 55-61
[33] Chiang J Y, Kimmel R, Stroup D. Regulation of cholesterol 7alpha-hydroxylase gene (CYP7A1) transcription by the liver orphan receptor (LXRalpha) [J]. Gene, 2001, 262(1-2) : 257- 265
[34] Vogelvan D, Bosch H M, Wit N J, et al. A cholesterol-free, high-fat diet suppresses gene expression of cholesterol transporters in murine small intestine [J]. American Journal of Physiology Gastrointestal and Liver Physiology, 2008, 294(5): 1171-1180
[35] Castrillo A, Tontonoz P. Nuclear receptors in macrophage biology: At the crossroads of lipid metabolism and inflammation [J]. Annual Review of Cell and Developmental Biology, 2004, 20: 455-480
[36] Makishima M. Nuclear receptors as targets for drug development: Regulation of cholesterol and bile acid metabolism by nuclear receptors [J]. Journal of Pharmacological Sciences, 2005, 97(2): 177-183
[37] Peet D J, Turley S D, Ma W, et al. Cholesterol and bile acid metabolism are impaired in mice lacking the nuclear oxysterol receptor LXRα [J]. Cell, 1998, 93(5): 693-704
[38] Chu K, Miyazaki M, Man W C, et al. Stearoyl-coenzyme A desaturase 1 deficiency protects against hypertriglyceridemia and increases plasma high-density lipoprotein cholesterol induced by liver X receptor activation [J]. Molecular and Cellular Biology, 2006, 26(18): 6786-6798
[39] Talukdar S, Hillgartner F B. The mechanism mediating the activation of acetyl-coenzyme A carboxylase-alpha gene transcription by the liver X receptor agonist T0-901317 [J]. Journal of Lipid Research, 2006, 47(11): 2451-2461
[40] Schultz J R, Tu H, Luk A, et al. Role of LXRs in control of lipogenesis [J]. Genes and Development, 2000, 14(22): 2831-2838
[41] Inaba T, Matsuda M, Shimamura M, et al. Angiopoietin-like protein 3 mediates hypertriglyceridemia induced by the liver X receptor [J]. Biochemistry, 2003, 46(7): 21344-21351
[42] Rocco D D, Okuda L S, Pinto R S, et al. Aerobic exercise improves reverse cholesterol transport in cholesteryl ester transfer protein transgenic mice [J]. Lipids, 2011, 46(7): 617-625
[43] Kazeminasab M M, Ghaedi K, Esfarjani F, et al. Endurance training enhances LXR expression in the liver of male Wistar rats [J]. Research in Pharmaceutical Sciences, 2012, 7(5): S544-553
[44] Yahagi N, Shimano H, Hasegawa K, et al. Cordinate activation of lipogenic enzymes in hepatocellular carcinoma[J]. European Journal of Cancer, 2005, 41(9): 1316-1322
[45] Rector R S, Thyfault J P, Morris R T, et al. Daily exercise increases hepatic fatty acid oxidation and prevents steatosis in Otsuka Long-Evans Tokushima fatty rats [J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2008, 294(3): G619-G626
[46] Yasari S, Prud Homme D, Wang D, et al. Exercise training decreases hepatic SCD-1 gene expression and protein content in rats [J]. Molecular and Cellular Biochemistry, 2010, 335(1): 291-299
