环境治理对红枫湖水生食物链中汞积累的影响
2018-01-29荆敏林丹闫海鱼康静文
荆敏,林丹,闫海鱼,康静文
1. 太原理工大学 环境科学与工程学院, 太原 030024 2. 贵州医科大学 公共卫生学院, 贵阳 550025 3. 中国科学院地球化学研究所 环境地球化学国家重点实验室, 贵阳550081
汞(Hg)是环境中引人关注的有毒污染物,而其有机形态——甲基汞(MeHg)因其极强的生物毒性,且极易通过水生食物链传输、累积和放大而长期受到关注。近年来的研究发现,我国湖泊、河流等水体汞污染明显高于欧美等发达国家的水平[1-2]。但大量的监测数据却表明,与欧美地区湖泊鱼不同的是,我国大部分地区的鱼体内的汞含量均未超标[1, 3-9]。上述现象的可能原因归纳为以下3个方面:我国高强度捕捞使食物链缩短,人工养殖使食物链简单化,水体富营养化导致的生物稀释作用等[7]。这些因素的变化都能显著地改变水生生态系统的食物链结构,使得汞在水生食物链的迁移转化与生物富集过程发生明显的变化,进而造成不同程度的生态和健康风险。
近年来,随着政府对水生生态环境健康的日益重视,相关的环境治理措施,特别是水专项和水十条等政策的执行,水环境已逐渐得到改善,被破环的水生生态系统的天然食物链和食物网结构逐渐恢复正常。但对于水生系统中的Hg污染,需要考虑的另一个环境问题是:水体富营养化程度降低后,鱼体Hg污染物的生物稀释作用减弱,以及食物链结构的恢复使得原本较短的食物链变长,这些改变是否使得鱼体Hg如北欧和北美一样富集放大?因此,很有必要选择正在进行生态恢复的典型湖泊水库为研究对象,进行长期的追踪监测,探讨上述环境问题的发生与发展趋势的相关规律,为未来合理管理和利用水资源提供数据支持。
红枫湖是贵州省内面积最大的人工水库之一,距离贵阳市中心28 km,属于长江中上游乌江水系,是贵阳市最大的饮用水源地。改革开放以来,红枫湖受到不同程度的污染包括工业废水、生活污水、旅游污染及网箱养殖等,致使红枫湖水体富营养化十分严重。因此,自2008年以来,当地政府对红枫湖开始进行环境综合治理,例如设置水体净化带,关停周边污染源,取缔网箱养鱼等。目前,红枫湖的富营养化得到明显改善,且水库里主要是自然生长的野生鱼类。因此红枫湖可以作为研究食物链结构恢复与衡量Hg的污染状况是否改变的典型对象。因此,本研究拟通过测定百花湖水生食物链不同营养级生物体内的Hg含量,及碳氮稳定同位素,探究治理前后红枫湖食物链汞含量、食物链长度及富集放大规律是否发生改变。
1 材料与方法(Materials and methods)
1.1 样品采集
于2015年10月,在红枫湖宽阔水域采集表层水及浮游生物,在岸边的浅滩采集底栖生物。于当年12月中旬采集鱼样。本次共获得浮游生物、底栖生物和鱼类共11个种类。其中鱼类6种,有草食性鱼:草鱼 (Ctenopharyngodonidellus)3条、杂食性鱼:鲫鱼 (Carassiusauratus) 3条、白条 (Hemiculterleucisculus) 9条、赤睛鱼3条(Scardiniuserythrophthalmus)、白鲢 (Hypophthalmichthysomlitrix) 3条及肉食性的爬虎鱼5条(Abbottinarivularis);底栖生物主要有:螺蛳(Bellamyaquadrata)、湖虾(freshwater shrimps)、蜻蜓幼虫(Odonatalarva)、摇蚊幼虫(Chironmidae)每个样品不少于6个个体的混合样。
水样的采集:采用5 L的Niskin采样器在船上采集,采集1 000 mL的水样,经过0.45 μm (Millipore PVDF)微孔滤膜过滤水样,滤膜保存在离心管中,冷藏保存以测定叶绿素a(Chl-a)。过滤后的水样保存在2个200 mL经过处理过的去除汞的硼硅玻璃瓶中,再采集未过滤的水样保存在2个200 mL去除汞的硼硅玻璃瓶中,采集的水样均加入5%(V/V)的盐酸,放在冰箱中冷藏保存,用于测定富营养化指标及总汞含量。
浮游动植物的采集:分别用25 #和13 #浮游生物网,采用水平拖动的方式搜集浮游动植物样品。样品低温运回实验室并在-20 ℃保存。
底栖生物采集:在水库的浅滩边,铲取表层10 cm的沉积物,过40目尼龙筛淘洗,挑出其中的底栖生物,并用纯净水冲洗干净后放入样品瓶,样品瓶放在冷藏箱低温运回实验室,-20 ℃保存。
鱼样采集:和渔民一起撒网随机捕获。鲜活鱼样运回实验室进行解剖。记录其名称、种类、长度、重量等信息,并用手术刀取脊部肌肉约20 g,去皮去骨,用锡纸包好装入自封袋于-20 ℃保存。
所有样品测定前-80 ℃冷冻干燥,玛瑙研钵研磨并过60目尼龙筛,储存在玻璃样品瓶,防潮常温保存,用于THg、MeHg及δ13C 和 δ15N的测定。同时,取一份做水分测定。
由于螺蛳、虾、摇蚊幼虫等底栖类生物个体较小,故将若干个体混合作为一个样本,螺蛳和虾均去壳取肉进行测定。
1.2 样品分析
水体总汞的测定:采用二次金汞齐-冷原子荧光法分析测定[10],汞分析仪为Tekran 2500(加拿大),方法的最低检出限为0.5 ng·L-1。
生物样品总汞的测定:准确称取干样0.1000 g,加入到石英舟,通过Lumex PYRO-915+测汞仪(俄罗斯Lumex公司)热解测定[11]。每个样品均测定二次及以上,取其平均值,平行测定的标准偏差< 5%。每10个样品用标准物质进行一次校准。所用国际标准参考物质为Tort-2(加拿大),测定结果为(292±12) ng·g-1, 使其回收率严格控制在96%~105%。
甲基汞的测定:采用碱消解-水相乙基化GC-CVAFS法测定[12],所用甲基汞分析仪为Brooks Rand model III(美国)进行分析测定。10%的平行样,每测10个样品用标准物质Tort-2进行一次校准,测定结果为(147±4.60) ng·g-1,回收率严格控制94%~99%。
稳定同位素的测定: δ13C与δ15N同位素通过DI-MAT252同位素质谱仪(德国Finnigan公司)测定,δ13C同位素选用的标准参考物质为IAEA-C-3。δ15N选用IAEA-NO3为标准参考物质。每10个样品加个标准物质进行校准,另加10%的平行样测定。回收率分别严格控制在99.8%~101%、100%~100.5%。
水质参数的测定:用塞氏罗盘现场测定透明度(SD),化学指标总氮(TN)、总磷(TP)按照《水和废水监测分析方法》第四版分析测定[13]。叶绿素a(Chl-a)采用0.45 μm(Millipore PVDF)微孔滤膜200~500 mL过滤,保留滤膜并用丙酮萃取分光光度法测定[14]。
1.3 数据分析与计算
本次实验测得的Hg含量均为干重含量,为了便于与其他研究的Hg含量比较,通过含水率将生物体中的干重含量换算为鲜重含量。
所测得的碳氮同位素,δ13C和δ15N的计算方法如下:
δ13C或δ15N=((R样品/R标样)-1) ×1000
(1)
式中R为标样或样品中13C /12C或15N /14N。
δ13C与δ15N稳定同位素用来分析食物网的能量流动与食物来源。不同营养级间的δ15N富集值的平均值为3.4‰。因此,可以根据水域中不同生物的δ15N值来确定相应的营养等级[15],利用δ15N值计算红枫湖的食物链长度。具体公式如下:
TLconsumer= (δ15Nconsumer-δ15Nbaseline) /3.4‰ +λ(2)
式中,TLconsumer为消费者营养等级,δ15Nconsumer表示消费者的δ15N值,δ15Nbaseline表示食物链基底有机体δ15Nbaseline值,λ表示基底有机体的营养水平。
将鱼样THg含量(经log10转换)与δ15N做线性分析,用斜率表示THg在食物链中的生物放大率。
采用TN、TP、Chl-a、SD这4个参数综合评定水库的营养水平,采用修正的卡尔森综合指数评价水库的富营养化状态(TLI)[16],评价公式为:
(3)
式中TLI(∑)为综合营养状态指数,Wj为第j种参数的营养状态指数的相关权重,TLI(j)为第j种参数的营养状态指数。计算公式分别为:
TLI(Chl.a)=10(2.5+1.086 lnchl.a)
TLI(TP)=10(9.436+1.624 lnTP)
TLI(TN)=10(5.453+1.694 lnTN)
TLI(SD)=10(5.118-1.941 lnSD)
TLI<30 为贫营养型,TLI 在 30~40 之间为贫中营养型,TLI 在 40~50 之间为中富营养型,TLI>50 为富营养型。
2 结果与讨论 (Results and discussion)
2.1 鱼体样品基本参数变化分析
由表1可知,对比2007年鱼样特征,2015年采集的鱼样种类变为野生鱼,且种类及数量减少,体长变短,体重变轻,鱼龄偏小。
2.2 汞在水生食物链中的积累特征变化
2.2.1 水环境特征的变化
2015年红枫湖水体的透明度为1 m,总氮为0.564 mg·L-1,总磷为1.3 mg·L-1,叶绿素a为3.61 mg·m-3,根据公式计算得治理后水体综合营养状态指数为39.24。并与之前的研究数据结合分析得出以下结果。如图1可以看出,自2008年起水体TLI值开始下降,到2015年TLI值下降为39.24。水体Hg含量由治理前的6.9 ng·L-1[19]降到4.29 ng·L-1。富营养化水体会使养殖鱼类的食物来源更加丰富,生长速度快,使其汞含量由于生长稀释而大大降低,而现在由于污染源的控制及网箱养鱼的取缔,湖水富营养化程度降低,养殖鱼类减少,鱼体中汞的生物稀释作用减弱,这有可能导致鱼类的汞浓度变高。
2.2.2 鱼体汞含量的变化
2015年THg和MeHg在不同鱼体内的分布如图2。鱼类的THg含量范围为10.56~234.40 ng·g-1(鲜重),平均值为79.62 ng·g-1(鲜重)。MeHg含量范围为2.70~110.28 ng·g-1(鲜重),平均值为38.10 ng·g-1(鲜重) 。MeHg占THg的比例的范围为17%~90%,平均值为51%。低于其他研究中鱼体MeHg在THg中的比例(90%以上)[20-22]。本次研究Hg含量在杂食性鱼类中最高,其次为肉食性,滤食性和草食性较低。其中肉食性鱼体中Hg含量偏低,可能是由于所采的爬虎鱼年龄小,生长时间短。

图1 2015年与2007年红枫湖富营养化状态指数及Hg含量变化注:2008年红枫湖开始进行综合治理,2003—2009年及2011—2013年的富营养化状态指数数据分别引用于郭云等[17]和詹苏等[18]。治理前水体THg数据引用何天容等[19]。Fig. 1 The changes of trophic level index (TLI) and water Hg concentration of Hongfeng Reservoir (HF) between 2007 and 2015Note: HF began its comprehensive management in 2008. The trophic level index of HF during 2003—2009 cite from Guo et al[17];the trophic level index of HF during 2011—2013 cite from Zhan et al [18], THg concentration data in water before the environment improvement cite from He et al[19].

表1 2007年与2015年鱼样特征参数对比Table 1 Comparison of characteristic parameters of fish samples between 2007 and 2015
注:2007年鱼样特征参数引自何天容文章[3]。
Note: the characteristic parameters of fish samples in 2007 cited from He Tianrong’s paper[3].

图2 红枫湖鱼体的Hg含量及MeHg占THg的比例(2015年)注:“N”表示鱼种的数量; C. p, 草鱼, C. a, 鲫鱼, H. l, 白条, S. e, 赤精鱼, H. m, 白鲢, A. r, 爬虎鱼。Fig. 2 Concentrations of Hg and the proportion of MeHg in THg of fishes in HF in 2015Note: “N” represents the number of collected samples. C. p, Ctenopharyngodon idellus; C. a, Carassius auratus; H. l, Hemiculter lceucisculus; S. e, Scardinius erythrophthalmus; H. m, Hypophthal michthysomlitrix; A. r, Abbottina rivularis.

图3 5个水库鱼体Hg含量对比图注: HF-红枫湖, BHH-百花湖, HJD-洪家渡, WJD-乌江渡, DF-东风; “Y”表示年份, “Max”表示最大值,“Average”代表平均值,“Min”代表最小值。红枫湖2007年鱼体汞含量数据引自何天容等[3],百花湖水库鱼体汞含量数据引自张勇[23],洪家渡鱼体汞含量数据引自姚珩等[5],乌江渡及东风水库鱼体汞含量引自蒋红梅[1]。Fig. 3 Comparison of Hg concentration in fish from five reservoirsNote: HF-Hongfeng Reservoir, BH-Baihua Reservoir, HJD-Hongjiadu Reservoir, WJD-Wujiangdu Reservoir, DF-Dongfeng Reservoir; “Y” means year, “Max” is maximal value, “Average” means average value, “Min” means minimum value. Fish Hg concentration in fishes of HF in 2007 cited from He et al[3], Hg concentration in fishes of BH cited from Zhang[23], Hg concentration in fishes of HJD cited from Yao et al[5], Hg concentration in fishes of WJD and DF cited from Jiang et al[1].
由图3可知,何天容等[3]在2007年对红枫湖鱼体Hg含量进行测定,THg含量范围为3.20~150.00 ng·g-1(鲜重),平均值为32.00 ng·g-1(鲜重);MeHg含量为0.15~53.00 ng·g-1(鲜重),平均值为12.00 ng·g-1(鲜重);MeHg在THg中的比例范围为0.8%~96%,平均值为43%[3]。对比本研究的结果,2015年鱼体Hg含量显著升高,其中平均THg含量增加140%;平均MeHg含量增加210%;MeHg在THg中占得比例平均增加18%。可能的原因是2007年采到多为网箱养鱼,而目前红枫湖已取缔网箱养鱼,本次实验采的均为野生鱼。由表1可知,养殖鱼类较野生鱼类个体大,生长速度快,周期短,很大程度上对鱼体内的Hg积累起到生物稀释作用。同时也可能由于环境的改变使得水体中食物链结构发生改变进而影响鱼体Hg含量及甲基化程度。
同乌江流域的其他水库比,红枫湖2015年鱼体THg与MeHg含量接近张勇[23]2015对百花湖及姚珩等[5]2008年对洪家渡所采的野生鱼类THg及其MeHg的含量范围,但明显高于乌江渡与东风水库的网箱鱼的含量(图3)。例如对比蒋红梅等[1]2005年对乌江渡及东风鱼体测定的结果,2015年红枫湖野生鱼体内的THg比2005年所采集的乌江渡网箱鱼体内的THg高1.9倍,而MeHg高1.3倍;2015年红枫湖野生鱼体内的THg比2005年东风水库鱼体THg高2.0倍,而MeHg高2.6倍。
此外,本次研究还采集了底栖生物和浮游生物,其中底栖生物的THg含量范围为16.52~38.06 ng·g-1(鲜重),平均含量为25.33 ng·g-1(鲜重);MeHg占THg的比例为27%。MeHg含量范围为1.20~22.87 ng·g-1(鲜重),平均值含量为11.25 ng·g-1(鲜重)。浮游动植物的THg含量分别为41.11 ng·g-1(鲜重)和32.76 ng·g-1(鲜重),MeHg含量分别为10.44 ng·g-1(鲜重)和3.48 ng·g-1(鲜重)。MeHg占THg的比例分别为11%和8%。底栖生物和浮游生物的Hg含量偏高,可能原因是底栖生物在生长过程中从沉积物中(沉积物中的THg含量为751.20 ng·g-1(鲜重) (未发表数据))吸收Hg,而浮游生物在生长过程中也会吸收水体及悬浮颗粒有机物中的Hg。
2.2.3 水生食物链特征的变化
δ13C值能表明生物的食物来源,δ13C值的差异大,说明生物的食物组成和生活习性差异大,δ15N值用于确定生物的营养层次,δ15N值越高,表明营养层次越高。因此,用δ13C值和δ15N值来表示水生食物链的特征。
2007年红枫湖鱼类的δ13C范围为(-26.80~-14.20)[24],2015年鱼类δ13C值范围为(-31.07~-15.67),说明相比于2007年采集的养殖鱼类2015年采集的野生鱼类的食物来源更为复杂。
由公式(2)可知,2015年红枫湖食物链的实际长度为3.9,但是若仅以其中的鱼类的δ15N值推算食物链长度为5.5。推算的理论值高于实际值,说明红枫湖中的基底物受到了严重的氮污染,使得浮游生物δ15N值偏高。
鉴于之前的研究对象只采集了红枫湖的鱼类,因此用鱼类的δ15N值推算治理前的食物链长度。跟据以前的研究数据[24],2007年红枫湖的食物链长度为4.1,根据实际值与理论值相差约1.6,可以推算出治理前实际长度应该为2.5。
对比2年的变化情况可见:红枫湖食物链长度从2.5增加到3.9。同时发现2015年红枫湖的食物链长度略高于余杨等[6]对三峡水库的鱼类的食物链长度测定(3.7)。但低于东非地区富营养化湖泊中的食物链长度(4.9)[25]。此外与欧美国家相比,2015年的食物链长度,略高于意大利、美国以及加拿大等地的研究报道值(食物链长度分别为3.50、2.19与3.36)[26-28]。各地区食物链长度的差异可能是由湖泊资源可用性、生态系统大小、生态稳定性等因素不同引起的。
另外,2015年采集的红枫湖底栖生物δ13C值范围为(-28.01‰~-20.25‰),浮游动植物的δ13C值分别为-34.75‰和-35.75‰。底栖生物δ15N值的范围为(9.99‰~13.81‰),浮游动植物的δ15N值分别为20.79‰和21.08‰。底栖生物和浮游动植物δ15N值明显偏高说明红枫湖受到周边的人为活动影响较大,由于浮游生物的δ15N值季节性变化明显,若以浮游生物为生物基准会影响食物链其他营养级的同位素特征。
2.2.4 水生食物链中生物传输放大率的变化
为了与之前的研究进行比较,本研究用鱼体的δ15N值与其THg含量(经log10转换)做回归分析。通常用斜率值表示鱼体内Hg含量随营养级的累积程度,斜率越大说明Hg在鱼体内的生物放大率越高,由图4可以看出,2015年红枫湖生物体中THg含量与δ15N值的斜率为0.084,2007年的生物放大率为0.14,其生物传输放大率明显降低。高于乌江流域其他水库的研究结果(斜率为0.06)[24],但低于东非地区、美国及加拿大等地的报道(0.13~0.29)[27-28]及余杨等[6]对三峡水库神农溪干流的测定(0.12),高于三峡水库万州干流的测定(0.04)[6]。说明Hg在红枫湖食物链上的生物传输放大效率总体偏低,可能的原因在于本次采样所获样品中没有大型肉食性鱼类。2015年的lg(THg)与δ15N值的相关性不太显著可能是由于样品量不足引起的。
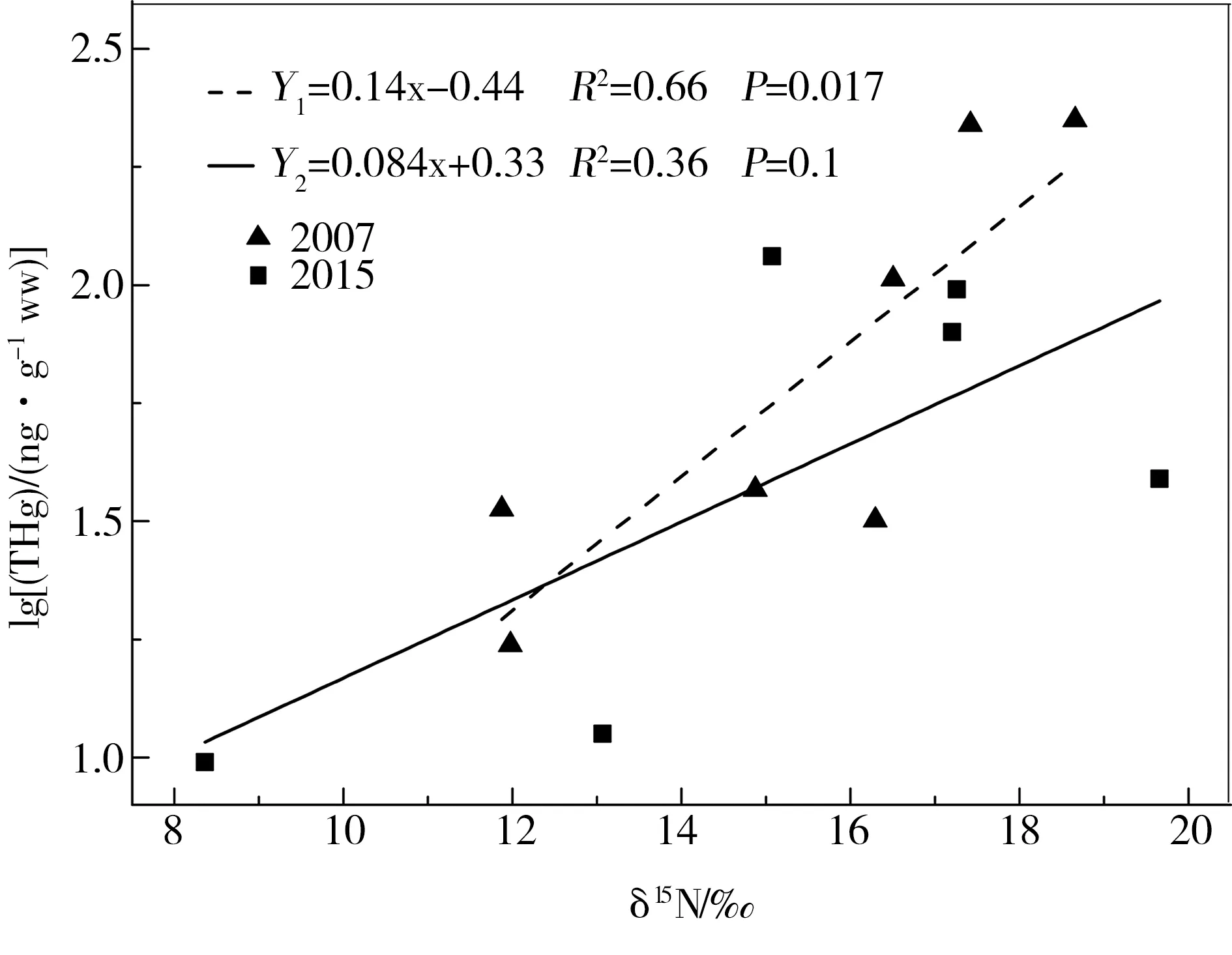
图4 2007年和2015年的 lg(THg)与δ15N的关系注:“Y”表示年份,2007年数据引自冯新斌[24]。Fig. 4 Correlation of lg(THg) with δ15N in 2007 and 2015Note:“Y” represents “year”, data in 2007 cited from Feng et al[24].
综上所述:
(1)水体富营养化程度的降低减弱了生物稀释作用,导致鱼体汞含量上升,但高强度的捕捞使得长度变化很小,并未导致鱼体中的汞含量显著上升。
(2)氮污染源导致的浮游生物δ15N值偏高,干扰通过稳定氮同位素判断食物链长度的准确度。
致谢:感谢贵州大学谭清友同学、太原理工大学张勇同学在野外采样中的帮助。
[1] 蒋红梅. 水库对乌江河流汞生物地球化学循环的影响[D]. 北京:中国科学院研究生院, 2005: 105-112
Jiang H M. Effects of hydroelectric reservoir on the biogeochemical cycle of mercury in the Wujiang River [D]. Beijing: Graduate School of Chinese Academy of Sciences, 2005: 105-112 (in Chinese)
[2] Yan H Y, Feng X B, Shang L H, et al. The variations of mercury in sediment profiles from a historically mercury-contaminated reservoir, Guizhou Province, China [J]. Science of the Total Environment, 2008, 407(1): 497-506
[3] 何天容, 吴玉勇, 潘鲁生, 等. 红枫湖鱼体中汞形态分布特征[J]. 西南大学学报: 自然科学版, 2010, 32(7): 78-82
He T R, Wu Y Y, Pan L S, et al. Distribution of mercury species and their concentrations in fish in Hongfeng Reservoir [J]. Journal of Southwestern University: Natural Science Edition, 2010, 32(7): 78-82 (in Chinese)
[4] 王明猛, 闫海鱼, 李太山, 等. 陡河水库鱼体汞的生物积累初探[J]. 生态毒理学报, 2014, 9(5): 986-992
Wang M M, Yan H Y, Lin T S, et al. Preliminary study on bioaccumulation of mercury in fish from Douhe Reservoir [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 986-992 (in Chinese)
[5] 姚珩, 冯新斌, 闫海鱼, 等. 乌江洪家渡水库鱼体汞含量[J]. 生态学杂志, 2010, 29(6): 1155-1160
Yao H, Feng X B, Yan H Y, et al. Mercury concentration in fish body in Hongjiadu reservoir in Guizhou Province [J]. Chinese Journal of Ecology, 2010, 29(6): 1155-1160 (in Chinese)
[6] 余杨, 王雨春, 周怀东, 等. 三峡水库蓄水初期鱼体汞含量及其水生食物链累积特征[J]. 生态学报, 2013, 33(13): 4059-4067
Yu Y, Wang Y C, Zhou H D, et al. Mercury contents in fish and its biomagnification in the food web in Three Gorges Reservoir after 175m impoundment [J]. Acta Ecologica Sinica, 2013, 33(13): 4059-4067 (in Chinese)
[7] Liu B, Yan H Y, Wang C P, et al. Insights into low fish mercury bioaccumulation in a mercury-contaminated reservoir, Guizhou Reservoirs, China [J]. Environmental Pollution, 2012, 160(1): 109-117
[8] Yan H Y, Rustadbakken A, Yao H, et al. Total mercury in wild fish in Guizhou Reservoirs, China [J]. Journal of Environmental Sciences, 2010, 22(8): 1129-1136
[9] Pan K, Chan H, Yin K T, et al. Low mercury levels in marine fish from estuarine and coastal environments in southern China [J]. Environmental Pollution, 2014, 185(4): 250-257
[10] 闫海鱼, 冯新斌, 商立海, 等. 天然水体中痕量汞的形态分析方法研究[J]. 分析测试学报, 2003, 22(5): 10-13
Yan H Y, Feng X B, Shang L H, et al. Speciation analysis of ultra trace levels of mercury in natural waters [J]. Journal of Instrumental Analysis, 2003, 22(5): 10-13 (in Chinese)
[11] 王翠萍, 闫海鱼, 刘鸿雁, 等. 使用Lumex测汞仪快速测定固体样品中总汞的方法[J]. 地球与环境, 2010(3): 378-382
Wang C P, Yan H Y, Liu H Y, et al. The method of rapidly measuring total mercury in solid samples using lumex analytical equipment [J]. Earth and Environment, 2010(3): 378-382 (in Chinese)
[12] 闫海鱼, 冯新斌, 商立海, 等. GC-CVAFS 法测定鱼体内甲基汞的分析方法研究[J]. 分析测试学报, 2005, 24(6): 78-80
Yan H Y, Feng X B, Shang L H, et al. A methodological study of methyl mercury in fish using GC-CVAFS [J]. Journal of Instrume Journal of Instrumental Analysis, 2005, 24(6): 78-80 (in Chinese)
[13] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 100-246
[14] 林少君, 贺立静, 黄沛生, 等. 浮游植物中叶绿素a提取方法的比较与改进[J]. 生态科学, 2005, 24(1): 9-11
Lin S J, He L J, Huang P S, et al. Comparison and improvement on the extraction method for chlorophyll a in phytoplankton [J]. Ecologic Science, 2005, 24(1): 9-11 (in Chinese)
[15] Post D M. Using stable isotopes to estimate trophic position: Models, methods and assumptions [J]. Ecology, 2002, 83(3): 703-718
[16] 金相灿, 屠清瑛. 湖泊富营养化调查规范[M]. 北京: 中国环境科学, 1990: 286-291
[17] 郭云, 赵宇中, 龙胜兴, 等. 湖泊富营养化治理成效阶段水环境特征研究——以贵阳市饮用水源地红枫湖为例[J]. 环境污染与防治, 2015, 37(6): 55-62
Guo Y, Zhao Y Z, Long S X, et al. Study on water environment characteristics in the stage of governance effect of lake eutrophication: Taking drinking water sources of Hongfeng Lake in Guiyang as an example [J]. Environmental Pollution and Control, 2015, 37(6): 55-62 (in Chinese)
[18] 詹苏, 杨大鹏. 红枫湖水体的富营养化特征评价[J]. 贵州农业科学, 2012, 40(10): 200-203
Zhan S, Yang D P. Characteristics evaluation of eutrophication about Hongfeng Lake [J]. Guizhou Agricultural Sciences, 2012, 40(10): 200-203 (in Chinese)
[19] 何天容, 吴玉勇, 冯新斌. 富营养化对贵州红枫湖水库汞形态和分布特征的影响[J]. 湖泊科学, 2010, 22(2): 208-214
He T R, Wu Y Y, Feng X B. The impact of eutrophication on distribution and speciation in Hongfeng Reservoir, Guizhou Province [J]. Journal of Lake Sciences, 2010, 22(2): 208-214 (in Chinese)
[20] Allen-gil S M, Gilroy D J, Curtis L R. An ecoregion approach to mercury bioaccumulation by fish in reservoirs [J]. Archives of Environmental Contamination and Toxicology, 1995, 28(1): 61-68
[21] Bloom N S. On the chemical form of mercury in edible fish and marine invertebrate tissue [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1992, 49(5): 1010-1017
[22] Scheuhammer A M, Meyer M W, Sandheinrich M B, et al. Effects of environmental methylmercury on the health of wild birds, mammals, and fish [J]. Ambio A Journal of the Human Environment, 2007, 36(1): 12-18
[23] 张勇. 贵州百花湖汞污染研究及污染控制成果浅析[D]. 太原: 太原理工大学, 2016: 38-42
Zhang Y. The research of mercury pollution in Guizhou Baihua Lake and analysy of pollution control results [D]. Taiyuan: Taiyuan University of Technology, 2016: 38-42 (in Chinese)
[24] 冯新斌. 乌江流域水库汞的生物地球化学过程及环境效应[M]. 北京: 科学出版社, 2016: 325-350
[25] Poste A E, Muir D C G, Guildford S J, et al. Bioaccumulation and biomagnification of mercury in African lakes: The importance of trophic status [J]. Science of the Total Environment, 2014, 506: 126-136
[26] Dominik J, Tagliapietra D, Bravo A G, et al. Mercury in the food chain of the Lagoon of Venice, Italy [J]. Marine Pollution Bulletin, 2014, 88(1-2): 194-206
[27] Lavoie R A, Hebert C E, Rail J F, et al. Trophic structure and mercury distribution in a Gulf of St. Lawrence (Canada) food web using stable isotope analysis [J]. Science ofthe Total Environment, 2010, 408(22): 5529-5539
[28] Zhang L, Campbell L M, Johnson T B. Seasonal variation in mercury and food web biomagnification in Lake Ontario, Canada [J]. Environmental Pollution, 2012, 161(1): 178-184
