功能化离子液体修饰多壁碳纳米管固定化Candida antarctic lipase B
2018-01-29相欣然万晓梅索红波胡燚
相欣然,万晓梅,索红波,胡燚
1 引言
碳纳米管作为一种中空结构的新型一维量子纳米材料,独特的结构赋予其良好的导电传热性能、适宜的比表面积、特殊的孔道结构、高稳定性以及生物相容性等优点,作为一种新型的酶固定化载体在酶工程领域得到了广泛的关注1-4。然而,碳纳米管的表面较为光滑,缺少活性基团,而且碳纳米管之间具有极强的疏水作用,导致其在很多反应体系溶液溶解度低或分散不均匀,因此利用碳纳米管固定化酶存在着固定化效率不高、分散能力较差、酶学性能不佳等缺陷5-7。针对此问题,对碳管表面进行化学修饰,引入功能有机分子,改变载体的表面结构和性质,可有效的改善固定化酶的酶学性能8,9。
离子液体作为一种可设计的绿色溶剂在有机合成、电化学、材料科学、分离工程等领域得到了广泛的应用,而且很多种类的酶在离子液体作为反应介质或添加剂作用下显示出了很好的活性、稳定性和选择性10-12。近年来,离子液体作为一种全新的酶固定化载体表面修饰剂获得了成功应用。Jiang等13将褶皱假丝酵母脂肪酶(CRL)固定在咪唑类离子液体修饰的 Fe3O4-SiO2核壳结构磁性纳米粒子上,并考察了离子液体不同的阴离子对固定化酶酶学性能的影响;结果表明,当以 PF6-作为阴离子时,固定化酶的活性最高。本课题组在之前的研究工作中将功能性离子液体作为一种新型的修饰剂对介孔材料进行表面修饰改性,显著地提高了猪胰脂肪酶(PPL)、洋葱伯克霍尔德菌脂肪酶(BCL)等脂肪酶的活性、热稳定性和重复使用性等酶学性能14-18。
Candida antarctic lipase B (CALB)是一种多功能酶,广泛应用于催化各种反应,如动力学拆分、氨解、酯化、酯交换及水解反应,此外,CALB还具有较强有机溶剂耐受性、热稳定性及对映体特异性等优良特性。其对非水溶性和水溶性物质都用很强的催化活性,可用于许多有机化合物,医药中间体等的合成19-21。MWNTs在酶固定化领域的应用中,采用具有不同阴离子的离子液体表面修饰 MWNTs之前并没有相关报道,而离子液体本身属性的不同会对固定化酶的酶学性能产生影响。通常阴离子对脂肪酶活力影响的差异性远大于阳离子,为了进一步探讨离子液体中阴离子变化对固定化脂肪酶的影响,本文在前期工作基础上将具有不同阴离子的功能化离子液体用于多壁碳纳米管(MWNTs)的表面共价修饰,改变其表面结构和性质,研究修饰前后固定化CALB的酶学性能变化,拓展离子液体作为酶固定化载体修饰剂的应用领域,为相关领域的科研工作者提供一定的参考价值。
2 实验部分
2.1 实验试剂与仪器
试剂:褶皱假丝酵母脂肪酶 B (CALB,10 mg·mL-1,购于 Novozymes);碳纳米管(MWNTs,购于深圳纳米港);1-(3-氨基丙基)咪唑、氯化亚砜(SOCl2)、硝酸、硫酸、四氢呋喃(THF)、盐酸(HCl)、碳酸氢钠(NaHCO3)、溴丁烷、四氟硼酸钠、六氟磷酸钾、NaH2PO4·2H2O、Na2HPO4·12H2O、考马斯亮蓝(G250)、牛血清蛋白、酚酞(指示剂),所用试剂均为分析纯。
仪器:电子天平(JY10001),旋转式恒温水浴振荡器(DSHZ-300A),恒温磁力搅拌器(DSHZ-300A),集热式恒温加热磁力搅拌器(DF-101S),循环水式真空泵(SHZ-III),pH 计(PHS-3C),离心机(5804R),真空冷冻干燥机(FD-1A-50),透射电子显微镜(JEM-200CX,加速电压200 kV),热重分析仪(TGA,STA 409 PC),酶标仪(Model680)。
2.2 实验方法
2.2.1 载体的制备
载体的制备方法如图1所示22,23。具体为:取1 g MWNTs,分散在 2 L 2.6 mol·L-1的硝酸,70 °C搅拌加热回流 48 h,离心(4500 r·min-1,10 min),弃上清液去除无定形碳,用0.22 μm的聚四氟乙烯膜(PTFE)过滤,去离子水洗至中性,滤饼在80 °C真空干燥8 h。将纯化的MWNTs分散在浓酸混合液 H2SO4:HNO3(3 : 1,v/v)中,40 °C 超声 3 h,用0.22 μm PTFE膜过滤,去离子水洗至中性,滤饼 80 °C真空干燥 8 h,得羧基化 MWNTs(MWNTs-COOH)。取100 mg MWNTs-COOH分散在30 mL SOCl2中,氮气保护下,回流搅拌反应24 h,过滤,用无水THF洗涤,室温干燥2 h,得到酰氯官能化MWNTs (MWNTs-COCl);氮气保护下,将MWNTs-COCl与30 mL 1-(3-氨丙基)咪唑,120 °C反应 24 h,经 0.22 μm PTFE 膜过滤,用无水 THF、1 mol·L-1HCl溶液、饱和 NaHCO3溶液洗涤,接着用去离子水洗至中性,最后用乙醇洗涤,60 °C真空干燥过夜,得中间产物A。氮气保护下,将产物A与溴丁烷80 °C反应24 h,经0.22 μm PTFE膜过滤,用无水THF洗涤,室温真空干燥24 h,得到中间产物B。中间产物B在去离子水中与NaBF4,KPF6进行阴离子交换24 h,过滤,得到烷基功能化离子液体修饰的碳纳米管,分别命名为MWNTs-IL(BF4-)、MWNTs-IL(PF6-)。而中间产物 B与 NaH2O4在二氯甲烷中进行阴离子交换24 h,过滤,得到以H2PO4-为阴离子的烷基化离子液体修饰的碳纳米管,命名为 MWNTs-IL(H2PO4-)。
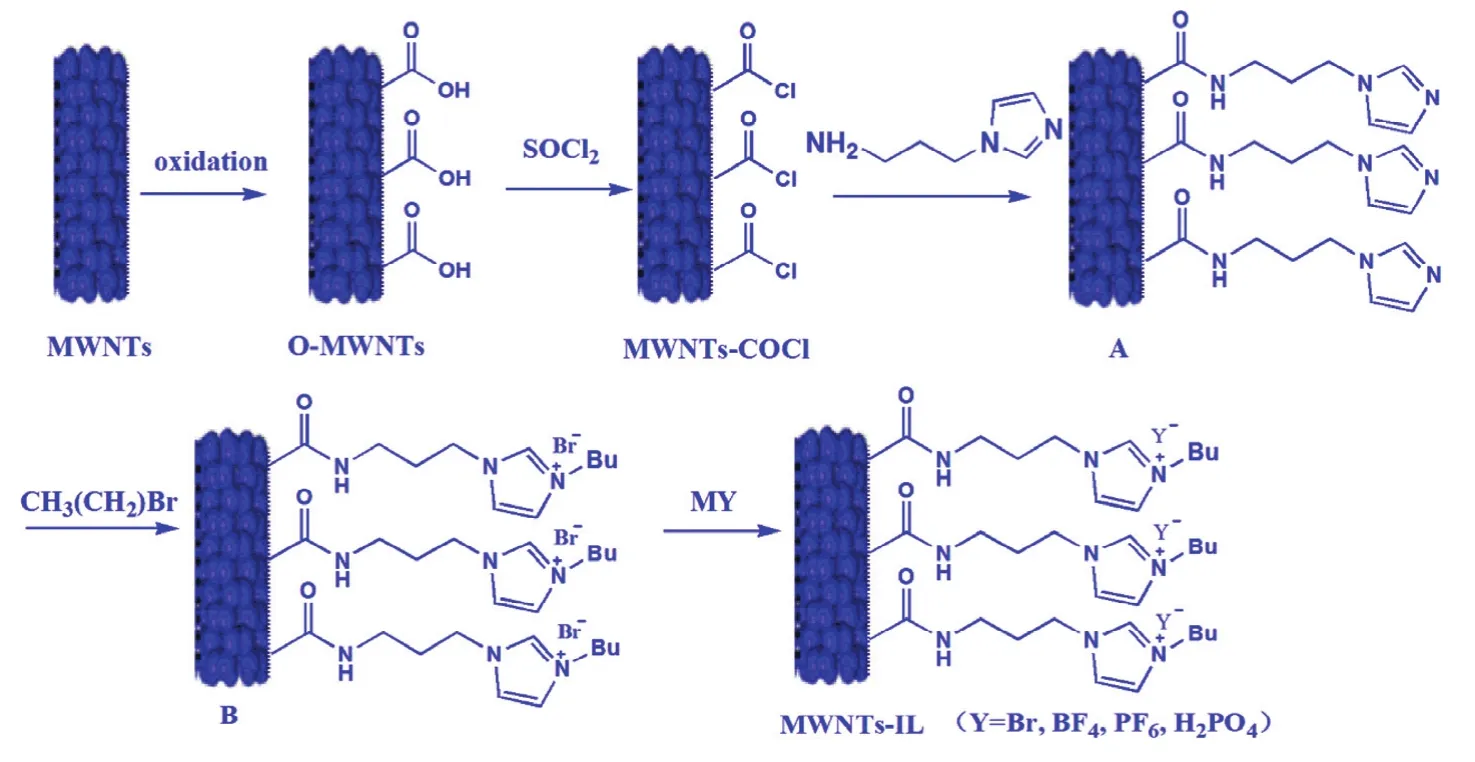
图1 烷基化功能化离子液体修饰MWNTs的制备过程Fig.1 General procedure of synthesis of MWNTs-IL.
2.2.2 载体及的表征
本实验采用德国NETZSCH公司的STA 409 PC型热重分析仪(TGA)测定离子液体在碳纳米管上的负载情况,加热范围为50-700 °C,升温速率10 °C·min-1,在 20 mL·min-1氮气流中进行。采用美国Thermo公司的ESCALAB250XI型X射线光电子能谱(XPS)分析离子液体在碳纳米管上的负载情况,采用日本JEOL公司的JEM-200CX型透射电子显微镜(TEM)和法国Horiba公司的Labram HR800型激光共焦显微拉曼光谱仪(Ramanspectra)分析载体的微观形貌。
2.2.3 固定化酶的制备
取50 mL磷酸缓冲液(PBS,pH = 7.0,0.025 mol·L-1)于 100 mL 锥形瓶中,加入 0.1 g载体(MWNTs、MWNTs-IL(Br-)、MWNTs-IL(BF4-)、MWNTs-IL(PF6-)和 MWNTs-IL(H2PO4-),超声 10 min。将3 mL Lipozyme CALB加入锥形瓶中,加塞密封后置于 30 °C 水浴中,150 r·min-1下震荡反应 7 h后,将混合液抽滤并用大量磷酸缓冲液(PBS,pH = 7.0,0.025 mol·L-1)洗涤数次,于冻干机中冷冻干燥 1 h,即得到固定化 CALB分别记为 MWNTs-CALB、MWNTs-IL(Br-)-CALB、MWNTs-IL(BF4-)-CALB、MWNTs-IL(PF6-)-CALB和MWNTs-IL(H2PO4-)-CALB。
2.2.4 固定化效率的测定
(1) 蛋白含量测定
按照 Bradford的方法24,以牛血清蛋白作为标准蛋白质绘制标准曲线。
(2) 固定化效率测定
测定固定化后残液的吸光值,根据上述得到的标准曲线来计算蛋白浓度。

Ci和Cf分别表示溶液中固定化前酶蛋白的初始浓度和固定化后酶蛋白的最终浓度(mg·mL-1)。
2.2.5 固定化酶酶活测定
(1) 三乙酸甘油酯乳化液的制备
在100 mL锥形瓶中加入60 mL磷酸缓冲液(PBS,pH = 7.0,0.025 mol·L-1),2 g 三乙酸甘油酯,磁力搅拌器强力搅拌10 min使其成为乳化液。
(2) 酶活测定
在上述制备的三乙酸甘油酯乳化液中加入0.1 g固定化CALB,在60 °C,pH = 7.0条件下平稳搅拌反应30 min后立即加入15 mL体积比为1 :1的丙酮-乙醇以终止反应。用 0.05 mol·L-1的NaOH溶液来滴定中和反应过程中产生的酸,其中指示剂为酚酞,记录NaOH的消耗量。酶活定义为:在一定条件下,每分钟催化三乙酸甘油酯生成1 μmol醋酸所需要的酶量。
比活力(U/g CALB) = 固定化CALB的表观活力/每克固定化酶中VALB的含量(2)
2.2.6 最适温度及最适pH
2.2.6.1 最适温度
调节反应液 pH 值为 7.0,分别在 35 °C、40 °C、45 °C、50 °C、55 °C、60 °C、65 °C、70 °C 和 75 °C下磁力搅拌反应30 min,取出后对固定化酶的活力进行测定,以选择最适宜的反应温度。
2.2.6.2 最适pH
调节反应液pH值为6.0、6.5、7.0、7.5、8.0、8.5、9.0和9.5,于60 °C下磁力搅拌反应30 min,取出后对固定化酶的活力进行测定,以选择最适宜的pH。
2.2.7 固定化酶的稳定性
2.2.7.1 热稳定性
将固定化酶置于60 °C水浴中分别保温0、5、10、15和20 min后取出,测定各固定化酶酶活(将各自未保温时所测得的酶活定义为 100%),以考察固定化酶的温度耐受性。
2.2.7.2 重复使用性
取0.1 g固定化酶于60 °C,pH 7.0的反应条件下反应30 min后,抽滤并用磷酸缓冲液洗涤,得到的固定化酶置于冻干机中冷冻干燥1 h,用于下一次反应;将得到的滤液用 0.05 mol·L-1的NaOH溶液进行滴定测定酶活(第一次使用时测定的酶活定义为100%)。
2.2.8 反应动力学参数的测定
配置浓度分别为 5、10、15、20、25和 30 mg·mL-1的三乙酸甘油酯乳化液,测定不同浓度乳化液浓度下反应30 min后各固定化酶的酶活,酶活测定方法同2.2.4。
2.2.9 圆二色性光谱检测
分别取 MWNTs、MWNTs-IL(Br-)、MWNTs-IL(PF6-)、CALB、MWNTs-CALB、MWNTs-IL(Br-)-CALB、MWNTs-IL(PF6-)-CALB溶于磷酸缓冲液(pH 7.0)中,配成所需的浓度。以相应的载为空白,用圆二色谱仪(JASCO-J810)分别对样品的进行定量检测。石英样品池的光程为1 cm,扫描测定波长范围为180-300 nm,扫描速度为50 nm·min-1。每个样品扫描十次取平均值。
3 结果与讨论
3.1 载体的表征
3.1.1 透射电子显微镜
采用 JEM-2100(HR)型透射电镜(TEM)上观察载体的形貌和结构,纯化的 MWNTs、MWNTs-COOH、MWNTs-IL(Br-)、MWNTs-IL(BF4-)、MWNTs-IL(PF6-)及 MWNTs-IL(H2PO4-)的透射电镜图如图 2所示,由图可以看出,修饰过程并没有破坏碳纳米管的结构完整性20。
3.1.2 拉曼光谱(RS)
MWNTs、MWNTs-COOH及MWNTs-IL(PF6)的拉曼光谱如图 3所示,由图可知,修饰前后的碳纳米管均在几个特征区存在吸收,且未发生明显的位移,表明功能化的过程基本没有破坏MWNTs本身的结构。同时,通过R = ID/IG比值(其中I为特征峰的积分面积)来表征,其中R值越大表明碳纳米管缺陷程度越大、有序度越低。通过对吸收峰的面积进行计算发现,相比于 MWNTs(R = 1.049),MWNTs-COOH (R = 1.130)和 MWNTs-IL(PF6) (R = 1.227)的R值略有增大,该结果说明功能化后的碳纳米管的缺陷程度略有增加,有序度略有下降23。该结果与电镜结果一致,进一步证明了表面改性并没有破坏多壁碳纳米管的结构完整性。
3.1.3 热重分析
纯化的MWNTs、MWNTs-IL(Br-)、MWNTs-IL(BF4-)、MWNTs-IL(PF6-)及 MWNTs-IL(H2PO4-)的TG曲线如图4所示,从图中可以看出,原始的MWNTs在600 °C以下比较稳定,而离子液体修饰的 MWNTs表现出有各区域明显的失重,第一区域的失重(-350 °C)可能是MWNTs表面接枝的咪唑盐的分解,第二区域中的显著失重(-580 °C)可能是由于 MWNTs自身的分解,表明离子液体已修饰到MWNTs的表面23,25。
3.1.4 X射线光电子能谱(XPS)
为了进一步确认离子液体成功负载在MWNTs上,利用XPS分析了咪唑环是否存在及离子交换是否进行,如图5。从(a)图中可以看出,MWNTs-IL (PF6)中N信号(402 eV)的存在说明了咪唑环已经存在于MWNTs中;从图(b, c)中可以看出,P信号(136.6 eV)、F信号(686.8 eV)的存在以及MWNTs-IL (PF6)中不存在Br-信号说明阴离子交换成功23,26。
3.2 固定化酶催化活性研究
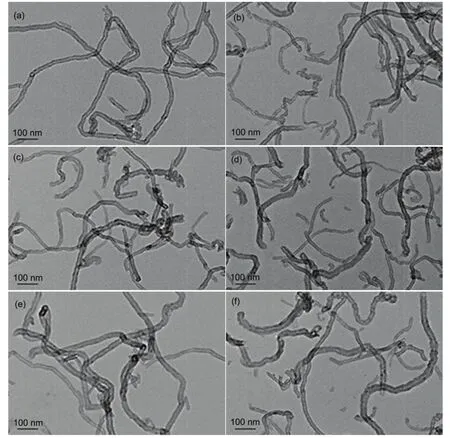
图2 MWNTs (a), MWNTs-COOH (b), MWNTs-IL(Br-) (c), MWNTs-IL(BF4-) (d), MWNTs-IL(PF6-) (e)及MWNTs-IL(H2PO4-) (f)的 TEM图Fig.2 TEM images of the (a) pristine MWNTs, (b) MWNTs-COOH, (c) MWNTs-IL(Br-), (d) MWNTs-IL(BF4-),(e) MWNTs-IL(PF6-), (f) MWNTs-IL(H2PO4-).
修饰前后的碳纳米管固定化CALB的固定化效率及酶活力情况如表 1所示。从表格中可以看出,具有不同阴离子的离子液体修饰碳纳米管固定化酶的负载量略有差异,其中 MWNTs-IL(H2PO4-)-CALB的负载量最高为 81 mg·g-1,是Rastian等27利用等离子体修饰的MWNTs固定化CALB的负载量的 4倍。在此,酶分子与离子液体功能基团之间存在静电、氢键、疏水、范德华力等相互作用28-30。所有离子液体修饰的MWNTs固定化CALB的活性都有了明显提升,可能是由于载体表面的功能化离子液体的存在会使得酶与载体之间的分子作用力在一定程度上改变了酶蛋白构象,使其活性位点暴露出来14-18。其中,以PF6-为阴离子的离子液体修饰载体固定化酶MWNTs-IL(PF6-)-CALB的酶活最高,展现出远高于其它3种固定化酶生物活性,其比活力是未修饰的MWNTs-CALB的6.06倍,是Cao等31利用等离子体修饰的MWN Ts固定化CALB的活力的2.1倍。酶分子中的―OH、―NH2等基团有可能与载体表面的离子液体形成氢键,使得维持原构象的次级键发生一定程度的变化,导致活性部位色氨酸残基的微环境的改变,从而影响酶活32,33。相比其它几种阴离子,PF6-具有较低的氢键形成能力,可以减少与酶分子的氢键作用34,而且其具有较低的亲水性和亲核性,可以减少溶剂与酶结构中正电荷区的作用,从而使酶构象改变缓慢35,而有较强的亲水性和亲核性的离子液体在一定程度上会破坏酶的折叠结构使酶活降低32,33。该结果与Jiang等13研究具有不同阴离子的咪唑类离子液体修饰磁性纳米材料固定化褶皱假丝酵母脂肪酶(CRL)得出的结论一致,当以 PF6-作为阴离子时,固定化酶的活性最高。此结果与本课题组之前研究具有不同阴离子的离子液体修饰SBA-15固定化PPL时,以 BF4-作为阴离子时固定化酶的活性最高的结论不同15。
3.2.1 固定化酶的最适温度和最适pH
3.2.1.1 最适温度
反应温度对固定化 CALB活力的影响如图 6所示,由图可知,与游离酶的最适温度(55 °C)相比,MWNTs-CALB 的最适温度降低了 10 °C,而MWNTs-IL(Br-)-CALB、MWNTs-IL(BF4-)-CALB、MWNTs-IL(PF6-)-CALB、MWNTs-IL(H2PO4-)-CALB的最适温度反而升高了 5 °C。相比于游离酶和MWNTs-CALB,碳纳米管经离子液体修饰后,固定化CALB对高温耐受性有所增强,可能是固定化酶体系当中离子液体的引入使得酶和载体之间的氢键、疏水作用以及静电作用有所增强,降低了CALB的动能,增强了酶的结构稳定性,减少了温度对其的影响14-18。
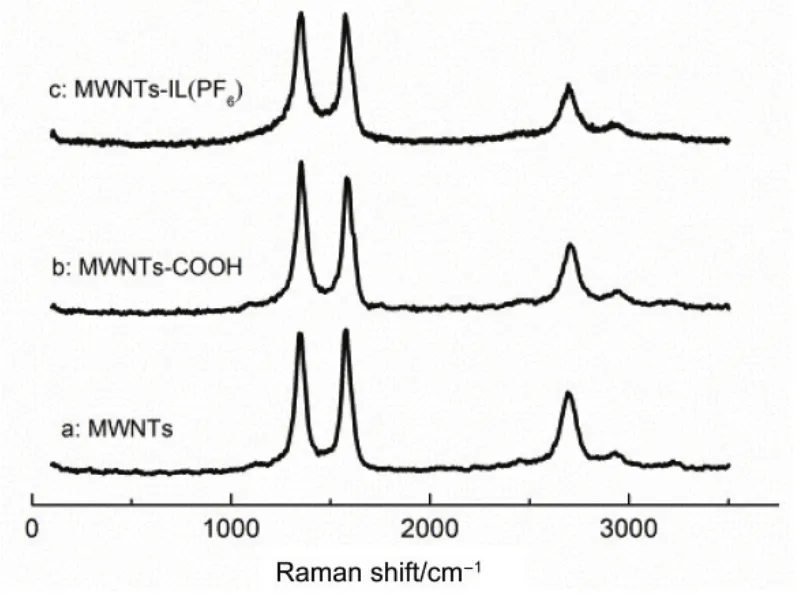
图3 (a) MWNTs, (b) MWNTs-COOH,(c) MWNTs-IL(PF6)的拉曼光谱图Fig.3 Raman spectra for (a) MWNTs,(b) MWNTs-COOH, (c) MWNTs-IL (PF6).
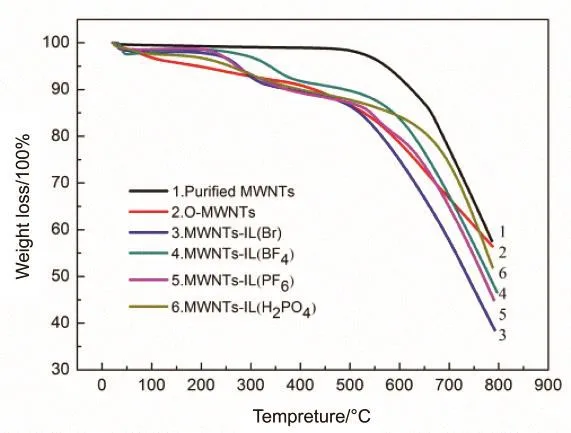
图4 修饰前后载体的TGA图Fig.4 TGA curves of pristine MWNTs and functionalized MWNTs.
3.2.1.2 最适pH
图7揭示了固定化CALB在pH 6.0-9.5范围内的酶活力,由图可知,游离酶和MWNTs-CALB的最适pH值为7.0,而载体经离子液体修饰后,固定化CALB的最适pH值升至8.0,且对高pH值的耐受性增强,这可能与载体表面的电荷有关36,碳纳米管上负载的离子液体所具有的离子降低了固定化酶对pH值的敏感度,同时酶结构的改变使得固定化酶的最适pH升至8.016,37。这与课题组之前离子液体修饰的SBA-15固定PPL时最适pH值有所降低,对低pH值的敏感度降低的现象有所不同14,17,18;与离子液体修饰的SiO2固定PPL时最适pH值升高,对高pH值的敏感度降低的现象相同16。
3.2.2 固定化酶的稳定性
3.2.2.1 热稳定性
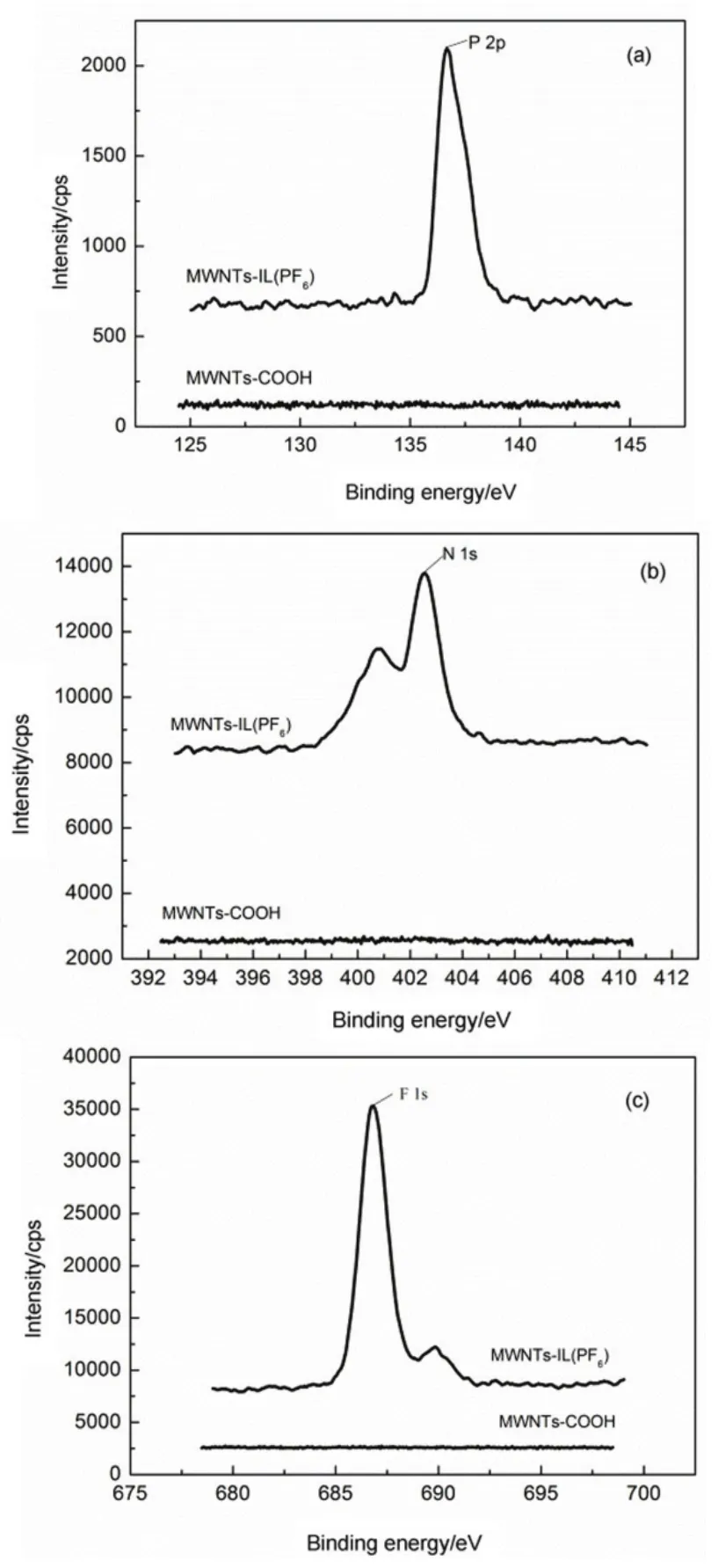
图5 MWNTs-COOH和MWNTs-IL (PF6)的XPS图谱Fig.5 (a) N (1s) region of MWNTs-COOH and MWNTs-IL (PF6-). (b) P (2p) region of MWNTs-COOH and MWNTs-IL (PF6-). (c) F (1s) region of MWNTs-COOH and MWNTs-IL (PF6-).
固定化酶的热稳定性在酶促反应中非常重要。修饰前后的碳纳米管固定化CALB的热稳定性如图8所示,MWNTs-CALB的热稳定性最差,70 °C温浴20 min后,基本丧失酶活。而MWNTs-IL(Br-)-CALB、MWNTs-IL(BF4-)-CALB、MWNTs-IL(PF6-)-CALB、MWNTs-IL(H2PO4-)-CALB的热稳定性都有一定程度的提高,其中,MWNTs-IL(Br-)-CALB的热稳定性最好,保温20 min后,其残余酶活力为初始酶活力的22%。这可能是载体上离子液体与酶蛋白分子之间的氢键、疏水作用及静电相互作用,使其刚性结构增强,阻止酶的构象因高温而受到破坏14-18。
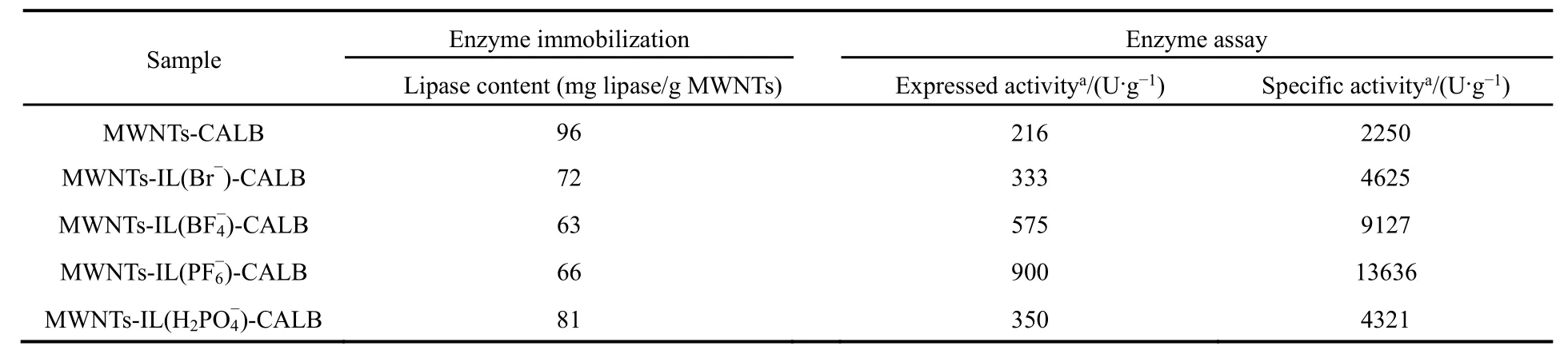
表1 CALB的固定化效率及酶活Table 1 Results of immobilization process of CALB.
3.2.2.2 重复使用性
固定化酶的重复使用性在工业化应用过程中也是一项重要的指标之一,图 9展示了各固定化CALB的重复使用性。由图可以看出,在每次循环使用后,固定化CALB的酶活力均有所下降,离子液体修饰后的碳纳米管固定化CALB的重复使用性能均有所提高,固定化CALB的酶活均有所下降,在重复使用4次后,MWNTs-CALB、MWNTs-IL(Br-)-CALB、MWNTs-IL(BF4-)-CALB、MWNTs-IL(PF6-)-CALB、MWNTs-IL(H2PO4-)-CALB的残余活力分别为2.12%、26.44%、18.38%、20.67%、17.35%,离子液体加强了酶与碳纳米管之间的疏水作用力、氢键作用力及吸附作用,使得酶的结构在重复使用过程中不易被破坏14-18。

图6 温度对固定化酶酶活的影响Fig.6 Effect of temperature on the activity of the immobilized lipases.
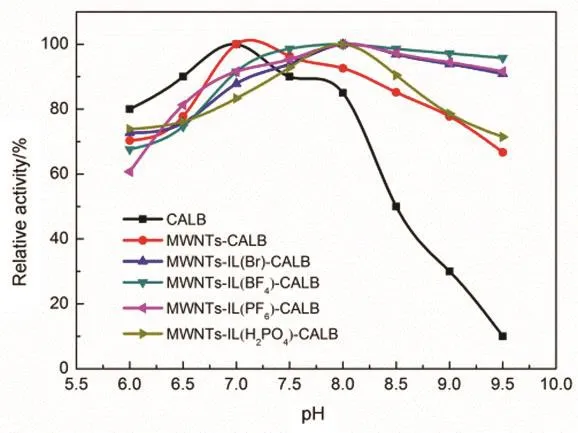
图7 pH对固定化酶酶活的影响Fig.7 Effect of pH on the activity of the immobilized lipases.
3.2.3 酶促反应动力学参数

图8 各固定化酶的热稳定性Fig.8 Thermal stability of the immobilized lipases.

图9 各固定化酶的重复使用性Fig.9 Reusability of the immobilized lipases.

表2 固定化酶的动力学常数Km和VmaxTable 2 Km and Vmax values of immobilized lipases from the Line weaver-Burk plot.

表3 固定化酶和游离酶中不同二级结构的含量Table 3 Fractions of different secondary structures of immobilized enzymes and free enzyme.
酶促反应动力学主要用于考察酶催化的反应速率和各种因素对反应速度的影响。动力学研究为确定酶催化最佳反应条件和最大化酶催化反应效率提供了有力的手段。Km值代表酶和底物之间的亲合力,Km值越高代表酶与底物的亲和力越低。动力学参数Vmax代表酶的最大反应速度,反映了固定化酶的特性。
本实验根据米氏方程(公式(3))来考察修饰前后的固定化酶的Km和Vmax的变化。
酶的Km及Vmax,结果如表2所示。MWNTs-CALB、MWNTs-IL(Br-)-CALB、MWNTs-IL(BF4-)-CALB、MWNTs-IL(PF6-)-CALB及 MWNTs-IL(H2PO4-)-CALB的Km分别为25.16、14.59、4.11、5.84、8.42 mg·mL-1,离子液体修饰的碳纳米管固定化CALB对底物的亲和力高于MWNTs-CALB,进一步说明离子液体的引入增强了酶与底物之间的亲和力。
3.2.4 圆二色性光谱分析

图10 固定化酶和游离酶的CD光谱图Fig.10 CD spectrum of immobilized enzymes and free enzyme.
圆二色谱主要是利用蛋白质二级结构的不对称性检测酶分子二级结构的变化。本实验选择酶活最高的MWNTs-IL(PF6-)-CALB和稳定性最好的MWNTs-IL(Br-)-CALB作为考察对象与游离酶及未修饰碳管固定化酶 MWNTs-CALB做对比,分析其二级结构的变化对酶学性能产生的影响。根据CD谱图与数据分析(如图10和表3),可以发现3种固定化酶的α螺旋均出现了一定程度的下降,MWNTs-IL(PF6-)-CALB的变化幅度较小,说明固定化过程对酶的活性位点造成的影响较小,酶活损失较低;固定化酶 MWNTs-IL(Br-)-CALB的 β折叠显示出一个明显上升,说明酶的刚性得到一定程度的增强,其稳定性得以提升38,与之前的实验结果相印证。
4 结论
本文利用具有不同阴离子的功能化离子液体修饰碳纳米管,对修饰后的载体进行了TEM、RS、TGA和XPS等表征,然后将CALB固定于修饰后的碳纳米管上,并考察其酶学性质,得出以下结论:通过 MWNTs表面改性使载体表面连接上具有不同的阴离子(Br-、BF4-、PF6-、H2PO4-)的离子液体这一过程并没有破坏碳纳米管的结构完整性,并通过对各固定化CALB的动力学参数的考察,证实了离子液体的引入增强了酶与底物之间的亲和力。碳纳米管经离子液体修饰后,相比于未经修饰的 MWNTs-CALB,固定化 CALB的活性都有了明显提高,对高温、高pH值耐受性有所增强,热稳定性和重复使用性也都有一定程度的提高。离子液体的阴离子不同对修饰碳纳米管固定化CALB的酶学性能有很大程度的影响,当以PF6-作为离子液体的阴离子时,固定化酶的比活力最高,达到 13636 U·g-1,是未修饰的 MWNTs-CALB的6倍;而以Br-作为离子液体的阴离子时,固定化酶的热稳定性得到最好的改善。
(1) Min, K.; Yoo, Y. J. Biotechnol. Bioproc. E 2014, 19, 553.doi: 10.1007/s12257-014-0173-7
(2) Mehra, N. K.; Mishra, V.; Jain, N. K. Biomaterials 2014, 35,1267. doi: 10.1016/j.biomaterials.2013.10.032
(3) Feng, W.; Ji, P. Biotechnol. Adv. 2011, 29, 889.doi: 10.1016/j.biotechadv.2011.07.007
(4) Xiang, X.; Huang, H.; Hu, Y. Chin. J. Inorg. Chem. 2017, 33, 1.[相欣然,黄 和,胡 燚. 无机化学学报, 2017, 33, 1.]doi: 10.11862/CJIC.2017.016
(5) Cao, L. Q. Curr. Opin. Chem. Biol. 2005, 9, 217.doi: 10.1016/j.cbpa.2005.02.014
(6) Javey, A.; Kim, H.; Brink, M.; Wang, Q.; Ural, A.; Guo, J.;Mcintyre, P.; Mceuen, P.; Lundstrom, M.; Dai, H. J. Nat. Mater.2002, 1, 241. doi: 10.1038/nmat769
(7) Wen, S.; Liu, H.; Cai, H.; Shen, M.; Shi, X. Adv. Healthcare Mater. 2013, 2, 1267. doi: 10.1002/adhm.201200389
(8) Qiu, L.; Chen, Y.; Yang, Y.; Xu, L.; Liu, X. J. Nanomater. 2013,2013, 8. doi: 10.1155/2013/252417
(9) Wang, Z. H.; Luo, G. Chin. J. Anal. Chem. 2003, 31, 1004. [王宗花, 罗国安. 分析化学, 2003, 31, 1004.]
(10) Zhao, H. J. Chem. Technol. Biotechnol. 2016, 91, 25.doi: 10.1002/jctb.4837
(11) Gao, W.; Zhang, F.; Zhang, G.; Zhou, C. Biochem. Eng. J.2015, 99, 67. doi: 10.1016/j.bej.2015.03.005
(12) Kumar, A.; Venkatesu, P. Int. J. Biol. Macromol. 2014, 63,244. doi: 10.1016/j.ijbiomac.2013.10.031
(13) Jiang, Y.; Guo, C.; Xia, H.; Mahmood, I.; Liu, C.; Liu, H.J. Mol. Catal. B 2009, 58, 10.doi: 10.1016/j.molcatb.2008.12.001
(14) Hu, Y.; Tang, S.; Jiang, L.; Zou, B.; Yang, J.; Huang, H.Process. Biochem. 2012, 47, 2291.doi: 10.1016/j.procbio.2012.09.007
(15) Zou, B.; Hu, Y.; Yu, D.; Jiang, L.; Liu, W.; Song, P.Colloid Surf. B 2011, 88, 93.doi: 10.1016/j.colsurfb.2011.06.014
(16) Zou, B.; Hu, Y.; Cui, F.; Jiang, L.; Yu, D.; Huang, H.J. Colloid Interf. Sci. 2014, 417, 210.doi: 10.1016/j.jcis.2013.11.029
(17) Zou, B.; Hu, Y.; Jiang, L.; Jia, R.; Huang, H. Ind. Eng.Chem. Res. 2013, 52, 2844. doi: 10.1021/ie303363p
(18) Zou, B.; Hu, Y.; Yu, D.; Xia, J.; Tang, S.; Liu, W.; Huang,H. Biochem. Eng. J. 2010, 53, 150.doi: 10.1016/j.bej.2010.09.005
(19) Tsai, S. J. Mol. Catal. B 2016, 127, 98.doi: 10.1016/j.molcatb.2014.07.010
(20) Idris, A.; Bukhari, A. Biotechnol. Adv. 2012, 30, 550.doi: 10.1016/j.biotechadv.2011.10.002
(21) Cai, C.; Gao, Y.; Liu, Y.; Zhong, N.; Liu, N. Food Chem.2016, 212, 205. doi: 10.1016/j.foodchem.2016.05.167
(22) Tan, H.; Feng, W.; Ji, P. Bioresource Technol. 2012, 115,172. doi: 10.1016/j.biortech.2011.10.066
(23) Park, M. J.; Lee, J. K.; Lee, B. S.; Lee, Y. W.; Choi, I. S.;Lee, S. G. Chem. Mater. 2006, 18, 1546.doi: 10.1021/cm0511421
(24) Bradford, M. M. Anal. Biochem. 1976, 72, 248.doi: 10.1006/abio.1976.9999
(25) Pourjavadi, A.; Doulabi, M. J. Polym. Sci. Pol. Chem. 2014,52, 3166. doi: 10.1002/pola.27372
(26) Yu, B.; Zhou, F.; Mu, Z.; Liang, Y.; Liu, W. Tribol. Int.2006, 39, 879. doi: 10.1016/j.triboint.2005.07.039
(27) Rastian, Z.; Khodadadi, A. A.; Guo, Z.; Vahabzadeh, F.;Mortazavi, Y. Appl. Biochem. Biotechnol. 2016, 178, 974.doi: 10.1007/s12010-015-1922-6
(28) Camarero, J. A. Biopolymers 2008, 90, 450.doi: 10.1002/bip.20803
(29) Gao, Y.; Kyratzis, I. Bioconjugate Chem. 2008, 19, 1945.doi: 10.1021/bc800051c
(30) Matsuura, K.; Saito, T.; Okazaki, T.; Ohshima, S.; Yumura,M.; Iijima, S. Chem. Phys. Lett. 2006, 429, 497.doi: 10.1016/j.cplett.2006.08.044
(31) Cao, X.; Zhang, R.; Tan, W.; Wei, C.; Wang, J.; Liu, Z.;Chen, K.; Ouyang, P. Korean J. Chem. Eng. 2016, 33,1653. doi: 10.1007/s11814-016-0002-0
(32) Pan, S.; Liu, X.; Xie, Y.; Yi, Y.; Li, C.; Yan, Y.; Liu, Y.Bioresource Technol. 2010, 101, 9822.doi: 10.1016/j.biortech.2010.07.107
(33) Lue, B.; Guo, Z.; Xu, X. Process Biochem. 2010, 45, 1375.doi: 10.1016/j.procbio.2010.05.024
(34) Persson, M.; Bornscheuer, U. T. J. Mol. Catal. B 2003, 22,21. doi: 10.1016/S1381-1177(02)00294-1
(35) Lozano, P.; De Diego, T.; Gmouh, S.; Vaultier, M.; Iborra, J.L. Biocatal. Biotransf. 2005, 23, 169.doi: 10.1080/10242420500198657
(36) Gao, S.; Wang, W.; Wang, Y.; Luo, G.; Dai, Y. Bioresource Technol. 2010, 101, 7231.doi: 10.1016/j.biortech.2010.04.089
(37) Kaar, J. L.; Jesionowski, A. M.; Berberich, J. A.; Moulton,R.; Russell, A. J. J. Am. Chem. Soc.2003, 125, 4125.doi: 10.1021/ja028557x
(38) Rahman, R.; Tejo, B. A.; Basri, M.; Rahman, M.; Khan, F.;Zain, S. M.; Siahaan, T. J.; Salleh, A. B. Appl. Biochem.Biotechnol. 2004, 118, 11. doi: 10.1385/ABAB:118:1-3:011
