水-环己酮-甲基异丁基酮液液相平衡数据的测定与关联
2018-01-29崔鹏刘海于雪敏夏青李青松
崔鹏,刘海,于雪敏,夏青,李青松
1 引言
环己酮是一种重要的有机化学中间体和优良溶剂,广泛应用于纺织、化纤、汽车、电子、机械、合成医药、皮革等领域1。目前,国内绝大部分环己酮的制备采用环己烷液相氧化法2,3,苯加氢制备环己烷、环己烷氧化、过氧化物分解、环己醇脱氢、精馏得到环己酮。其中氧化反应、分解反应以及真空精馏过程中均会产生废水(不包括皂化废碱),其化学需氧量(COD)为 7000-1l000 mg·L-14,5。环己酮对环境和人体健康都会产生严重危害6。目前,工业上含酮废水的处理主要有气提法、电解法、吸附法等7-11,国内大部分环己酮生产企业采用汽提法12和微电解系统预处理法处理废水13,14,均存在能耗高、去除率低的缺点。而液液萃取技术作为一种成熟的传统分离工艺,具有操作简便、能耗低等优点。
液液相平衡数据反映了萃取过程中环己酮在水相和有机相中的分配,有助于研究有机溶剂 +环己酮 + 水三元体系的相行为和热力学性质15,是溶剂萃取操作过程和装置设计的基础,对萃取过程具有重要意义16,17。然而,到目前为止从废水中回收环己酮的相平衡数据鲜有报道,Vozin等18,19研究了使用不同溶剂如芳烃、烷烃等萃取废水中的环己酮,但是并没有相关的液液相平衡数据;Pei及其团队20研究了环己酮在水相和环己烷相中的分配并给出了三元液液相平衡的实验数据。本文测定了常压,303.15、313.15和323.15 K下水 +环己酮 + MIBK三元体系的液液相平衡数据。据笔者所知,此三元体系的液液相平衡数据还未见报道。同时,本文使用分配系数和分离因子来评价分离效果,通过Hand方程和Bachman方程检验实验数据的热力学一致性和可靠性,并采用NRTL和UNIQUAC模型对实验数据进行了关联。
2 实验过程与方法
2.1 仪器及试剂
实验过程中所使用的试剂及其相关参数列于表 1中,所有试剂没有经过进一步处理并对其纯度进行色谱分析。
2.2 实验过程及分析方法
本实验测量了大气压下,303.15、313.15和323.15 K温度下水 + 环己酮 + MIBK三元液液相平衡数据。在之前的文章21中已经对测量方法进行了描述并对其可靠性进行了评估。实验在如图 1所示的自制带恒温夹套的相平衡釜中进行,恒温夹套与超级恒温水浴(宁波海曙亿恒仪器有限公司,SC-15,精度±0.1 K)相接。实验过程中, 将釜液的总质量控制在55 g左右,用电子分析天平(梅特勒-托利多仪器(上海)有限公司,AL204,精度 0.0001 g)准确称取上述各组分并加入平衡釜中,密封后在设定温度条件下用磁力搅拌器将釜液搅拌2 h,静置4 h,直至彻底分层呈相平衡之后,分别用色谱针抽取有机相和水相溶液,异丙醇作为内标物,采用气相色谱(TCD)定量分析各物质的质量分数。根据标准测量不确定度方法(GUM)10,每一相至少分析三次,以确保各物质含量计算结果的方差低于0.1%,将其平均值作为实验的测量值。通过改变混合物的组成和温度,得到一系列的液液相平衡数据。
色谱条件:TCD (Agilent GC6820)的色谱柱为Porapak N (3 mm × 3 m);载气为氢气,气速60 mL·min-1;气化室和检测器温度均为 523.15 K,初始温度393.15 K (保持1.5 min),以20 K·min-1程序升温到523.15 K (保持1 min)。
2.3 不确定度
有两种计算不确定度的方法,‘A’和‘B’22。
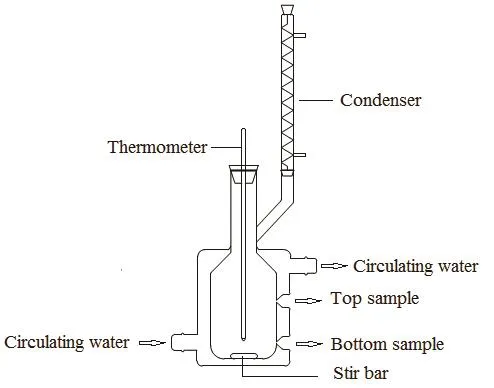
图1 相平衡釜示意图Fig.1 Equilibrium vessel.

表1 实验药品Table 1 Material description.
本文中确定参数用A方法评估,计算公式如下:
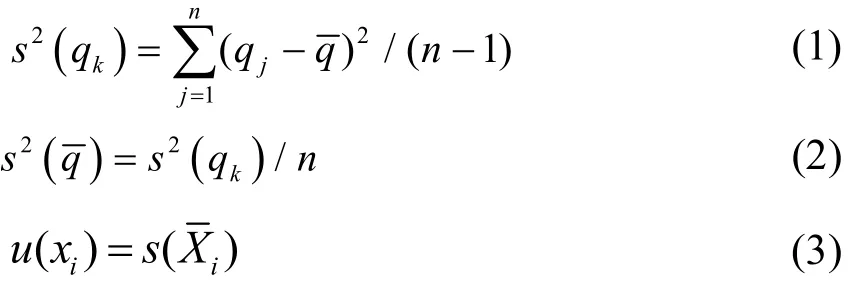
公式(1)计算的标准偏差(s(qk))表示测量值 qk与其平均值q的偏离程度。因此对于一个输入的测量值Xi(由n次重复测量的Xi,k确定),估计xi=Xi,采用方法A所求的不确定度为u(xi) = s(Xi)。
2.4 选择性
分配系数Di(水(i = 1)、环己酮(i = 2))和分离因子S用来评价MIBK的分离效率,计算D和S的公式:


xiα、xiβ为i组分分别在水相和有机相中的摩尔分数。
2.5 相平衡数据的一致性检验
对实验数据进行一致性检验是评价数据可靠性的一种重要方法。运用Hand、Bachman方程23-25对其进行关联,其表达式分别如下:
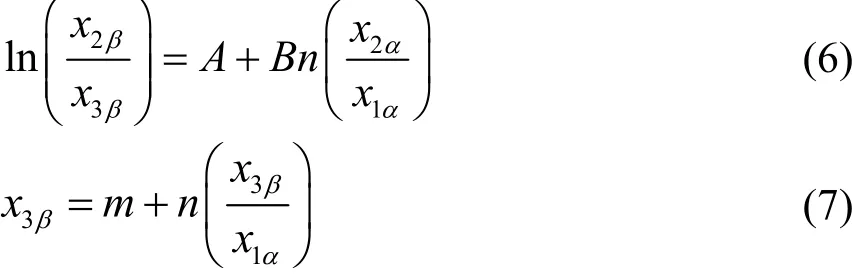
A、B、m、n分别为Hand和Bchman方程中的参数,x2α和 x1α分别为环己酮和水在水相中的摩尔分数, 3xβ和 2xβ分别为环己酮和水在有机相中的摩尔分数。R2表示相关数据的可靠性和一致性。
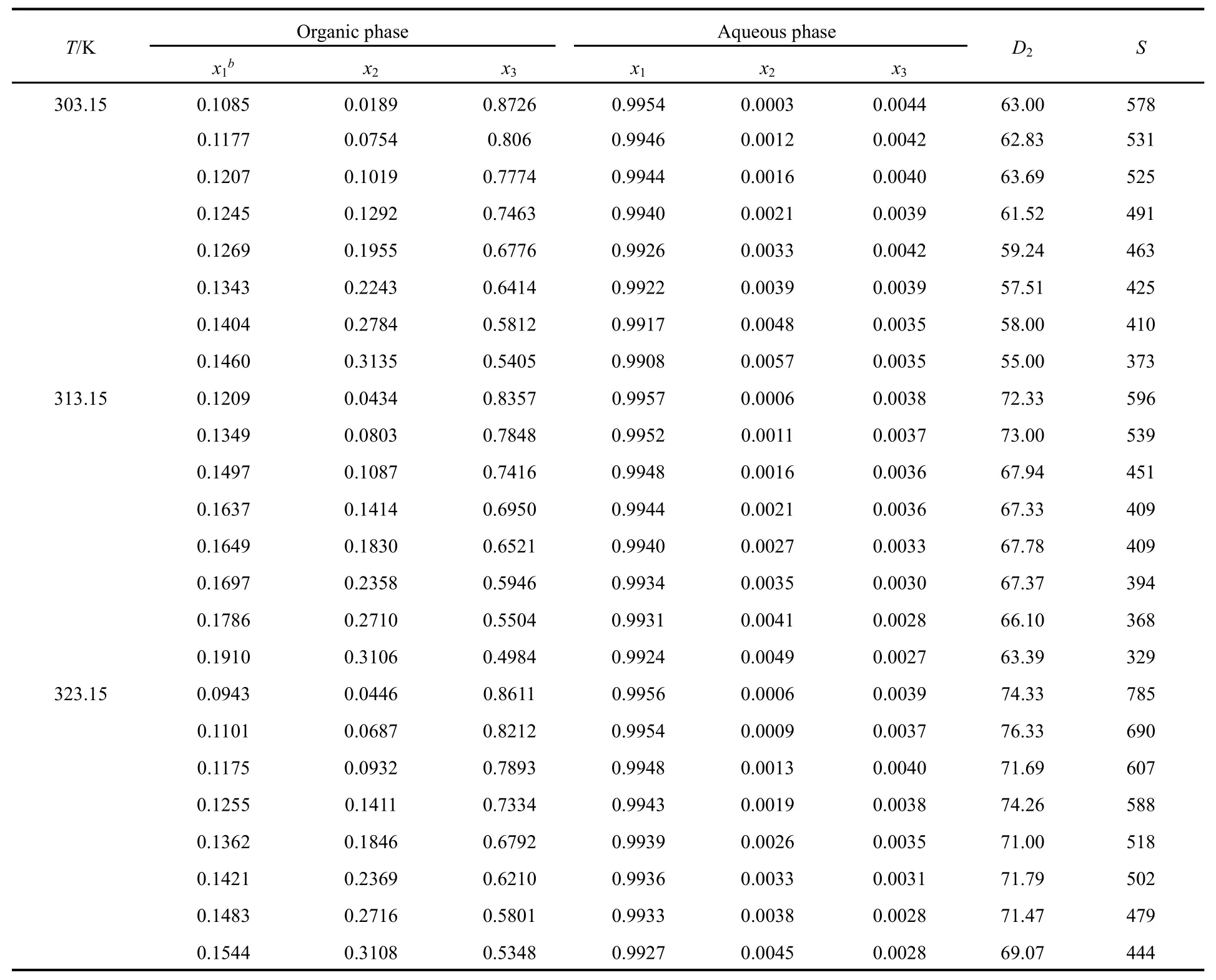
表2 常压下不同温度条件下水 + 环己酮MIBK的液液相平衡数据(摩尔分数)Table 2 Experimental LLE data (mole fraction) for water + cyclohexanone + MIBK system at different temperatures under atmosphere pressure a.
2.6 热力学模型
根据热力学原理,如果液体混合物在一定温度下形成两相并达到平衡,两相中的各组分有如下关系:


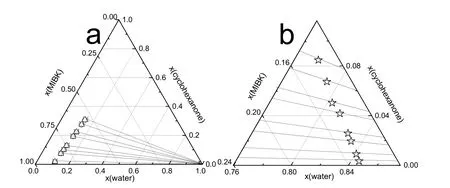
图2 水 + 环己酮 + MIBK在303.15 K下的三元相图Fig.2 Ternary phase diagram for water + cyclohexanone + MIBK system at 303.15 K.
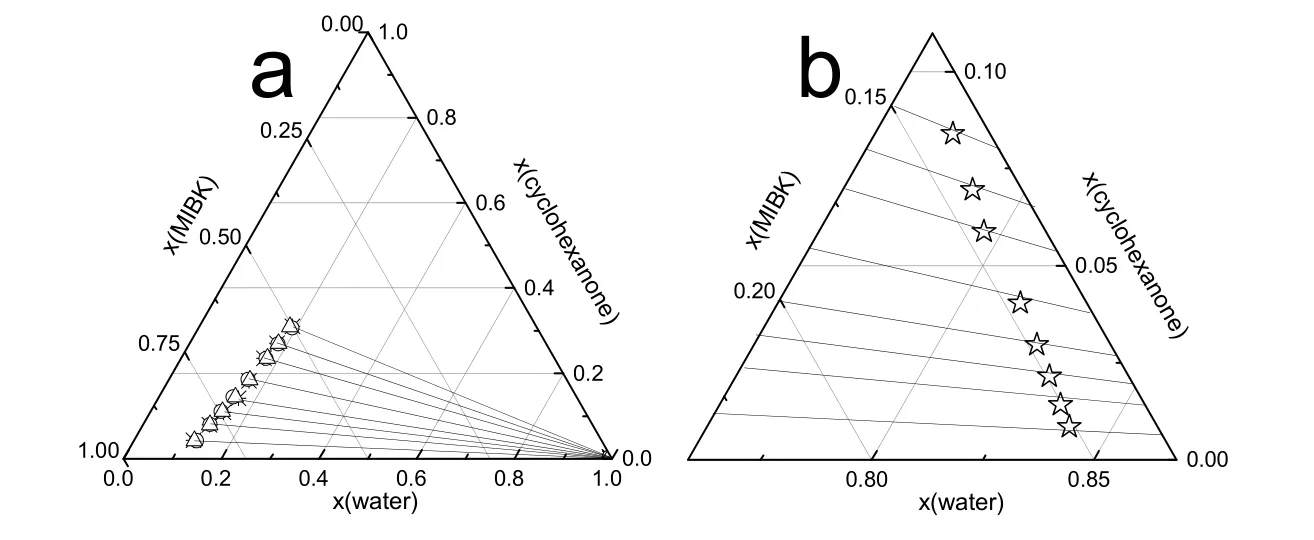
图3 水 + 环己酮 + MIBK在313.15 K下的三元相图Fig.3 Ternary phase diagram for water + cyclohexanone + MIBK system at 313.15 K.
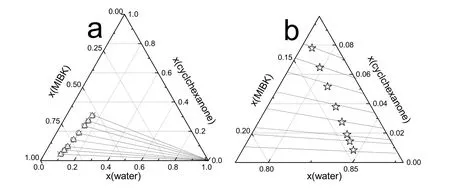
图4 水 + 环己酮 + MIBK在323.15 K下的三元相图Fig.4 Ternary phase diagram for water + cyclohexanone + MIBK system at 323.15 K.
本文借助Aspen Plus 8.4软件,选择NRTL和UNIQUAC模型对实验数据进行回归。
NRTL模型的关联方程为:
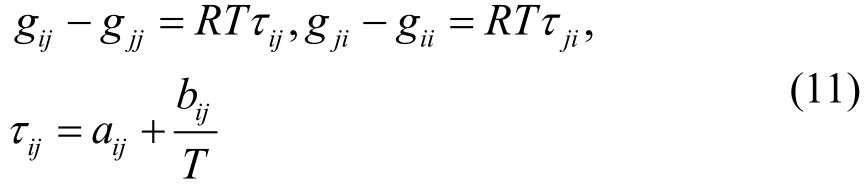
其中, aij和 bij是通过NRTL模型模拟出的二元交互作用参数,gij-gjj和gji- gii代指NRTL方程计算的到的二元交互作用能量参数。
UNIQUAC模型的方程为:

其中, aij和 bij是通过UNIQUAC模型模拟出的二元交互作用参数,uij-ujj和uji- uii代指UNIQUAC方程计算得到的二元交互作用能量参数。
固定NRTL模型中环己酮和MIBK的非随机参数为 0.3,其余均取 0.2。UNIQUAC模型中的结构参数r(体积参数)和q(表面积参数)26,27已列在表1中。
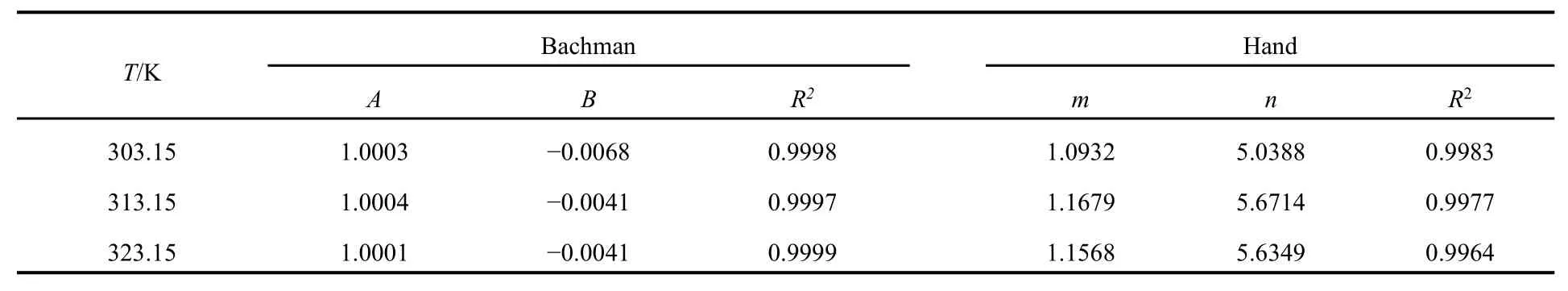
表3 不同温度下水 + 环己酮 + MIBK的Hand和Bachman关联拟合参数Table 3 Parameters of Hand and Bachman equations for water + cyclohexanone + MIBK system at different temperatures.
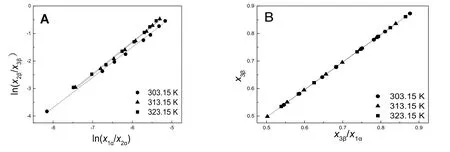
图5 水 + 环己酮 + MIBK三元体系Hand和Bachman方程结线关联Fig.5 Hand and Bachman correlations for the ternary systems water + cyclohexanone + MIBK.
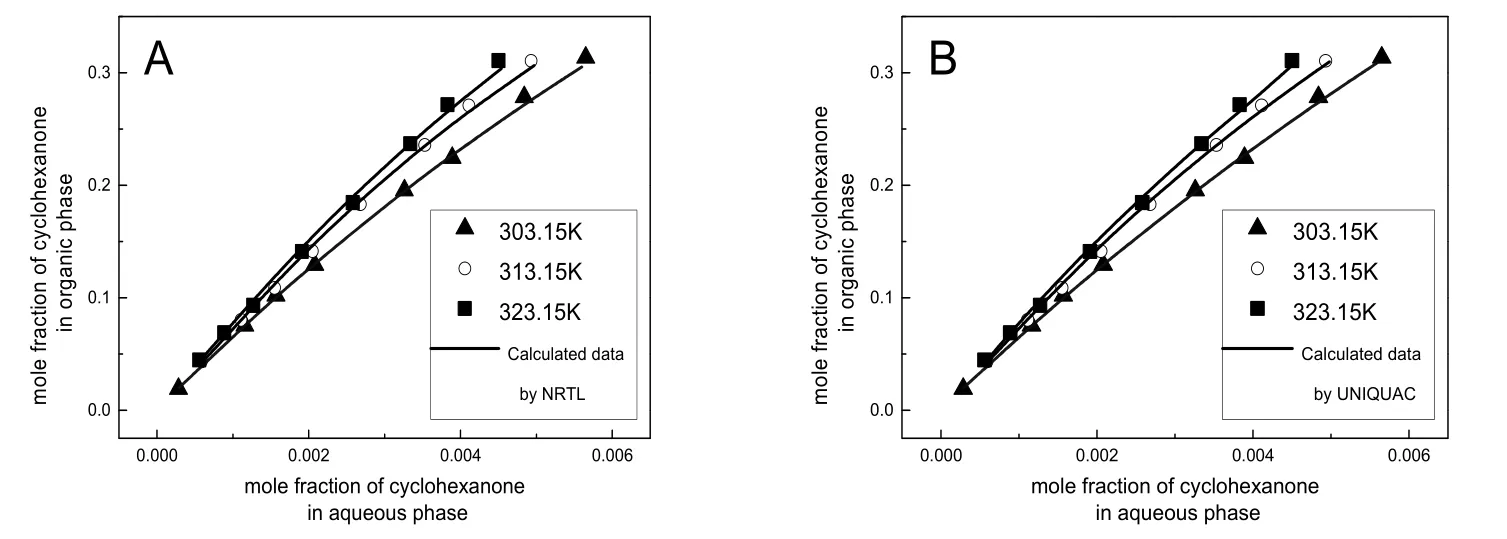
图6 环己酮在水相和有机相中的平衡分配线Fig.6 Equilibria distribution of cyclohexanone between aqueous phase and organic phase.
回归时采用最小二乘法,使式(13)中的目标函OF取最小值,关联出NRTL和UNIQUAC模型的最优参数。
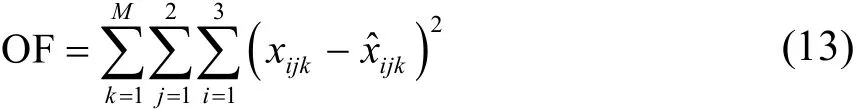
式中M为联结线数,x和ˆx分别为实验值和模拟值(摩尔分数),i、j、k分别代表不同组分数、相数和液液相平衡共轭组成的联结线数。
根据回归的二元交互参数,可对三元物系的液液相平衡数据进行预测。预测的计算值与实验数据的均方根误差(RMSD)对液液相平衡数据的关联效果进行评价。公式如下:
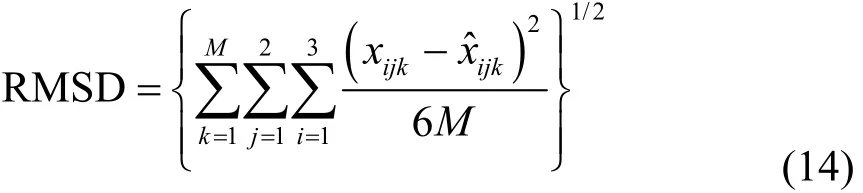
式中的参数M,x,ˆx,i,j,k和式(13)中的一样。
3 结果与讨论
3.1 实验结果
常压下,水 + 环己酮 + MIBK在303.15、313.15、323.15 K时的液液相平衡数据列在表 2中,所有浓度都用摩尔浓度表示。三元相图、联结线和进料组成如图 2-4所示。从图中看出,进料点位于联结线上,实验过程符合质量守恒定律,证明实验数据的可靠性28。如图2-4和表2所示,环己酮在萃取相中的摩尔浓度远大于其在水中的摩尔浓度并且在萃余相中MIBK的摩尔浓度低于0.5%,说明以MIBK为萃取剂从水溶液中提取环己酮过程中只有少量MIBK萃取剂损失在萃余相中,大部分萃取剂可以回收。由于环己酮分子结构中存在羰基,与水有一定的互溶性,随萃取相中环己酮含量增加水含量有所增加;萃取相中的水含量远小于萃余相中的水含量,大大减小水对后续精馏过程的不利影响。此外,从三元相图中可以看出有很大范围的两相区可以用来进行萃取操作。
Hand方程和Bachman方程的参数值以及相关指数 R2见表 3。图 5为三元体系 Hand方程和Bachman方程的拟合图像,拟合结果表现出明显的线性关系,R2均接近于 1,说明三组液液相平衡数据具有很高的一致性。
不同温度下的分配系数(D2)和分离因子(S)列在表2中。分离因子指现代分离技术分离物质时,某一单元操作或某一分离流程将两种物质分离的程度。当一个萃取体系对A、B两个组分萃取时,A物质的分配比与B物质的分配比的比值即为分离因子,其衡量了一个萃取体系对A、B两个组分的分离能力。分离因子大于1,说明萃取是可行。从表 2中的高分配系数和分离因子来看,MIBK萃取水中的环己酮选择性高,萃取效果好。同时,随着环己酮在进料中的摩尔浓度升高,分离因子和分配系数均有下降的趋势,这表明进料中环己酮的摩尔浓度越高,MIBK的萃取效果越差29,这是随着环己酮摩尔浓度升高,两相区的面积减少造成的。此外,表 2中的分配系数和分离因子随着温度升高而增大,并且在323.15 K时的分离因子明显大于低温时的分离因子,以上结论表明,对于所研究的平衡系统中,随着温度的升高,在形成新的相平衡以前,更多的环己酮从水相中转移到有机相中,高温时环己酮比水溶于萃取剂的程度更大,因此温度对萃取效果有一定的影响,并且在323.15 K进行萃取效果更好。
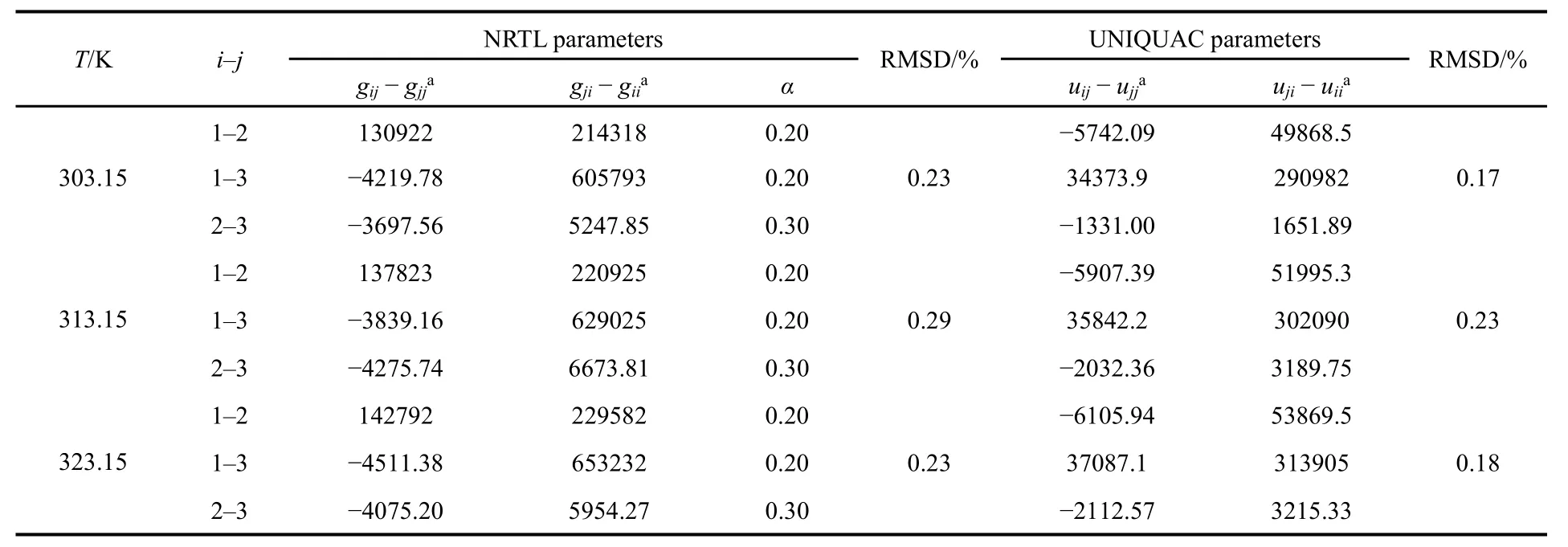
表4 水 + 环己酮 + MIBK三元体系NRTL和UNIQUAC模型的二元能量作用参数Table 4 Binary energy parameters of NRTL and UNIQUAC models for the water + cyclohexanone + MIBK system.
3.2 实验数据的关联
由NRTL和UNIQUAC 活度系数方程回归得到的二元交互能量作用参数和RMSD见表4。同时,在图2-4中绘制了NRTL方程和UNIQUAC方程拟合数据结果。图 6中,303.15、313.15和323.15 K三个温度下的实验数据,几乎都落在计算数据的连线上,由此可见,计算数据与实验数据的吻合程度高,并且,RMSD均小于 0.50%,表明,NRTL和 UNIQUAC模型均能很好的关联水 + 环己酮 + MIBK三元体系的液液相平衡实验数据,运用NRTL和UNIQUAC模型以及根据实验数据回归得到的二元交互参数,能够很好的预测水 + 环己酮 + MIBK三元系的液液相平衡数据,为以MIBK为萃取剂萃取回收水中的环己酮过程设计和流程模拟计算提供依据。通过比较拟合结果的RMSD,UNIQUAC模型比 NRTL模型更适合本三元体系的拟合回归。
4 结 论
常压下,测量了三元体系水+环己酮+MIBK在303.15、313.15、323.15 K条件下三组液液相平衡数据。根据相平衡数据分析,环己酮的分离因子远大于1,MIBK作为萃取剂从水溶液中萃取环己酮是可行的。并采用Hand和Bachman方程对实验数据进行可靠性检验,结果具有良好的热力学一致性。
借助 Aspen Plus软件,采用 NRTL和UNIQUAC模型对实验数据进行关联,回归得到各组分间的二元交互作用参数,其回归数据与实验测定值偏差较小,RMSD均小于0.5%。结果表明NRTL和UNIQUAC模型均能较好的描述水 +环己酮 + MIBK三元体系的液液相平衡。实验所测得液液相平衡数据和拟合得到的二元交互参数,为以MIBK为萃取剂萃取回收水中的环己酮过程设计和流程模拟计算提供依据。
(1) Zhang, J.; Li, D. Chem. Intermediate 2005, 12 (5), 1. [张杰, 李丹.化工中间体, 2005, 12 (5), 1.]
(2) Yang, X. Q. China Synthetic Fiber Ind. 1992, 15, 49. [杨序清. 合成纤维工业, 1992, 15, 49.]
(3) Wan, Y.; Lu, G. Z.; Wang, X. Y. Chem. Ind. Eng. Process 1999, 1, 29.[万颖, 卢冠忠, 王幸宜. 化工进展, 1999, 1, 29.]doi: 10.3321/j.issn:1000-6613.1999.01.011
(4) Xie, W. L.; Tian, A. G. Chem. Ind. Eng. Process 2003, 22, 420. [谢文莲, 田爱国. 化工进展, 2003, 22, 420.]doi: 10.3321/j.issn:1000-6613.2003.04.023
(5) Shen, W. China Synthetic Fiber Ind. 2010, 33 (4), 50. [申武. 合成纤维工业, 2010, 33 (4), 50.]doi: 10.3969/j.issn.1001-0041.2010.04.016
(6) Liu, X. Q. Chem. Chem. Ind. Eng. Process 2003, 22, 306. [刘小秦.化工进展, 2003, 22, 306.] doi:10.3321/j.issn:1000-6613.2003.03.021.
(7) Peter, S.; Karich, A.; Ullrich, R. J. Mol. Cat. B Enzym. 2014, 103, 47.doi: 10.1016/j.molcatb.2013.09.016.
(8) Zhou, L.; Xu, J.; Miao, H. Appl. Catal. A. Gen. 2005, 292, 223.doi: 10.1016/j.apcata.2005.06.018.
(9) Wu, S.; Qi, Y.; Gao, Y. J. Hazard. Mater 2011, 196, 139.doi: 10.1016/j.jhazmat.2011.09.003.
(10) Cui, L. P.; Zhang, Y. X.; Liu, H.; Chen, F. L.; Jiang, W. Q. Liaoning Chem. Ind. 2011, 40, 458. [崔丽萍, 张银新, 刘慧, 陈凡立, 蒋文强. 辽宁化工, 2011, 40, 458.]
(11) Qian, B. Z. Techno. Water Treatment 2010, No. 11, 55. [钱伯章. 水处理技术, 2010, No. 11, 55.]
(12) Zhou, W. R. Chem. Prod. Techno. 1999, 12 (1), 31. [周万荣.化工生产与技术, 1999, 12 (1), 31.]
(13) Tan, Q. W.; Yin G. Z.; Li, D. Techno. Water Treatment 2008,34 (6), 82. [谭钦文, 尹光志, 李斗. 水处理技术, 2008, 34(6), 82.]
(14) Li, D. W.; He, X. M.; Yuan, X. Techno. Water Treatment 2007,33 (10), 67. [李东伟, 何晓曼, 袁雪. 水处理技术, 2007, 33(10), 67.] doi: 10.3969/j.issn.1000-3770.2007.10.020
(15) Zeng, J.; Chen, Y.; Zhou, X. M.; Wen, C. Y. J. Chem.Thermodyn. 2013, 63, 116.doi: org/10.1016/j.canlet.2013.04.025
(16) Mazutti, M. A.; Voll, F. A. P.; Cardozo-Filho, L.; Corazza, M.L.; Lanza, M.; Priamo, W. L.; Oliveira, J. V. J. Chem.Thermodyn. 2013, 58, 83. doi: 10.1016/j.jct.2012.10.006.
(17) Li, H. D.; Han, Y. T.; Huang, C.; Yang, C. F. J. Chem.Thermodyn. 2015, 86, 20. doi: 10.18632/oncotarget.4397
(18) Vozin, V, G.; Diyarov, I. N.; Gainullin, I. F. J. Appl. Chem.USSR 1986, 58, 1525.
(19) Vozin, V. G.; Diyarov, I. N.; Gainullin, I. F. J. Appl. Chem.USSR 1986, 58, 7.
(20) Pei, Y.; Wang, Q.; Gong, X. Fluid Phase Equilib. 2015, 394,129. doi: org/10.1016/j.fluid.2015.02.029.
(21) Dai, F. F.; Xin, K. Song ,Y. H.; Shi, M. D.; Li, Q. S. Fluid Phase Equilib. 2016, 419, 50.doi: 10.1016/j.fluid.2016.03.003.
(22) Bipm, I. E. C.; Iso, I. Joint Committee for Guides in Metrology (JCGM) 100:2008. https://wenku.baidu.com/view/0c876c1d783e0912a3162a22.html
(23) Zhang, L.; Zhang, H.X.; Li, C. Journal of Zhengzhou University (Engineering Science) 2011, 32 (5), 46. [张雷, 张宏勋, 李晨. 郑州大学学报(工学版), 2011, 32 (5), 46.]doi: 10.3969/j.issn.1671-6833.2011.05.011.
(24) Liu, Y. Liquid-liquid Phase Behavior and Thermodynamic Modeling of Systems Containing lower Alcohols and Water.MS Dissertation, Qingdao University of Science and Technology, Qingdao, 2013. [刘迎. 低碳醇-水体系的液液相行为及热力学模拟[D]. 青岛: 青岛科技大学, 2013.]
(25) Feng, Y. R.; Gai, H. J.; Guo, K. J Chem. Ind. Eng. 2016, 68,848. [冯艺荣, 盖恒军, 郭凯, 化工学报, 2016, 68, 848.]doi: 10.11949/j.issn.0438-1157.20161068.
(26) Lei, F.; Wang, Q.; Gong, X. Fluid Phase Equilib. 2014, 382,65. doi: org/10.1016/j.fluid.2014.08.034.
(27) Yang, C. F.; Qian, Y,; Jiang, Y. B. Fluid Phase Equilib. 2007,258, 73. doi: org/10.1016/j.fluid.2007.05.026.
(28) Li, Y. X.; Xu, Q.; Liu, S. L.; Li, H. M.; Zhang, F. B.; Zhang,G. L.; Xia, Q. Fluid Phase Equilib. 2016, 412, 199.doi: 10.1124/dmd.110.034793.
(29) Al-Tuwaim, M. S.; Alkhaldi, H. A. H.; Fandary, M. S.;Al-Jimaz, A. S. Fluid Phase Equilib. 2012, 315, 21.doi: 10.1016/j.fluid.2011.11.008.
