噬菌体裂解酶作用机制及用于细菌感染治疗的研究进展
2018-01-29祝思路付玉荣伊正君
朱 丹,祝思路,付玉荣,伊正君
(潍坊医学院 1.医学检验学系; 2.临床医学院, 山东 潍坊 261053)
噬菌体是感染细菌、真菌、放线菌或螺旋体等微生物的病毒,侵入细菌细胞内并产生酶破坏细胞壁从而裂解细菌。噬菌体分为温和噬菌体和烈性噬菌体。前者是感染细菌后不增殖、不裂解细菌,而是将其核酸整合到细菌染色体上,并能与染色体一起复制传代。后者是在宿主细胞内复制增殖,产生许多子代噬菌体并控制编码裂解酶(endolysin)最终使细菌裂解,也称毒性噬菌体,因为其可以产生裂解酶裂解细菌,所以对临床有利用和研究价值。
1 裂解细菌的机制
噬菌体分为双链DNA噬菌体和单链RNA噬菌体,裂解酶大多是双链DNA噬菌体编码的,一般在病毒复制晚期合成的一类胞壁质水解酶。具有底物特异性和高效性。根据作用于细胞壁肽聚糖共价键位点的不同,可将噬菌体裂解酶分为葡糖苷酶、酰胺酶、内肽酶和转糖基酶。具有酰胺酶活性的裂解酶的裂菌谱(split bacterial spectrum)较宽[1]。裂解酶的高亲和性与种属特异性的细胞壁糖基有关,而后者是细菌存活的必要成分,所以细菌难以对裂解酶产生抗性,自然界中,几乎所有的细菌都有相应的噬菌体,所以裂解酶的开发研究具有重要的价值。
噬菌体裂解酶裂解细菌的方式有“自内裂解”(lysis from interior)和“自外裂解”(lysis from external)两种方式。当有噬菌体存在时,噬菌体侵入细菌并编码产生裂解酶,从细菌内部裂解细菌的方式即“自内裂解”。当没有噬菌体时,将某些噬菌体裂解酶放至对其敏感的细菌中,噬菌体裂解酶也可以在细菌外发挥有效的裂解作用,即“自外裂解”[2]。噬菌体“自内裂解”细菌通常是裂解酶与穴蛋白(holin)这2种物质导致细菌裂解的,裂解酶主要靶向作用于细胞壁,穴蛋白主要靶向作用于细胞膜。
1.1 靶向细胞壁
许多噬菌体裂解酶都具有“双结构域结构”的特点,即N-端结构域具有催化活性,可以特异的切断肽聚糖(peptidoglycan,PG)的化学键,也称催化域(catalytic domain)[3]。催化域中含有5种主要类型的酶活性:N-乙酰胞壁酶、内-b-N-乙酰氨基葡糖苷酶、转糖苷酶、N-乙酰胞壁酰-L-丙氨酸酰胺酶或者内肽酶。大部分的催化结构域是作用于胞壁上的聚糖骨架或多肽链之间的酰胺键,还有少部分比如分支杆菌噬菌体裂解酶作用于肽聚糖。C-端结构域是与宿主细胞壁上的特异性底物结合的区域,胞壁上含有多糖和磷壁酸受体[4]。少数噬菌体具有其他结构的裂解酶,这些噬菌体裂解酶含有多个不同的催化结构域和一个结合结构域。其中催化结构域维持着酶的宿主特异性,结合结构域对保持酶的完整性非常重要[5]。
1.2 靶向细胞膜
双链DNA基因组的噬菌体控制编码的裂解酶有利于溶解细胞壁的肽聚糖,但裂解酶不含信号序列不能通过细胞质膜,需要穴蛋白的协助[6]。穴蛋白是细胞的溶解效应器[7],由105个氨基酸组成,能够透细胞膜并起到信号肽的作用,在细胞膜上打孔破坏细胞膜的内外渗透压和正常调节机制,使细胞膜破裂内容物外漏崩解。小RNA噬菌体编码的单一蛋白质称为amurins[8],这个蛋白有导致细胞膜溶解并抑制细胞壁合成的作用,一般不需要穴蛋白协助。
所以溶菌效应是穴蛋白和裂解酶协同作用的结果。在裂解循环的末端,通过穴蛋白寡聚化(oligomerization)诱导细胞质膜的损伤,随之裂解酶分解肽聚糖,通过溶解细胞壁造成细胞的裂解来释放子代噬菌体[9]。

图1 自内裂解Fig 1 Lysis from interior
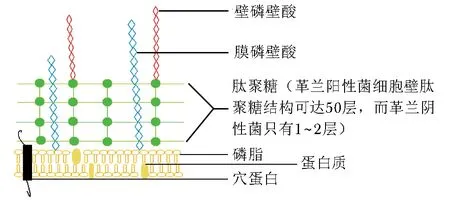
图2 自外裂解Fig 2 Lysis from external
2 裂解细菌的特性
2.1 裂解酶具有特异性
裂解酶只裂解其宿主菌,对其他菌株没有杀灭作用,鲍曼不动杆菌噬菌体裂解酶PlyAB1,只裂解鲍曼不动杆菌,对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌均没有裂解作用[10]。通过基因重组技术得到的针对产气荚膜梭菌的裂解酶,将其置于含产气荚膜梭菌和其他菌株的培养基中进行浊度减少试验,发现产气荚膜梭菌被裂解,但没有裂解任何产气荚膜梭菌以外的菌种[11]。作为1种抗菌药,裂解酶的特异性可以有效的避免菌群失调的发生。
2.2 裂解酶具有高效性
裂解酶与抗生素相比有较强的杀菌活性。裂解同等量的菌株,裂解酶的灭菌效率是抗生素的12~24倍,而且可以消除生物膜(biomembrane),具有低耐药性等优点[12]。使用微克或毫克的裂解酶就可以使靶细菌在几分钟内呈对数下降[13]。单独使用裂解酶裂解细菌,裂解酶的裂菌活性随着裂解酶浓度的增加而增强,最高的裂菌率可达99%[14]。
2.3 裂解酶有较高稳定性
噬菌体裂解酶有较强的稳定性,耐受的温度范围较宽,在短时间内不断改变裂解酶所处环境温度的情况下,裂解酶仍能保持完整的活性,裂解酶Ply5218在-80 ℃条件下,活性维持时间大于7个月,4 ℃下稳定时间超过30 d。50 ℃下维持活性时间超过30 min,70 ℃条件下孵育5 min后,其活性仍超过70%酶类[15]。同时,裂解酶适宜的pH范围也较宽,裂解酶P28分别在pH 4.0~pH 12.0条件下,30 ℃孵育1 h,裂解酶的裂菌活性不变[14]。
2.4 裂解酶具有潜在广泛的杀菌性能
目前关于多种裂解酶的研究都证明了裂解酶裂菌谱较窄,但是可以用物理(如高静压)和化学(如EDTA,弱有机酸,柠檬酸)方法处理裂解酶,增强其穿透细胞膜的能力,以拓宽其裂菌谱。也有研究发现一些新型的裂解酶具有广谱的杀菌能力,单独使用的情况下,不仅可以裂解革兰阳性菌也可以裂解革兰阴性菌,可用于治疗混合感染[14]。
2.5 裂解酶具有安全性
裂解酶若作为一种抗菌药物,其安全性也是不可或缺的,裂解酶的安全性检测主要通过动物实验体现的。在单剂量毒性实验中,实验动物未出现任何不良反应,重要器官及组织也未见严重的炎性反应及其他病变。在重复剂量毒性试验中,实验动物的体质量,食物消化、眼科、心电图、尿常规、血液学、血液生化和脏器重量,或宏观和微观检查均未见异常变化。只有一些动物在每天均注射裂解酶,持续1周以后,才出现了一些短暂轻微的临床症状[16]。
3 用于对革兰阳性菌临床感染的治疗
3.1 治疗葡萄球菌属的感染
葡萄球菌是临床常见的致病菌,主要是金黄色葡萄球菌引起的化脓性感染,近年耐药性也有所上升,尤其是耐甲氧西林金黄色葡萄球菌(methicillin resistantStaphylococcusaureus,MRSA)的出现,使得很多抗生素治疗无效,但是裂解酶对于治疗各种葡萄球菌的感染的效果却很可观,部分裂解酶本身具有较强的裂菌活性,单独使用就可裂解多种葡萄球菌,对于裂菌效果不满意的,可以将作用位点不同的裂解酶混合使用,或与抗生素联合使用,也可将裂解酶的CHAP结构域和溶葡萄球菌素的细胞壁结合结构域构成嵌合裂解酶,这些措施对实验中所有被测试的金黄色葡萄球菌菌株(包括MRSA分离株)都具有较高的抗菌活性,明显提高了实验中患葡萄球菌性菌血症小鼠的存活率[17]。
3.2 治疗链球菌属的感染
对于裂解酶治疗链球菌属的感染,主要是通过构建嵌合酶的方式,构建方式有3种,分别为将裂解酶基因组插入前噬菌体区域内表达出一个新型的噬菌体裂解酶,此种方式构建的嵌合酶可拓宽裂解酶裂菌能力[18]。也可以由2种链球菌裂解酶构建而来,此种嵌合酶的裂菌能力是裂解酶单体的2倍,而且还能有效抑制链球菌生物膜的形成。或者将裂解酶与肺炎链球菌自溶酶的细胞结合区域构建一个嵌合酶,此种方式构建的嵌合酶可以杀灭多株多重耐药肺炎链球菌及其相关菌株,并且具有极大地高效性[19]。
3.3 其他革兰阳性菌
产气荚膜梭菌是革兰阳性菌,在人类食源性疾病中具有重要的作用。病原菌的胞子(spore)在土壤、粪便或环境中可持续存在,并且会引起许多严重的动物和人类的感染,如食物中毒、气性坏疽和坏死性肠炎。将产气荚膜梭菌噬菌体裂解酶基因进行克隆,并在大肠杆菌中表达,得到的重组裂解酶进行裂菌实验,发现其能特异性裂解产气荚膜梭菌[11]。炭疽杆菌能够引起人畜共患传染病炭疽,炭疽芽胞很容易储存,运输和传播,并可能在土壤中存活了几十年。噬菌体裂解酶plyb、PlyG可作用于炭疽杆菌膜,使接种(腹腔)炭疽杆菌的100%小鼠存活,Plyb、PlyG表现出不同的催化活性和切割不同的肽聚糖位点,因此将两种裂解酶联合使用抗炭疽效果非常显著[20]。
4 用于对革兰阴性菌临床感染的治疗
4.1 鲍曼不动杆菌
鲍曼不动杆菌已成为最重要的医院感染病原菌之一,因为它抵抗几乎所有抗生素。可喜的是,现有重组裂解酶PlyAB1,30 min可杀灭206株多重耐药鲍曼不动杆菌(multidrug-resistantA.baumannii,MDRAB)及48株泛耐药鲍曼不动杆菌(pandrug-resistantA.baumannii,PDRAB)[10]。从基于13株鲍曼不动杆菌前噬菌体的基因组文库中筛选出编码溶菌活性基因,以这种方法获得可以裂解鲍曼不动杆菌的裂解酶PlyF307,在小鼠感染模型中,1.0 mg PlyF307可使50%腹腔注射了108CFU鲍曼不动杆菌的小鼠存活[21],有效的治疗了鲍曼不动杆菌的感染。
4.2 铜绿假单胞菌
铜绿假单胞菌引起的感染多发生在衰弱或免疫受损的住院患者,常引起术后感染、肺部感染和尿路感染等,是重要的医院内病原菌。目前已有多项研究发现裂解酶在EDTA或有机酸的存在下能够杀灭铜绿假单胞菌。也可以将抗菌肽和裂解酶共价结合构建重组裂解酶,由于抗菌肽有靶向肽聚糖的作用,因此能够介导裂解酶穿过革兰阴性菌的细胞膜,5 min可使铜绿假单胞菌下降3个数量级,其中还包括一些多重耐药的菌株[22]。
4.3 其他革兰阴性菌
很多裂解酶因其具有特异性,所以只能针对1种细菌,但最近有研究发现,将裂解酶与EDTA或有机酸等细胞通透剂联用可使裂解酶杀灭2种及2种以上的细菌。如,裂解酶ABgp46在不加细胞通透剂条件下有特异抗鲍曼不动杆菌的特性,但若与有机酸联合使用,则其对铜绿假单胞菌和鼠伤寒沙门菌都有较强的裂解活性[23]。裂解酶Lys68仅可杀灭铜绿假单胞菌,但是若与柠檬酸或苹果酸联合使用,则可以在2 h内使9~11种革兰阴性菌下降3~5个数量级,其中包括鼠伤寒沙门菌、鲍曼不动杆菌、宋内志贺菌、大肠杆菌、阪崎肠杆菌等[24]。
5 小结
目前由于抗生素的滥用导致各种抗药菌株出现,给临床治疗带来了极大的挑战,当前迫切需要寻找新的治疗方法,裂解酶的特异性、安全性和高效性使其在控制耐药方面具有巨大的发展潜力。虽然裂解酶仍存在某些不足但可以通过裂解酶的基因工程,设计、改造和修饰裂解酶,也可以通过与抗生素、柠檬酸和EDTA等联合作用。这些方法不仅提高了其裂解活性和靶向特异性,更重要的是拓宽了其裂菌谱,成为了能够解决耐药问题的有效方法。此外,裂解酶的活性受多种因素的影响,如酶浓度、金属离子和盐浓度等[24],对不同的酶,这些因素所产生的效果不尽相同,所以在裂解酶制剂方面,可以针对不同的酶添加不同的辅助因子以提高裂解酶制剂的治疗效果。目前裂解酶不易产生耐药性的机制尚不清楚,仍需进一步研究,如何利用裂解酶进行临床耐药菌感染的治疗仍是该领域重要的研究方向。
[1] Rucká L, Volkova O, Pavlík A,etal. Expression control of nitrile hydratase and amidase genes in Rhodococcus erythropolis and substrate specificities of the enzymes[J]. Antonie Van Leeuwenhoek, 2014, 105: 1179- 1190.
[2] Abedon ST. Lysis from without[J]. Bacteriophage, 2011, 1: 46- 49.
[3] Chapot-Chartier MP, Kulakauskas S. Cell wall structuer and function in lactic acid bacteria[J]. Microb Cell Fact, 2014, 13 Suppl 1: S9.doi:10.1186/1475- 2859- 13- S1- S9.
[4] Chapot-chartier MP. Interaction of the cell-wall glycopoly-mers of lactic acid bacteria with their bacterio-phages[J]. Front Microbiol, 2014, 5: 236. doi:10.3389/fmicb.2014.00236.
[5] Kong M, Ryu S. Bacteriophage PBC1 and its endolysin as an antimicrobial agent againstBacilluscereus[J]. Appl Environ Microbiol, 2015, 81: 2274- 2283.
[7] Lella M, Kamilla S, Jain V, Mahalakshmi R. Molecular mechanism of holin transmembrane domain I in pore formation and bacterial cell death[J]. ACS Chem Biol, 2016, 11:910- 920. doi:10.1021/acschembiol.5600875.
[8] Pimentel M. Genetics of phage lysis[J]. Microbiol Spec, 2014, 2, doi:10.1128/microbiolspec.MGM2- 0017- 2013.
[9] Saier MH, Reddy BL. Holins in bacteria, eukaryotes, and archaea: multifunctional xenologues with potential biotechnological and biomedical applications[J]. J Bacteriol, 2015, 197: 7- 17.
[10] Guang TH, Xiao DS, Ya LG,etal. Antibacterial properties of Acinetobacter baumannii phage Abp1 endolysin (PlyAB1)[J]. BMC Infect Dis, 2014, 14: 681.doi:10.1186/s12879- 014- 0681- 2.
[11] Seal BS. Characterization of bacteriophages virulent for clostridium perfringens and identification of phage lytic enzymes as alternatives to antibiotics for potential control of the bacterium[J]. Poult Sci, 2013, 92: 526- 533.
[12] Schuch R, Lee HM, Schneider BC,etal. Combination therapy with lysin CF- 301 and antibiotic superior to antibiotic alone for treating methicillin-resistantStaphylococcusaureus-induced murine bacteremia[J]. J Infect Dis, 2014, 209: 1469- 1478.
[13] Díez-Martínez R, De Paz HD, García-Fernández E,etal. A novel chimeric phage lysin with highinvitroandinvivobactericidal activity against Streptococcus pneumoniae[J]. J Antimicrob Chemother, 2015, 70: 1763- 1773.
[14] Dong H, Zhu C, Chen J,etal. Antibacterial activity of edolysin P28 against bothStenotrophomonasmaltophiliagram-positive and gram-negative bacteria[J]. Front Microbiol, 2015, 6: 1299.
[15] Zhang H, Zhang C, Wang H,etal. A novel prophage lysin ply5218 with extended lytic activity and stability againstStreptococcussuisinfectionn[J]. FEMS Microbiol Lett, 2016, 18: pii: fnw186.doi:10.1093/femsle/fnw186. Epub2016 Jul 31.
[16] Jun SY, Jung GM, Yoon SJ,etal. Preclinical safety evaluation of intravenously administered SAL200 contai-ning the recombinant phage endolysin SAL-1 as a pharmaceu-tical ingredient[J]. Antimicrob Agents Chemother, 2014, 58: 2084- 2088.
[17] Schuch R, Lee HM, Schneider BC,etal. Combination therapy with lysin CF- 301 and antibiotic is superior to antibiotic alone for treating methicillin-resistantStaphylococcusaureus-induced murine bacteremia[J]. J Infect Dis, 2014, 209: 1469- 1478.
[18] Riley BT, Broendum SS, Reboul CF,etal. Dynamic motion and communication in theStreptococcalC1 phage lysin, PlyC[J]. PLoS One, 2015, 10: e0140219. doi: 10.1371/journal.pone.0140219.
[19] Blázquez B, Fresco-Taboada A, Iglesias-Bexiga M,etal. PL3 amidase, a tailor-made lysin constructed by domain shuffling with potent killing activity againstPneumococciand related species[J]. Front Microbiol, 2016, 7: 1156.doi:10.33891/fmicb.2016.01156.
[20] Jończyk-Matysiak E, Kak M, Weber-Dąbrowska B,etal. Possible use of bacteriophages active againstBacillusanthracisand otherB.cereusgroup members in the face of a bioterrorism threat[J]. Biomed Res Int, 2014: 735413. doi: 10.1155/2014/735413.
[21] Lood R, Winer BY, Pelzek AJ,etal. Novel phage lysin capable of killing the multidrug-resistant gram-negative bacteriumAcinetobacterbaumanniiin a mouse bacteremia model [J]. AAC, 2015, 59: 1983- 1991.
[22] Briers Y, Walmagh M, Grymonprez B,etal. Art- 175 is a highly efficient antibacterial against multidrug-resistant strains and persisters ofPseudomonasaeruginosa[J]. Antimicrob Agents Chemother, 2014, 58: 3774- 3784.
[23] Oliveira H, Vilas BD, Mesnage S,etal. Structural and enzymatic characterization of ABgp46, a anovel phage endolysin with broad anti-gram-negative bacterial activity[J]. Front Microbiol, 2016, 7:208, doi: 10.3389/fmicb.2016.00208.
[24] Gutiérrez D, Ruas-Madiedo P, Martínez B,etal. Effec-tive removal of staphylococcal biofilms by the endolysin LysH5[J]. PLoS One, 2014, 9: e107307. doi: 10.1371/journal.pone.0107307.
