人端粒酶反转录酶过表达抑制低氧/复氧大鼠心肌细胞的凋亡
2018-01-29王平善
王平善,刘 阳
(桂林医学院附属医院 心外科, 广西 桂林 541000)
端粒酶(telomerase,TE)是由端粒酶RNA和蛋白质所构成的核糖核蛋白复合物,它能以自身RNA 为模板不断合成端粒DNA 并添加到染色体末端,从而阻止端粒的不断缩短,进而稳定染色体的长度和结构,避免细胞因端粒丢失导致的死亡。在端粒酶的组成中,人端粒酶反转录酶(telomerase reverse transcriptase,TERT)是TE的催化亚基,是决定其活性的关键基因, 过表达TERT基因可以发挥端粒对DNA的保护和修复功能[1- 2]。近年有报道,TERT 基因在生物体中不仅是对端粒的保护作用,而且还具有许多非端粒酶依赖性效应,如抗应激、调控线粒体功能、能量代谢、细胞Ca2+分布和促进细胞存活及抗细胞凋亡等[3- 6]。本研究通过构建携带端粒酶反转录酶基因的重组腺病毒载体,探讨端粒酶与细胞增殖和凋亡的关系。
1 材料与方法
1.1 实验材料
1.1.1 材料:Annexin V-APC/7-AAD细胞凋亡检测试剂盒(上海前尘生物科技有限公司);RNA提取试剂Trizol(TaKaRa公司);RT-PCR试剂(DBI公司);自转录试剂盒(DBI公司);BCA蛋白浓度测定试剂盒(PierceTM BCA Protein Assay Kit),Rat TE ELISA Kit(E-EL-R0947c),DEPC(Sigma公司);RNasin(Promega公司)。
1.1.2 细胞及病毒载体:出生3d的幼鼠心肌细胞(rat cardiac myocytes,RCM)(北京裕恒丰科技有限公司);TERT siRNA(m)慢病毒载体Lenti-KDTMmiRNA-EGFP和TERT过表达慢病毒载体Lenti-OETMcDNA-EGFP(上海吉凯基因化学有限公司设计构建)。
1.2 方法
1.2.1 实验分组及处理:参考文献中建立的心肌细胞低氧/复氧(hypoxia/reoxigenation,Hypo/Ro)模型方法[7],将心肌细胞培养在含体积分数为10%小牛血清的改良伊戈尔培养基(Dulbecco’s modified Eagle medium,DMEM),并置于饱和湿度、95%空气和5% CO2、37 ℃恒温密闭式培养箱中培养,每2天更换1次培养液。实验时取对数增殖期细胞,并分为对照组和Hypo/Ro组2组, Hypo/Ro组培养液采用不含血清和不含糖的DMEM培养基培养,并置于37 ℃密闭的低氧培养箱中(95% N2和5% CO2),10 h后置换新鲜培养基,置于含95%空气和5% CO2的密闭培养箱中继续培养,2 h后收集细胞。对照组置于37 ℃常氧培养,12 h后收集细胞。
1.2.2 Real-time PCR检测TERT、CytC和P21的miRNA表达:Real-time PCR扩增的反应体系为:Bestar® SybrGreen qPCRmasterMix 10 μL;PCR正向引物(10 μmol/L) 0.5 μL;PCR反向引物(10 μmol/L)0.5 μL;cDNA 2 μL;ddH2O 7 μL;Total 20 μL。PCR反应条件:95 ℃ 2 min,94 ℃ 20 s,58 ℃ 20 s,40个循环。熔解曲线分析:温度65 ℃~95 ℃。每个样重复3次。实验按照2-△△Ct方法计算基因相对表达量值。引物设计: TERT:正义链:5′-CCTTGCCA TGTTCCTGTTCTG-3′;反义链:5′-GTTGCCTGATTCC AATGCTCT-3′; CytC:正义链:5′-CAGGATTTTCTTA CACGGATGC-3′;反义链:5′-TGCCTGGGATGTATT TCTTCG-3′;P21:正义链:5′-GAACAGTAGACACG AAACAGGC-3′;反义链:5′-TATAGAAGGCATCGT CAACACC-3′;GAPDH:正义链:5′-CCTCGTCTCA TAGACAAGATGGT-3′;反义链:5′-GGGTAGAGT CATACTGGAACATG-3′;实验按照2-△△Ct方法处理数据。
1.2.3 病毒载体的转染:用构建好的病毒载体对接种24 h的心肌细胞进行转染,并设置普通对照组(未转染),过表达空白组(转染不携带TERT基因病毒载体),TERT过表达组(转染携带TERT基因病毒载体),沉默表达空白组(转染不携带TERT siRNA病毒载体),TERT沉默表达组(转染携带TERT siRNA病毒载体),共5组。每个细胞转染15~20个病毒。使用10% FBS的低糖DMEM培养基培养,培养3~5 h后按上述方法进行Hypo/Ro处理。提取蛋白并行缺口末端标记法染色(Tunnel染色)。
1.2.4 Western blot检测转染后TERT、CytC和P21蛋白浓度:常规方法提取RCM总蛋白,行SDS-PAGE电泳及转膜。一抗为稀释后的TERT(稀释比 1∶400)、CytC(稀释比 1∶1 000)、P21(稀释比1∶1 000)抗体及GAPDH抗体,二抗为HRP羊抗兔抗IgG(稀释比1∶5 000)。BCA试剂显影后用Image-Pro Plus 6.0凝胶图象处理系统分析条带吸光度值,用GAPDH条带吸光度值进行校正,得出各条带的相对吸光度值。
1.2.5 流式细胞计量术检测Hypo/Ro诱导的心肌细胞凋亡:取对数增殖期的RCM悬液6孔板中(5×104/孔),在37 ℃ 5% CO2孵箱中培养,48 h后用胰蛋白酶将细胞从6孔板中消化,2 000 r/min离心5 min,用4 ℃预冷的l×磷酸盐缓冲液洗涤细胞两次,100 μL 1×结合缓冲液重悬细胞,再加入10 μL Annexin V-APC混匀后,避光反应,冰上孵育10 min后,每管加入380 μL 1×结合缓冲液后再加入10 μL 7-AAD染色液,1 h内进行流式细胞仪检测。
1.2.6 ELISA测定转染后心肌细胞TE水平:参照伊莱瑞特生物科技有限公司Rat TE ELISA Kit试剂盒说明书进行操作。测量TE在450 nm波长处吸光度值,并根据标准曲线图查出相应的浓度;再乘以稀释倍数,即为TE的实际浓度。
1.3 统计学分析

2 结果
2.1 TERT、P21及CytC表达的变化
Hypo/Ro组TERT及P21的表达明显低于对照组(P<0.05),Hypo/Ro组CytC的表达高于对照组(P<0.05)(表1)。

表1 低氧复氧损伤对心肌细胞相关基因表达量的影响
*P<0.05 compared with control group.
2.2 病毒转染效率
TERT和P21蛋白的表达在TERT过表达组最高,TERT沉默表达组TERT及P21的表达明显低于其余各组(P<0.05)。CytC的表达在TERT沉默表达组最高,在TERT过表达组最低(P<0.05)(表2,图1)。
2.3 TERT表达的变化对缺血再灌注心肌细胞的影响
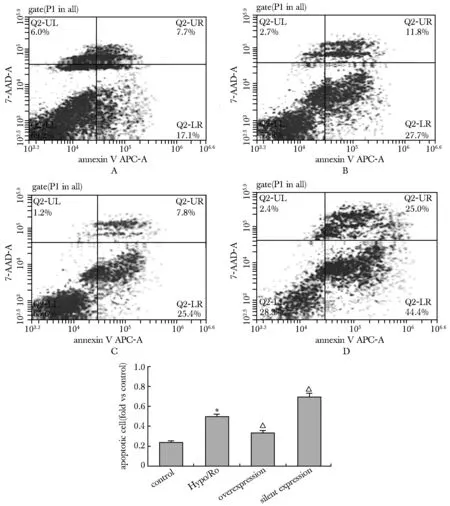
2.3.1 TERT表达的变化对心肌细胞Hypo/Ro诱导的细胞凋亡的影响。正常活细胞 Annexin V-APC及7-ADD均低染,分布在流式细胞分析图的左下区;早期凋亡细胞Annexin V-APC高染7-ADD低染,分布在图的右下区,晚期凋亡或死亡细胞Annexin V-APC及7-ADD均高染, 分布在图的右上区。

表2 转染后各组心肌细胞相关蛋白的表达
*P<0.05 compared with control group;△P<0.05 compared with overexpression control group;#P<0.05 compared with silent control group.
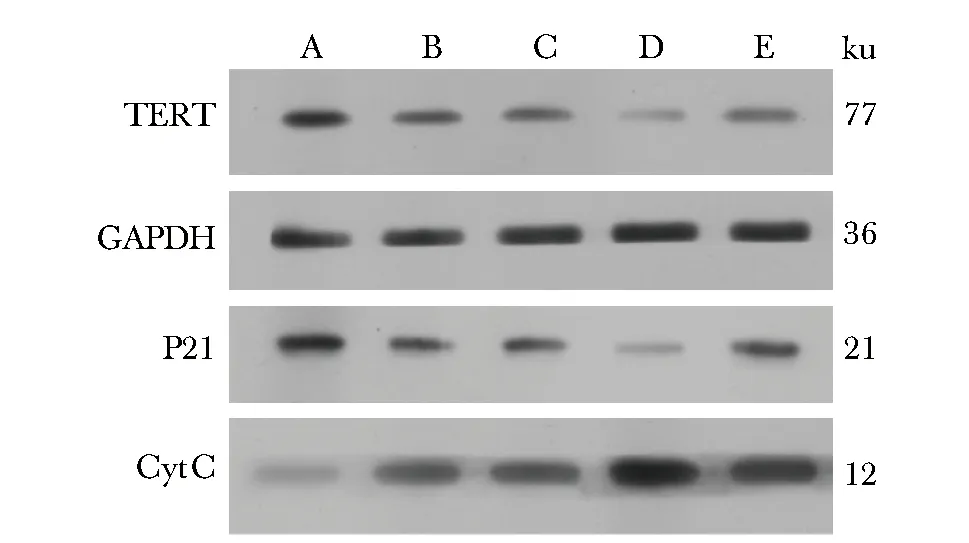
A.TERT overexpression group; B.overexpression control group; C.silent expression control group; D.TERT silent expression group; E.control group图1 转染后心肌细胞TERT、CytC和P21蛋白的表达Fig 1 Expression of TERT, CytC and P21 proteins in cardiomyocytes after transfection
早期凋亡细胞百分数和晚期凋亡细胞百分数之和称为总凋亡率。Hypo/Ro组与对照组相比心肌细胞早期凋亡率增加,总凋亡率亦增加(P<0.05)。对比转染后心肌细胞,TERT过表达组心肌细胞的凋亡率明显低于TERT沉默表达组,同时TERT过表达组心肌细胞的凋亡率较I/R组明显降低,TERT沉默表达组的凋亡率明显高于Hypo/Ro组(P<0.05)(图2)。
2.3.2 TERT表达的变化对端粒酶活性的影响。TE蛋白浓度在TERT过表达组最高,在TERT沉默表达组最低(P<0.05)(图3)。
A.control group; B.Hypo/Ro group; C.TERT overexpression group; D.TERT silent expression group;*P<0.05 compared with control group;△P<0.05 compared with Hypo/Ro group

3 讨论
心肌缺血再灌注损伤(ischemia reperfusion injury, IRI)是心脏外科手术后最常见的并发症之一,其与氧自由基产生、钙超载、炎性反应因子和炎性反应细胞聚集等因素有关,其实质是诱导心肌细胞的凋亡。端粒是真核细胞染色体末端的特有结构, 随着细胞的分裂不断缩短。端粒有一段特殊DNA序列能使染色体不被降解,而端粒酶能稳定端粒的长度和结构,从而保护染色体,抑制细胞凋亡[8- 9]。可见,通过控制端粒的功能干预缺血再灌注损伤的过程具有较高的可行性。
TERT是端粒酶活性的主要决定因素,同时具有抑制细胞凋亡的作用。转染外源性TERT可以促进细胞TERT的表达,抑制细胞凋亡。此外TERT还具有DNA修复功能[10- 11],能通过调节DNA修复蛋白的表达,促进DNA修复、稳定染色体结构而抑制细胞凋亡。此外,TERT还有可能通过调节细胞增增殖[12]来抑制细胞凋亡。

*P<0.05 compared with control group; △P<0.05 compared with overexpression control group; #P<0.05 compared with silent control group图3 转染后心肌细胞TE蛋白的表达Fig 3 Expression of TE protein in cardiomyocytes
本研究中,外源性TERT的转染促进了体外培养的心肌细胞TERT的表达,增加端粒酶的活性,保护心肌细胞。同时,过表达的TERT可促进细胞内P21的表达并抑制CytC的表达。 P21基因为细胞周期的负性调控因子, 过表达所产生的大量P21蛋白可使细胞周期停于G1期、G2期或S期,抑制DNA 复制,使受损的细胞得到充分修复,减少凋亡的发生[13]。CytC是线粒体起源的细胞凋亡因子,在Hypo/Ro损伤中同样发挥重要作用,不仅可直接介导细胞凋亡,而且还能通过干扰电子的传输、阻断能量的合成、促进氧自由基的产生等方式间接参与细胞凋亡[14]。本研究中P21及CytC基因表达的变化,提示它们也参与了TERT对心肌细胞的保护作用,其具体作用机制尚待进一步研究。
[1] Wang W, Liu CZ, Jin B. Alleviating the ischemia-reperfusion injury of donor liver by transfection of exogenous hTERT genes[J]. Transplant P, 2009, 41:1499- 1503.
[2] Liu GY, Li ZJ, Li QL,etal. Enhanced growth suppression of TERT-positive tumor cells by oncolytic adenovirus armed with CCL20 and CD40L[J]. Int Immunopharmacol, 2015, 28:487- 493.
[3] Sampathi S, Chai WH. Telomere replication: poised but puzzling[J]. J Cell Mol Med, 2011, 15:3- 13.
[4] Wu X, Chen J, Cao Y,etal. Antitumor effect of COOH-terminal polypeptide of human TERT is associated with the declined expression of hTERT and NF-κB p65 in HeLa cells[J]. Oncol Rep, 2015, 34:2909- 2916.
[5] Okamoto K, Bartocci C, Ouzounov I,etal. A two-step mechanism for TRF2-mediated chromosome-end protection[J]. Nature,2013,494:502- 505.
[6] Pfeiffer V, Crittin J, Grolimund L,etal. The THO complex component Thp2 counteracts telomeric R-loops and telomere shortening[J]. EMBO J, 2013, 32: 2861- 2871.
[7] Ekhterae D, Lin Z, Lundberg MS,etal. ARC inhibits cytachrome c release from mitochondria and protects against hypoxia-induced apoptosis in heart-derived H9c2 cells[J]. Circ Res, 1999,85:70- 77.
[8] Kawano Y, Kobune M, Yamaguchi M,etal. Ex vivo expansion of human umbilical cord hematopoietic progenitor cells using a coculture system with human telomerase catalytic subunit(hTERT)-transfected human stromal cells[J]. Blood, 2003,101: 532- 540.
[9] Jang KJ, Kwon GS, Jeong JW,etal. Cordyceptin induces apoptosis through repressing hTERT expression and inducing extranuclear export of hTERT[J]. J Biosci Bioeng, 2015,119:351- 357.
[10] Sharma MA, Gupta A, Wang H,etal. hTERT associates with human telomeres and enhances genomic stability and DNA repair[J]. Oncogene, 2003, 22: 131- 146.
[11] Smith LL, Coller HA, Roberts JM. Telomerase modulates expression of growth controlling genes and enhances cell proliferation[J]. Nat Cell Biol, 2003,5:474- 479.
[12] Geserick C, Tejera A, Gonzalez-Suarez E,etal. Expression of mTert In primary murine cells links the growth factor-beta signaling[J]. Oncogene,2006,25: 4310- 4319.
[13] Ansar K, Yasin A, Bahman Y. Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage[J]. DNA Repair,2016,42:63- 71.
[14] 潘晓青,魏瑾,林琳,等. 低硒大鼠心肌线粒体Cytc含量的动态变化及其在心肌细胞凋亡中的作用[J]. 西安交通大学学报:医学版, 2013,2:177- 180.
