基于超像素方法的腹部CT影像多目标器官分割研究
2018-01-29张海涛刘景鑫王春月赵晓晴李慧盈
张海涛,刘景鑫,王春月,赵晓晴,李慧盈
1.吉林大学 计算机科学与技术学院,吉林 长春 130012;2.吉林大学中日联谊医院,吉林 长春 130033
引言
人体腹部CT图像是临床医学中医生用于研究腹部各器官结构、诊断病变的重要工具之一,利用计算机的高处理性能对腹部CT图像进行分割处理以获取信息,能够更加高效准确地帮助医生实现对病人病变区域的疾病诊断、疾病跟踪、诊断方案、质量评定、疾病监测等。
目前,在医学影像分割中由于目标形状、目标边缘以及同质性等所导致的分割效果不明显问题还未得到有效的解决[1]。大部分传统图像分割方法并不能在腹部CT图像的处理上取得较为完善的结果,如利用区域生长法的分割[2-5],虽然能确保分段的连续性和降低噪声的敏感度但是难以确定较好的种子点和收敛规则;基于聚类的分割方法[6-8],实现容易、鲁棒性高,但是其主要应用在MR图像上,对腹部CT图像并不适用;而基于可行变方法[9]的图像分割即使拥有较高的分割精度,但是由于需要调整合适的参数从而导致在实际应用中的速度较慢;目前应用最为广泛的就是基于分类器的方法,该分割方法能有效的应用于MR和CT图像中,但计算复杂,处理速度较慢,因此难以满足医疗行业的预期需要。对此,近年来快速发展出了一种新的图像处理技术—超像素[10],它将图像快速分割为一定数量的具有语言意义的子区域,相比于传统处理方法中的基本单元——像素,超像素更有利于局部特征的提取与结构信息的表达,并且能够大幅度降低后续处理的计算复杂度,在计算机视觉领域尤其是图像分割中得到了广泛的应用。
因此,本文引入超像素的方法,对腹部CT图像进行分割。不同于传统分割方法只根据边界区域、灰度等进行分割,本文中基于超像素的分割方法在指导聚类过程的过程中结合了目标形状和灰度大小,将聚类结果定义为可视化块,成功将腹部各器官分割出来。通过实验发现本文中的方法相比于常用算法,提高了准确度、缩短了运行时间并具有较好的适用范围。
1 基于超像素的腹部CT影像多目标器官分割方法
由于受到医疗成像设备和人体组织器官蠕动的影响,腹部CT图像[11-12]在含有重要医学信息的同时也伴随有部分不必要的噪声和伪影,给腹部各目标器官的分割带来了困难。基于超像素的腹部CT影像多目标器官分割方法旨在解决上述问题,将图像的处理粒度从孤立的像素升级为具有相互联系的像素块的形式,从而定义了分割的限制形式。通过像素分组的形式使得待分割图像更易理解,各个目标器官的边缘更加清晰,更有利于医生诊断病情。本文方法主要从分割预处理、提取各器官特征以及对不同器官标签分类3个方面进行展开,下面详细介绍各个部分。
1.1 分割预处理
人体腹部医疗影像中包含有大量的组织和器官:肝、胃、脾、椎骨、主动脉等,见图1。CT图像中各个器官的灰度值差异较小,器官间边界区域不明显。因此,对于一副输入的腹部CT影像,分割预处理首先将图像划分为n个初始矩形子区域,设图像的宽是W,高是H,则超像素的边长这也就形成了n个初始的超像素,并将其作为n个聚类初始点,见图2。

图1 人体腹部CT结构图
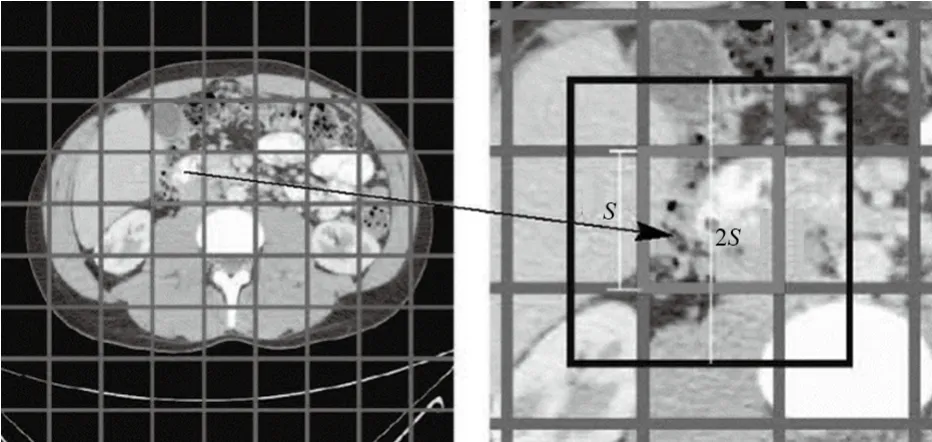
图2 n个划分超像素块
通过计算每个像素的梯度向量,可以尽可能的减小边缘不清晰和噪声较多等对聚类结果所产生的干扰。排序选出最小的点,并将其设定为初始的超像素聚类中心点[13],规定每个聚类起点对应的聚类区域为其所在的2S×2S邻域内。聚类时,由于聚类区域相比于全局只限定于在这个2S×2S的区域内,从而有效地提高了计算速率。
1.2 提取器官特征
利用超像素相邻相近的度量方法,从而提取出腹部CT中的纹理和亮度特征。如公式(1)所示,像素位置的邻近度dxy用欧氏距离表示。灰度相似值dgray用两个像素灰度的正差值表示,其中像素的灰度值为grayi,目标函数定义为见式(2)。利用度量准则描述超像素间的特征距离D,结合位置邻近度dxy和灰度相似度dxy,将其目标函数定义为式(3)所示。
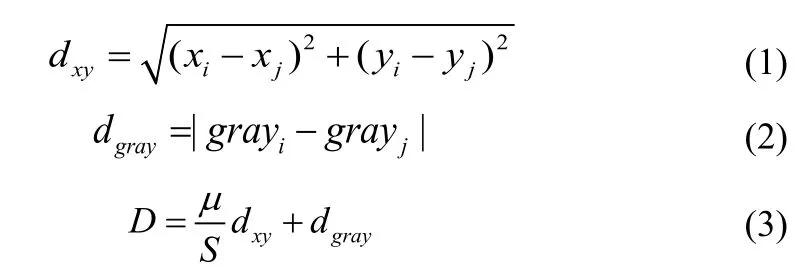
在使用模糊C-均值聚类算法[14]进行聚类时,对于所选的实验图为512×512而言,为了避免所选初始聚类中心数太少导致起不到超像素的效果,而太多又会影响速度,故而将初始聚类起点设定有81个,而为了能较快的得到聚类结果且保证最终算法的收敛,将迭代循环次数设置为不超过10次。将超像素的特征距离D定为聚类准则,更新超像素边界,从而得到了新的腹部切片聚类超像素情况(图3)。

图3 腹部切片聚类生成的超像素
截止到目前,本文的特征提取步骤已经将单个像素经过聚类形成了包含一定数量像素的超像素集合。为了提高划分的准确性,再将超像素的相对空间位置和纹理属性加入到相似性度量的标准D′,目标函数定义式如式(4)所示。

其中G为超像素的灰度平均值,E为超像素纹理的能量,I为超像素纹理的惯量,N为超像素纹理的熵,C为超像素纹理的相关性。
通常我们用灰度共生矩阵[15](Gray-Level Co-Occurrence Matrix,GLCM)来定义超像素之间的相似度关系,并用纹理属性[16]来对其标识。GLCM函数基本原理是计算像素对的频率,若假定空间为“出现在右面或者下面”,那么图4中的左侧图像对应的灰度共生矩阵则为右侧所示。
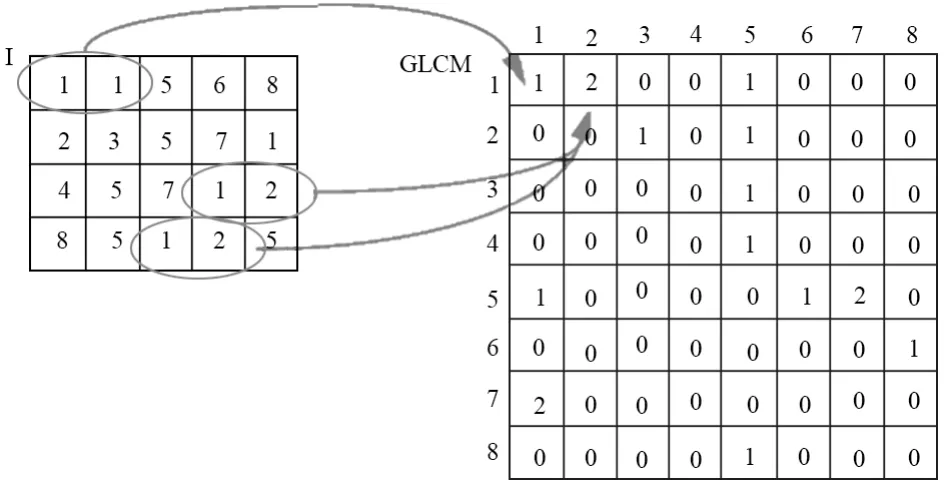
图4 图像的灰度共生矩阵
在创建灰度共生矩阵后,可以从中导出多个统计信息,这些统计信息提供了有关图像纹理的衡量标准。可以导出的统计信息,见表1。

表1 共生矩阵中所导出的信息
1.3 对不同器官标签分类
此外考虑到各脏器内部由于存在血管、淋巴等组织,故而为了提高分割效果,对器官采取了标签分类以及对比器官的超像素块间的相对空间关系来处理。首先采用人工方式,手动对脊椎、脾脏、胆囊、肝脏、肾脏等组织结构的超像素数据集合进行标记,生成带有标签的训练集,然后将每个超像素块做分类处理,获得超像素块的标签。每类脏器都有其所对应的超像素标签,具有相同标签的超像素属于同一个器官或组织,每个器官或组织由若干个带有标签的超像素构成。标记规则,见图5,其中背景标记为0。
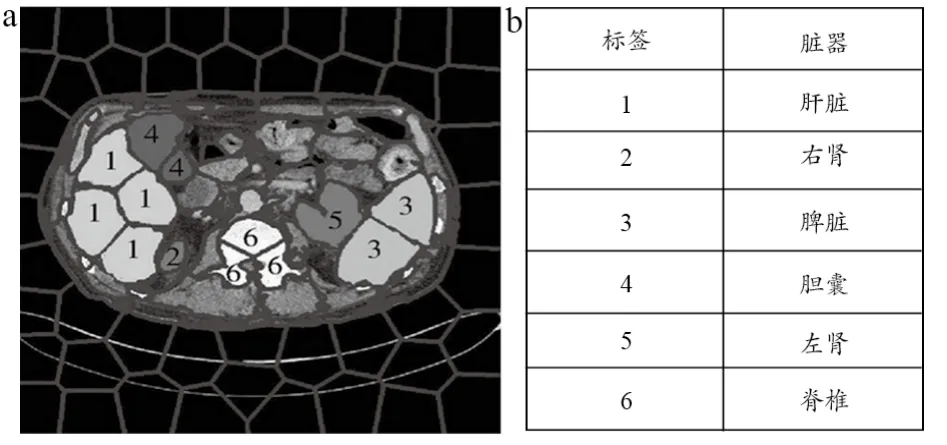
图5 各器官标记规则
由于腹部各器官之间存在着相互依赖的关系,因此可用超像素块之间的相对空间关系来表示真实脏器之间的实际位置关系。式(5)描述了超像素之间的邻近性。其中:d表示超像素之间的距离,‖·‖定义为L2范式,超像素中心像素点(x1,y1)、(x2,y2)的坐标分别为p1、p2。当超像素之间的距离和边长满足式(6)时,则将两超像素点定义为相邻;当超像素之间的距离和边长满足式(7)时,则将两超像素点定义为相近,其中S表示超像素分割时初始聚类矩形块的边长。
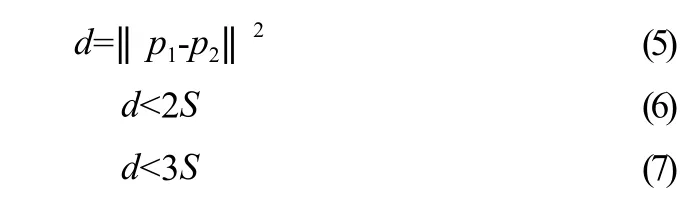
实际人体器官之间的位置不仅存在着相互依存的关系,同时也存在着相互制约的关系。通过建立有向邻接关系图来描述超像素群之间的相关性约束,在特征分类的同时通过器官之间的相互制约关系提高分类的准确率,最终减少分类分割的误差(图6)。

图6 超像素群的空间相对位置约束
2 实验结果
2.1 区域生长、高斯混合模型与本文方法对比
选用一组腹部CT医学图像进行单目标和多目标的分割来验证本文算法的有效性,图像参数为大小512×512的DICOM格式文件,切片间距为2.5 mm,图像来源于吉林大学白求恩第一医院。
通过医学图像预处理将图像转换为灰度级为0~255的BMP格式图像,然后采用本文提出的基于超像素的分割方法,结合图像灰度相似性和位置邻近性,经过自底向上的聚类和自顶向下的分类两个步骤来进行目标分割(图7)。实验结果表明本文方法对腹部CT中部分器官具有较高的分割完整率,不存在漏检、误检现象。

图7 单目标分割结果
选用区域生长和高斯混合模型[17]以分割右肾为例作为对照实验,验证算法的单目标分割能力,不同方法的右肾提取情况,见图8。综合表现对比,见表2,从表中可以看出本文选用的方法在单目标图像分割中具有较为显著的优势。

图8 单目标分割结果对比

表2 分割效率对比表
区域生长方法[1]需要人工手动选定初始种子生长点,终止条件的设定容易受到噪声的影响。高斯混合模型[17]采用多个单高斯分布的组合,以迭代的方式估计算法的参数,但是不能保证总是收敛,而且只能收敛到局部极值,不能达到全局最优。本文的腹部器官分割方法将初始聚类中心设为梯度最小点,可以有效的减小噪声对结果的影响。然后以超像素纹理和空间几何位置关系加入到超像素粒度的聚类准则,对分割结果进行进一步的修正,可以抑制分割不全或过度分割的现象。
2.2 分割结果评判指标
区域内一致性[18]常常作为判断图像分割结果的指标。优秀分割算法的标签表现为区域内的颜色、灰度、纹理等属性的一致性,而整个图像的一致性通常定义为其中各部分一致性的均值。区域一致性可以通过最大对比度来评价,对于一副腹部医学影像,假设分割后有n个区域,分别为R1、R2、R3…Rn。将Si定义为第i个区域的一致性,那么Si表示如式(8)所示。

其中grayi定义为图像的灰度值,Ni为第i个区域中的像素个数,W(i)为像素i的领域。
进一步将同质性作为表示区域一致性的指标,取值范围为[0,1],同质性评价结果,见图9。从图9可以看出,同质性数值都大于0.7的超像素所占比例在90%以上,表示此区域超像素的纹理比较均匀。部分超像素的同质性值相对较低,但本文则进一步利用了空间几何位置邻近度来修正聚类结果,有效保障分割结果的准确性。
除了区域一致性指标之外,还可以通过分割准确率来分析分割效果。其定义见式(9)所示,其中错误分割的像素总数和正确分割的像素总数分别用F和T来表示。本文基于超像素的方法分割腹部部分器官得到的准确率概况,见图10。


图9 同质性评价
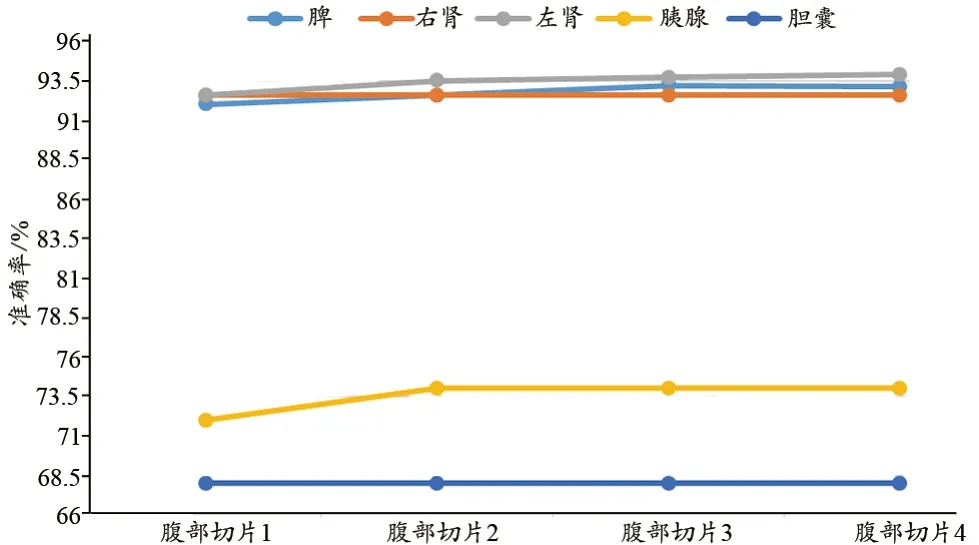
图10 不同器官分割准确度
腹部多目标医学影像分割结果,见图11。通过图11给出了3个说明性示例,进一步表明本文提出的算法是效果更好的方法。白色箭头指示常规先前的失效区域。以区域生长、最大后验最小体积重叠算法[19]、基于梯度参数和阈值的分割[20]作为参考实验。通过与其他分割方法对比,使用本文的方法比其他方法更好地分割了胰腺的头部(图11a)。胰腺、胆囊被常规方法遗漏,而本文方法更有效(图11b)。常规方法会将右肾划分到肝脏中,在这种情况下,分割的肝区域泄漏到右肾中。然而,即使当将泄漏的肝脏用于预测器官时,通过本文的方法依然成功地分割了这些器官。肝脏泄漏的区域由图中的白色箭头指示。通过本文分割方法,更好地将脾脏、左肾、胰腺、胆囊等区域分割出来(图11c)。在所示的3种情况下,本文的方法优于或等同于用于腹部目标器官的分割的常规方法。
3 结束语
医学图像的处理影响着医疗系统的进步和发展,有必要将先进的计算机技术与具体的临床医疗和学术研究相结合起来,高性能的图像分割技术能进一步帮助医生实现对病灶的准确判断。

图11 腹部多目标医学影像分割结果
本文将超像素理念应用到医学图像分割中,提出了一种基于超像素的腹部医学影像多目标分割方法。针对腹部CT影像,在传统分割方法的基础上,将超像素作为基本结构单元,结合了图像的空间关系、灰度特征,从两个方向对图像聚类再分类,在提高分割准确率的同时也提高了分割效率。我们的下一步工作则是针对存在病灶干扰导致极大HU值差异时的病变器官分割提取的研究。
未来的医学影像分割应当朝着一种更加智能化,高效化的方向发展,在充分利用计算机性能的同时也应更好的结合医学领域中的先验知识,发展出新的技术,更好的为医疗影像分割所服务。
[1] 李强.医学图像分割进展[J].中国医疗设备,2010,25(5):121-124.
[2] Kamdi S,Krishna RK.Image segmentation and region growing algorithm[J].Inter J Comput Tech Elec Engin,2012,1(2).
[3] 徐蔚波,刘颖,章浩伟.基于区域生长的图像分割研究进展[J].北京生物医学工程,2017,36(3):317-322.
[4] 彭微.基于区域生长算法的肝脏CT图像分割[J].医疗卫生装备,2014,35(9):49-50.
[5] 冯皓.图像区域生长算法的稳定性研究[D].福州:福建师范大学,2012.
[6] Bezdek JC,Hall LO,Clarke LP.Review of MR image segmentation techniques using pattern recognition[J].Med Phys,1993,20(4):1033.
[7] 何瀚志,朱红,王竞.基于聚类分析的医学图像分割综述[J].中国科技信息,2017,(15):43-46.
[8] 加小红.聚类算法及其在图像分割中的应用研究[D].兰州:兰州交通大学,2017.
[9] Metaxas DN.Physics-based deformable models: applications to computer vision, graphics, and medical imaging[J].Graph Med Imag,1997.
[10] 宋熙煜,周利莉,李中国,等.图像分割中的超像素方法研究综述[J].中国图象图形学报,2015,20(5):599-608.
[11] 韩文艳.CT能谱成像的基本原理与临床应用优势[J].中国医疗设备,2015,30(12):90-91.
[12] 梁启堂,钟向阳.心脏冠状动脉多排CT扫描的优化措施[J].中国医疗设备,2011,26(8):161-162.
[13] 郭书杰,吴小欣,黄杰.改进的聚类分析算法及其性能分析[J].计算机时代,2010,(8):4-6.
[14] Bezdek JC,Ehrlich R,Full W.FCM: The fuzzy c-means clustering algorithm[J].Comput Geosci,1984,10(2):191-203.
[15] 贺晓建,王福明.基于灰度共生矩阵的纹理分析方法研究[J].山西电子技术,2010,(4):89-90.
[16] 张云彬,张永生.基于图像纹理特征的目标快速检索[J].高技术通讯,2004,14(8):11-14.
[17] 张树伟.医学图像的高斯混合模型及聚类研究[D].镇江:江苏大学,2010.
[18] 胡兵.改进的Otsu算法在多尺度图像分割中的应用研究[D].长沙:中南大学,2012.
[19] Liu X,Linguraru MG,Yao J,et al.Abdominal multi-organ localization on contrast-enhanced CT based on maximum a posteriori probability and minimum volume overlap[A].IEEE International Symposium on Biomedical Imaging: From Nano To Macro[C].IEEE,2011:2083-2086.
[20] Selver MA,Kocaoğlu A,Akyar H,et al.Patient oriented neural networks to overcome challenges of abdominal organ segmentation in CT angiography studies[A].International Conference on Electrical and Electronics Engineering[C].New York:IEEE,2009:177-181.
