面向临床应用的光声成像技术
2018-01-29林日强冷吉陈敬钦刘成波龚小竞宋亮
林日强,冷吉,陈敬钦,刘成波,龚小竞,宋亮
中国科学院深圳先进技术研究院 生物医学光学与分子影像研究室,广东 深圳 518060
引言
光声成像主要基于光声效应,即当物体被脉冲激光照射后,会吸收光能并将部分能量转化为热能,进而引起样品的瞬时热膨胀和后续的高频振动,这种高频振荡的超声波即光声信号,用超声换能器探测该信号并通过计算机重建成像[1]。早在1880年,Bell实验室就发现了光声现象,但直到二十世纪60~70年代,光声效应才与现代激光技术、超声探测技术、微弱信号放大技术相结合而开始迅速发展。二十世纪90年代,光声效应被引入生物组织成像领域,后又经过10余年的努力,光声成像技术在系统构成、图像重建、功能成像等各个方面均获得了巨大的发展,并显现出其在临床医学和基础医学研究方面的巨大应用潜力。
生物组织的光声成像,通常是经过光吸收→激发光声信号→超声波检测→图像重建等过程,其原理见图1。在激发光照参数不变的情况下,光声信号的强度、频谱与生物体的光学特性(主要是光吸收特性)紧密相关。而不同的组织有不同的光吸收特性,因此光声成像可以对组织中特定成分进行高对比的结构成像。进一步,结合光声光谱技术,即在多个波长进行光声测量,可以定量地分析各种组织成分的变化,精细地反映极其微小的组织病变及血红蛋白浓度、血氧浓度、氧代谢率等一系列重要的生理参数,实现功能成像[1]。

图1 光声成像原理图
传统的生物医学光学成像,如光学相干层析、共聚焦、多光子等,可实现高分辨、高对比的成像。但由于组织对光的强烈散射作用,其成像深度往往局限在1~2 mm。光学扩散层析通过对光子运动轨迹的“追踪”,可实现厘米级深度成像。但同样由于组织对光的强烈散射作用,其追踪过程是针对大量光子的统计学计算,所以其分辨率仅为数毫米。医学超声成像可以获得较大的成像深度(数厘米)和较高的分辨率(数百微米),但由于成像原理是基于声阻抗不同的对比机制,使其对早期病变成像的对比度要远低于光学成像方式。光声成像克服了现有纯光学和纯超声成像的局限性,其对比度源于光学吸收差异,分辨率源于光声发射阶段的超声波探测。由于超声波在生物组织中的散射比光学散射低3个数量级,因此光声成像在扩射光子能够到达的区域,成像分辨率和最大成像深度均可以随着超声频率变化而变化[2]。综上,光声成像技术结合了超声成像的大深度、高分辨特点,同时又具备光学成像的高对比度,是一种非常有应用潜力的新兴成像技术。
由于具备在大穿透深度与高分辨成像之间灵活调节切换的能力,使得光声成像技术可以根据不同的应用目的,采用不同的成像方式,以获得与应用更为匹配的优质图像。本文中,我们将主要介绍3种常见的光声成像方式:光声显微成像技术、光声计算层析成像技术、光声内窥成像技术。光声显微成像技术和光声内窥技术主要目标是在毫米级的成像深度上实现微米级的分辨率。而光声计算层析技术的探测深度和分辨率可在较大范围内变化,既可以实现显微成像,也可以实现大深度的成像。
光声成像技术作为一种正在迅速发展的新型成像技术,凭借其灵活的成像方式、优质的成像能力、高度的生物安全性,正越来越多地受到生物医学成像领域研究人员的密切关注。近年来光声成像已被证明在众多生物医学领域有重要的应用价值,如肿瘤血管新生成像[3]、血红蛋白和血氧浓度成像[4]、心脑血管易损斑块成像[5]、乳腺癌诊断[6]等。本文中,我们结合本研究团队的主要研究工作,重点介绍与临床应用紧密联系的微血管成像、血管介入成像、消化道内窥成像、前哨淋巴结成像的光声技术的最新进展。
1 微血管成像
微血管的尺度在10 µm左右,需要采用光学分辨率光声显微成像系统(Optical-Resolution Photoacoustic Microscopy,OR-PAM)进行观察。OR-PAM是光声成像的一种主要形式,由于其横向分辨率达到光学聚焦量级(微米或者亚微米级),因此称为“光学”分辨率光声显微系统。该系统使用聚焦后的激光光束进行光声信号的激发,并将超声接收焦点与光激发焦点调节至共聚焦状态以实现最高的接收效率。
本研究团队搭建的OR-PAM系统结构图(图2)中[7],纳秒脉冲激发光由532 nm波长的钇铝石榴石晶体(Nd:YAG)固体激光器输出;经小孔整形与透镜聚焦后,再经光纤耦合器,耦合到单模光纤中;光纤出射光再经过两个相同的物镜进行准直和聚焦,最后照射到组织样本上为直径大约5 μm的光斑。产生的光声信号用水进行耦合后再经过组合棱镜的两次全反射后被其上方的高频超声换能器接收,该棱镜中间夹层灌注有硅酮油,用于透射激光反射超声,声透镜则附于棱镜的下方用于增强接收信号的灵敏度;接收到的光声信号放大后由高速数据采集卡进行采集,经计算机用MATLAB程序对采集的数据进行希尔伯特变换以及滤波处理后成像。三维位移平台用于移动成像探头进行机械扫描,获得三维数据[6-7]。

图2 OR-PAM系统结构图[7]
利用OR-PAM,我们成功实现了活体状态下对小鼠耳部血管网络的无创、无标记的光声成像(图3a)[7]。体成像分辨率达到5 μm,实现了对单个红细胞成像。通过自制夹具,我们还对小鼠背部乳腺癌肿瘤(4T1)进行了无标记的连续观察(图3b~3d)[8]。通过不同波长的激光进行激发,获得了血红蛋白在不同波长下的光声信号,结合氧合血红蛋白和脱氧血红蛋白的光谱差异,可从中提取出血氧饱和度信息。在今后研究中,需要提高该系统的光穿透深度以及光声信号探测效率,以获得更高深度的成像。利用该技术,可实现肿瘤周边微血管生成过程的无创精细观察,结合药物对小动物肿瘤模型的长期观察,有望为肿瘤病理学研究和临床诊断提供全新的工具。
2 血管介入成像
血管内光声成像(Intravascular Photoacoustic Imaging,IVPA)是一种新型检测血管内易损斑块的成像技术。它利用介入成像导管,深入到病变血管处进行成像。由于不同组织的吸收特性各不相同,因此IVPA可利用组织自身的光吸收对比和光声光谱方法,高敏锐的检测斑块的化学组分(如脂质核)。与传统的血管内超声成像(Intravascular Ultrasound,IVUS)和血管内光学相干层析成像只能够对血管内壁的结构和形态成像相比,血管内光声成像能够针对生物组织的成分差异或分子特异性进行功能成像。

图3 OR-PAM系统在体成像的部分代表成果[7]
本研究团队所设计的高速血管内光声超声双模成像系统,见图4a[9]。
激发源为重复频率为1 kHz的纳秒级脉冲光学参量振荡激光器(Optical Parameter Oscillator,OPO),激发光经过光阑光束整形和中性密度滤波片衰减后,再由透镜汇聚到多模光纤内,并经光纤导入由光纤、自聚焦透镜、棱镜与超声换能器构成的成像导管内(图4b)。光纤出射光经自聚焦透镜会聚、棱镜反射,照射在血管内壁,激发出的光声信号被超声换能器接收,获得血管壁的光声图像;同时超声换能器还进行超声的发射和接收,获得血管壁的超声图像。成像导管在旋转—平移扫描平台的带动下完成“螺旋式”扫描,所采集的数据通过高速数据采集卡传递到计算机,利用MATLAB软件对其进行希尔伯特变换和极坐标变换,最终实现三维的光声/超声双模成像。
利用上述搭建的IVPA系统(图4c)以及我们设计制作的外径为0.9 mm的光声/超声双模成像导管进行了成像实验,获取了由黄油制作的脂质仿体在波长为1185 nm、1195 nm、1210 nm、1225 nm和1235 nm下的光声图像,获得了光声光谱信息(图5d)[9]。由图5d可以看出,将测得的光声光谱与脂质的吸收谱比对,二者非常接近,并且利用二者进行互相关计算,可对脂质成分进行鉴别,进而获得脂质成份的分布图(图5e)。该技术可用于对易损斑块中的脂质核成分进行检测,为斑块易损性的诊断提供功能信息,有望成为临床新一代的成像工具,为医生提供更详尽的诊断信息。在今后的系统的改进中,应该提高光学耦合效率,以提高脂质信号的探测灵敏度。
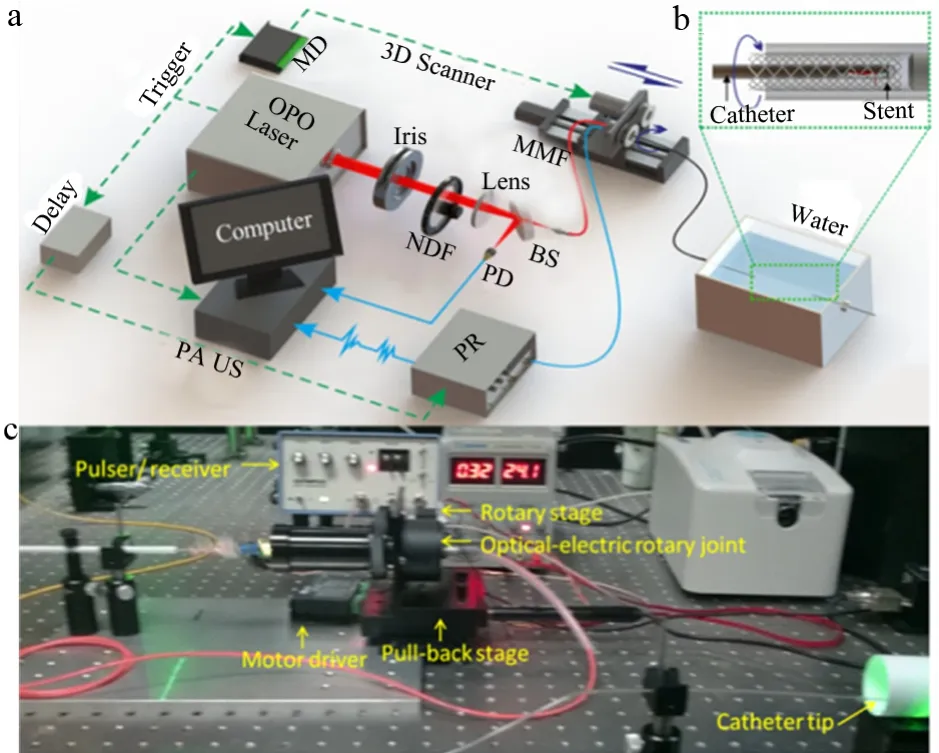
图4 高速血管内成像系统图[9]
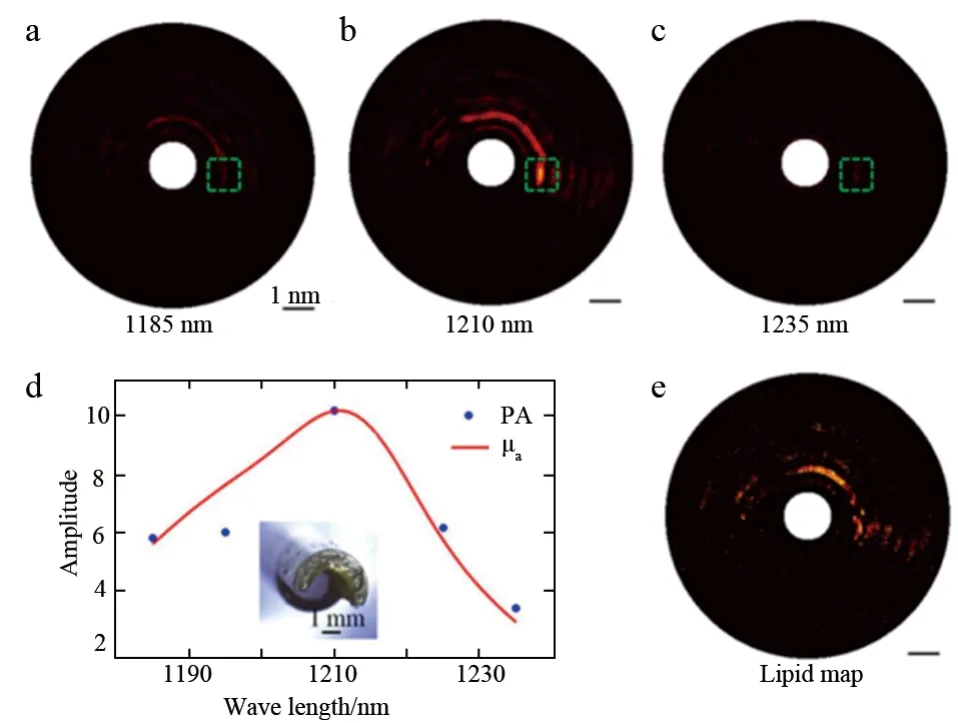
图5 利用IPVA获取的光声光谱图像[9]
此外,利用该系统,我们对离体的兔子血管内植入的心脏支架(图6a)进行了成像[9],成像速度可以到达每秒5帧。我们利用连续采集的多个超声和光声B-Scan图像进行了三维重建(图6b~c),可以看出IVPA相对IVUS具有更高的对比度,更有利于对支架的放置情况进行评估。因此亦可以利用该成像系统引导心脏支架介入手术以及监测心脏支架的植入情况。
3 消化道内窥成像
现阶段,对消化道疾病的常规诊断仍然依赖于医用内窥镜。医用内窥镜不仅能及时发现病灶位置,为医生提供病灶区域的图像,还能引导手术,对发病位置进行监控、采样、给药、切除等操作。但是目前临床内窥镜仍然具有一定局限性。白光和荧光类的内窥成像技术受限于传统光学成像技术的穿透深度,大多只能对消化道的表皮成像,无法观察到表皮以下的组织情况,难以判断肿瘤浸润深度,在一定程度上局限了其疾病诊断能力。超声成像的不足在于其图像对比度有限,针对某一种特定成分进行成像的特异性较差[10]。

图6 健康兔子血管植入心脏支架图像[9]
基于此,本研究团队在血管内光声成像技术的基础上发展了消化道光声/超声双模内窥镜,并针对特定成像对象和成像范围,对成像探头进行了全新设计。最终,我们实现了可兼容临床内窥镜活检通道的成像探头(外径为2.5 mm)。利用该探头,我们在国内首次实现了小动物的活体内窥光声/超声双模同位成像(图7)[11]。该技术既能对消化道浅表病灶的血管形态、血氧饱和度等进行功能成像,又能探测肿瘤浸润深度,在不同模态成像下获取多参量多尺度的信息。在接下来的研究中,我们将尝试将本系统与现有消化内镜技术融合,并逐步提高系统分辨率[12]与成像速度[13],初步建立基于光声内窥镜的消化道早癌多模态诊断体系和标准。利用该技术有望更早更快发现消化道肿瘤,为消化道的临床诊断提供方法上的革新。

图7 大鼠直肠在体光声/超声双模成像[11]
4 前哨淋巴结成像
传统的乳腺癌前哨淋巴结检测中,通常采用追踪放射性标记物并注射染料的方式定位前哨淋巴结,再将定位后的前哨淋巴结取出,进行病理检测。此种方法可引起严重的并发症,并且假阴性率高。而基于超声的针刺型活检虽然是微创手术,一般不会造成并发症,但是由于超声技术的低对比度,难以精准定位前哨淋巴结的位置。光声成像因其具有高对比度优势,能够大幅提升针刺型活检的有效性,在降低风险的同时,提高了前哨淋巴结检测的准确度[14-15]。
针对这一应用,本研究团队开发了基于手持式超声阵列探头的光声实时成像系统,主要包含:128通道数据采集装置,OPO纳秒脉冲激光器,光纤(或光纤束),手持式光声/超声探头,以及光路等附加部件系统,系统见图8[16]。

图8 手持式乳腺癌前哨淋巴结成像系统[16]
仿体实验结果表明,系统分辨率可达250 μm,成像速率为每秒20帧,能够实时成像。利用该系统,我们通过向大鼠前爪注射吲哚菁绿(Indocyanine Green,ICG)小分子光声成像对比剂,成功实现了大鼠前哨淋巴结的定位成像(图9)。该技术展示了光声成像技术在微创、高效检测前哨淋巴结中的重要应用潜力。在未来研究中,我们将继续致力于改进算法与系统结构,以提高系统的成像速度以及成像灵敏度[17-18],以期望其在乳腺癌早期诊断中发挥重要作用。

图9 手持式光声成像系统用于大鼠前哨淋巴结成像结果
5 总结
综上所述,光声成像技术既可以高分辨、高对比的对组织进行特异性结构成像,也可对目标组织中的特定成分进行鉴别,还可结合分子探针进行靶向目标成像。因此,光声成像技术作为一种兼具高对比度结构成像与高敏锐功能成像能力的新型成像技术,正在临床肿瘤、心脑血管疾病早期诊断等方面展现出巨大应用潜力[19-21]。推动光声成像技术的进一步临床转化与产业化,具有重大经济价值和社会意义。
[1] Wang LV,Hu S.Photoacoustic tomography: in vivo imaging from organelles to organs[J].Science,2012,335(6075),1458-1462.
[2] 汪立宏,吴新一.生物医学光学:原理和成像[M].合肥:中国科学技术大学出版社,2017.1.
[3] Lao YQ,Xing D,Yang SH,et al.Noninvasive photoacoustic imaging of the developing vasculature during early tumor growth[J].Phys Med Biol,2008,53:4203-4212.
[4] Zhang HF,Maslov K,Sivaramakrishnan M,et al.Imaging of hemoglobin oxygen saturation variations in single vessels in vivo using photoacoustic microscopy[J].Appl Phys Lett,2007,90(5):1555.
[5] Wang B,Emelianov S.Thermal intravascular photoacoustic imaging[J].Biomed Opt Express,2011,2(11):3072-3078.
[6] Ermilov SA,Khamapirad T,Conjusteau A,et al.Laser optoacoustic imaging system for detection of breast cancer[J].J Biomed Opt,2009,14(2):024007.
[7] Chen J,Lin R,Wang H,et al.Blind-deconvolution opticalresolution photoacoustic microscopy in vivo[J].Opt Express,2013,21(6):7316.
[8] Lin R,Chen J,Wang H,et al.Longitudinal label-free opticalresolution photoacoustic microscopy of tumor angiogenesis in vivo[J].Quant Imag Med Surg,2015,5(1):23-29.
[9] Li Y,Gong X,Liu C,et al.High-speed intravascular spectroscopic photoacoustic imaging at 1000 A-lines per second with a 0.9 mm diameter catheter[J].J Biomed Opt,2015,20(6):065006.
[10] Yang JM,Favazza C,Chen R,et al.Simultaneous functional photoacoustic and ultrasonic endoscopy of internal organs in vivo[J].Nat Med,2012,18(8):1297-1302.
[11] Lin R,Li Y,Chen J,et al.Full field-of-view photoacoustic endoscopy in vivo[J].P SPIE, 2017,64.
[12] Yang JM,Li C,Chen R,et al.Optical-resolution photoacoustic endomicroscopy in vivo[J].Biomed Opt Express,2015,6(3):918-932.
[13] Wu M,Springeling G,Lovrak M,et al.Real-time volumetric lipid imaging in vivo by intravascular photoacoustics at 20 frames per second[J].Biomed Opt Express,2017,8(2):943.
[14] Manohar S,Vaartjes SE,Hespen JCGV,et al.Initial results of in vivo non-invasive cancer imaging in the human breast using near-infrared photoacoustics[J].Opt Express,2007,15(19):12277.
[15] Kim C,Erpelding TN,Maslov K,et al.Handheld array-based photoacoustic probe for guiding needle biopsy of sentinel lymph nodes[J].J Biomed Opt,2015,15(4):046010.
[16] Li M,Liu C.A novel compact linear-array based photoacoustic handheld probe towards clinical translation for sentinel lymph node mapping[J].ICBIH,2015.
[17] Ermilov SA,Khamapirad T,Conjusteau A,et al.Laser optoacoustic imaging system for detection of breast cancer[J].J Biomed Opt,2009,14(2):024007.
[18] Wang Y,Erpelding TN,Jankovic L,et al.In vivo threedimensional photoacoustic imaging based on a clinical matrix array ultrasound probe[J].J Biomed Opt,2012,17(6):061208.
[19] Knieling F,Neufert C,Hartmann A,et al.Multispectral optoacoustic tomography for assessment of crohn’s disease activity[J].N Engl J Med,2017,376(13):1292.
[20] Stoffels I,Morscher S,Helfrich I,et al.Metastatic status of sentinel lymph nodes in melanoma determined noninvasively with multispectral optoacoustic imaging[J].Sci Transl Med,2015,7(317):ra199.
[21] Taruttis A,Timmermans A,Wouters P,et al.Optoacoustic imaging of human vasculature: feasibility by using a handheld probe[J].Radiology,2016,281(1):256-263.
