非接触式光声成像技术及其应用
2018-01-29陈重江周王婷胡毅成杨思华
陈重江,周王婷,胡毅成,杨思华
华南师范大学生物光子学研究院 激光生命科学研究所、暨激光生命科学教育部重点实验室,广东 广州 510631
引言
目前,在光声成像技术中,光声信号通常需要使用超声换能器进行接触式探测。由于超声波(光声信号)无法在空气中传播,在样品和超声换能器之间必须添加水或超声凝胶作为超声波的耦合介质,这使其在很多应用中受到限制。比如,在高温、强辐射等的工业应用中,往往因为待检测区域所处的环境恶劣,无法使用耦合剂进行耦合,或者超声换能器无法置于被检测区域;在烧伤检测和溃疡检测等的生物医学应用中,使用耦合剂会污染乃至感染待检测组织区域,而且在手术导航中耦合剂的使用会对目标区域的检测带来不便,这就限制了其在临床医学上的应用。光学超声检测是一种很有前途的超声波检测方法,以非接触的方式检测超声波信号,可以实现宽频带高灵敏度的光声成像,此方法避免了传统方法需要耦合剂而带来的不便。因此,与传统的光声成像相比,非接触式光声成像技术更利于扩展到工业及生物医学领域的应用。
过去几年,越来越多的光学超声检测方法被提出,光学检测超声信号的方法已经被广泛的应用于各种领域[1-21]。早在上个世纪90年代,Pouet等[22]在光折变晶体中混合双光束的方法形成外差干涉仪,并将其用来探测物体粗糙表面的超声信号。2004年,Carp等[23]利用改进的马赫曾德尔干涉仪测量光声效应引起的表面振动的位移,该系统具备4 ns的时间分辨率,0.3 nm位移灵敏度。亦有研究使用基于聚合物薄膜的法布里—珀罗干涉仪来检测超声波[24]。2010年,Berer等[2]利用双波长混频干涉仪实现了远距离和非接触式光声成像。最近,有研究提出将相位敏感型光学相干层析(Optical Coherence Tomography,OCT)系统用于光声信号的检测[25]。在以上提到的各种光学检测超声的方法中,有的由于检测灵敏度低并不能进行非接触式测量,有的由于光学信号调制频率受限导致系统检测带宽较窄,有的则是成像分辨率较低。为了实现非接触式宽带高分辨率的接收光声信号,我们在本文中提出了一种基于低相干迈克尔逊干涉仪的光学检测光声信号的方法,并建立非接触式光声成像系统,验证了该系统的成像能力及横向分辨率,并通过模拟实验和在体实验验证了该非接触式光声成像系统能够高分辨率的成像生物组织的脉管系统,促进了光声成像技术在生物医学中的应用。
1 原理与方法
1.1 光学相干法测量光声信号的原理
当吸收体被短脉冲激光照射时,吸收体会吸收光能产生热膨胀,从而辐射热弹波,也就是光声信号。光声信号本质上是机械波,它在传播的过程中会引起吸收体表面的振动。因此,我们可以通过测量吸收体表面振动位移的大小来反演光声信号的大小。迈克尔逊干涉仪是常用的精密测量设备,其精度可达到皮米量级甚至更高,在科研及工业领域中都有着广泛的应用。本文中,我们利用迈克尔逊干涉仪对相位变化的高度敏感性来检测光声信号引起吸收体表面振动的位移,从而实现光声信号的非接触式检测。
光学相干法测量光声信号的原理,见图1。光声信号检测光经分束器分为两束光,一束光通过透镜并聚焦在反射镜上形成参考臂,另一束光依次通过二向色镜和物镜最后聚焦在样品上形成样品臂,从样品臂和参考臂各自反射回去的光相遇后发生干涉,光电平衡探测器用来接收干涉信号,这就构成了迈克尔逊干涉仪。光声信号检测光与光声信号激发光经过二向色镜后变为同轴光束,一同经过物镜聚焦于生物组织上,生物组织吸收激发光能量后产生光声信号,光声信号传到组织表面时会引起表面的振动,振动幅度的大小就反映了光声信号的大小。根据光声信号在介质中的传播性质,组织的振动位移Δx(t)与引起组织振动的光声信号p(t)的一维简化关系如下[26]:

其中va为超声在介质中的传播速度,ρ为介质的密度,t为激光脉冲的脉宽。组织表面的振动会改变干涉仪中样品臂的相位,因此通过检测相位变化就能得到光声信号引起的振动位移的大小。为方便,将Δx(t)写成Δx。光声信号引起的组织表面位移与相位的变化关系如下:

其中λ0为探测光的中心波长。通过干涉仪最终探测到的干涉光强为:
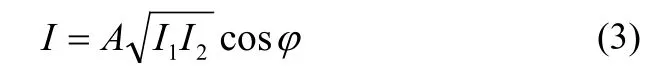
A为光电平衡探测器的放大倍数,I1、I2分别为参考臂及样品臂反射回去的光强。相位φ包含环境噪声(光学平台的振动及空气扰动等)产生的相位φnoise及光声信号引起的相位变化Δφ,即:φ=Δφ+φnoise。由(3)式可得,当时,即干涉信号经过差分放大后输出为“0”时,系统对光声信号的检测灵敏度最高,此时作为光声信号的检测时间窗口。
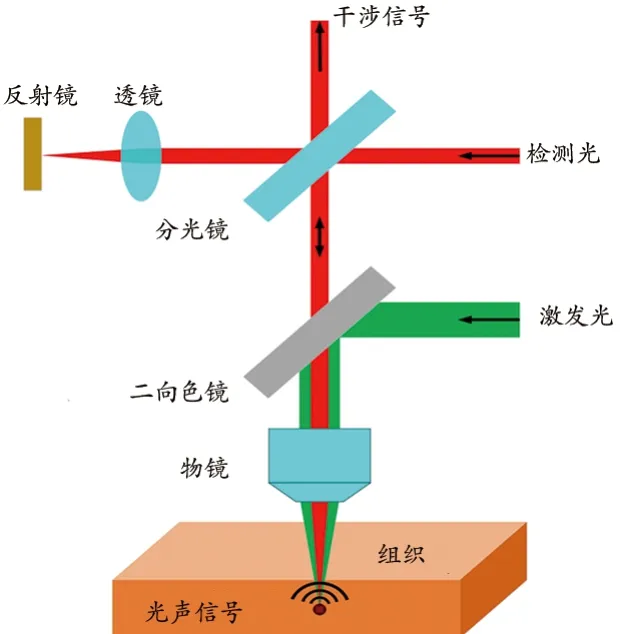
图1 光学相干法检测光声信号的原理图
1.2 非接触式光声成像系统
非接触式光声成像系统原理图,见图2。光声信号检测系统由超发光二极管(中心波长1310 nm,带宽45 nm)、光纤环形器、2×2光纤耦合器、二向色镜、反射镜光电平衡探测器等组成(图2a)。从光纤耦合器输出的检测光通过光纤准直器和透镜1聚焦在反射镜上形成干涉仪的参考臂,另一路检测光通过二向色镜、扩束系统(L2焦距是30 mm,L3焦距是100 mm)及物镜聚焦在样品表面形成干涉仪的样品臂,调整样品臂与参考臂的长度使其相等,从而使干涉仪工作在零差模式。考虑到该系统主要用来进行血管成像,所以选用的脉冲激光器波长是532 nm,脉宽为 10 ns,重复频率是 0.11~10 kHz(HLX-I-F005,Horus Laser),4倍物镜用来聚焦光束。由前文我们知道只有在环境噪声ϕ =kπ ±的情况下系统的灵敏度最高,在这里我
noise们使用FPGA控制卡采集由光电平衡探测器输出的差分信号,对采集到的差分信号进行实时分析,当差分信号在零点附近时可编程逻辑器件(Field-Programmable Gate Array,FPGA)控制卡会发出脉冲信号T1去触发激光器,激光器就会发出激光脉冲来激发光声信号,并同时输出同步信号T2取触发NI-5124采集卡采集光声信号,此时完成对一个扫描点信号的采集,然后由PCI-1716控制卡发出位移信号T3,驱动二维电机扫描平台移动到下一个扫描点,依次循环,实现对样品的二维扫描,最后对各个采样点将得到数据进行最大值投影,从而得到一幅二维光声图像。为了降低噪声影响,将信号通过截止频率为30 kHz的高通滤波器。通常,生物组织对检测光的反射率较低,为进一步提高系统的检测灵敏度,通常在组织表面覆盖一层几百微米厚的油层用来增强反射光。系统的工作时序,见图2b。
首先,我们测试了这种方法检测光声信号的可行性。为此,我们将黑色胶带作为吸收体,使用非接触式光声成像系统测试了黑胶带的光声信号,结果见图2c,表示的是光声信号引起吸收体表面振动的位移大小。根据第一节中等式(1),将图2c中的位移信号进行微分,即可得到光声压信号。这个信号与我们用超声换能器测到的光声信号是一致的,具有双极性。因此,这种光学方法检测光声信号是可行的。
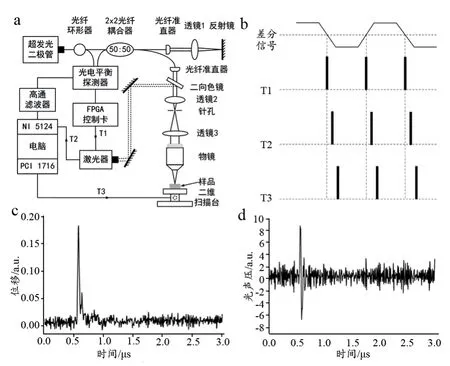
图2 非接触式光声成像系统原理图
2 结果
2.1 系统分辨率测试
为了验证该非接触式光声成像系统的横向分辨能力,我们对直径为6 μm碳纤维丝进行光声成像实验,通过对所获得的光声图像进行分析来量化上述系统的分辨率。实验中,电机的扫描步距为2 μm,扫描速度为40 Hz,且对每个扫描点的数据平均10次。图3a是直径为碳纤维的光声图像。取其在x轴扫描方向上的一维信号,然后通过高斯拟合拟合出光滑的曲线,最后取其半峰全宽作为系统的横向分辨率数值,结果见图3b,可以看到该成像系统的横向分辨率优于10.6 μm。
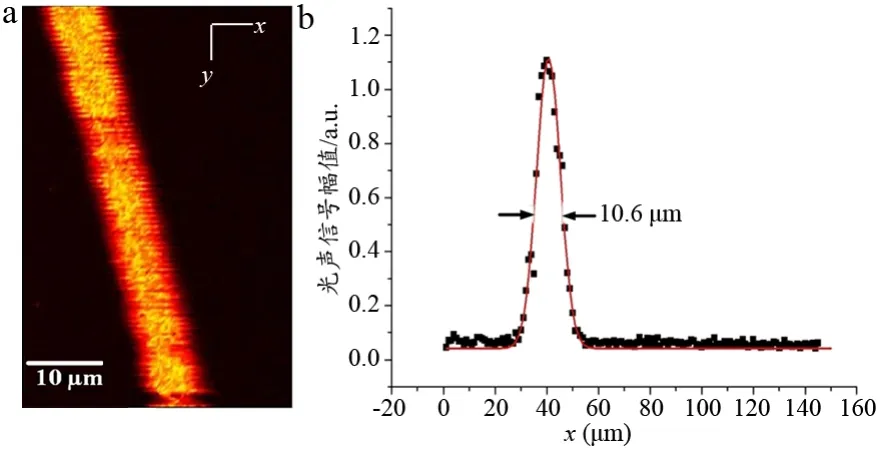
图3 非接触式光声成像系统的横向分辨率
2.2 模拟样品实验
接下来我们证明了该非接触式光声成像系统在散射介质中也有较好的成像能力。实验对象为埋在浓度为1%的琼脂凝胶中的菩提叶脉,叶脉在实验前经过染料处理,使得它在532 nm激发光下可以激发出光声信号,凝胶模拟组织对光的高散射特性。实验中,电机扫描步距为10 μm,成像范围为4 mm×4 mm。成像结果,见图4。叶脉的纹理能够被清晰地成像出来,且图像具有很高的对比度。模拟实验证明了该非接触式光声成像系统能够以高的分辨率成像高散射介质中的吸收体。
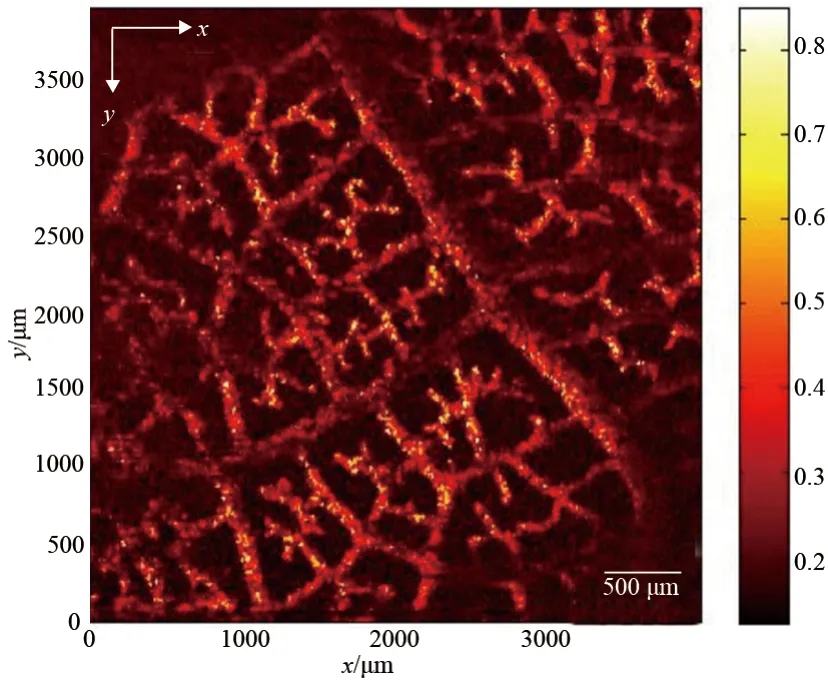
图4 菩提叶脉的光声成像实验
2.3 在体实验
为了验证该非接触光声成像系统的在体成像能力,我们用该系统对接种有黑色素瘤的小鼠耳朵的血管及瘤体进行了活体成像。根据实验规范,在实验前我们先用麻醉剂队小鼠进行腹腔注射(40 mg/kg)麻醉。为了保证小鼠耳朵不被损害,实验过程中对激光能量进行测量,将其控制在12 mJ/cm2以下。图5为黑色素瘤小鼠耳朵光声二维成像结果,其血管网络清晰可见,成像范围为3 mm×3 mm,绿色圆形虚线框为黑色素瘤实体部位,由图可以看出肿瘤相关血管结构具有高度的紊乱性,其新生血管结构为点状结构,见图5中的绿色矩形框的箭头所示。此在体实验结果说明了该非接触式光声成像技术可以活体成像生物组织,在识别皮肤肿瘤疾病等相关血管结构及肿瘤实体方面具有潜在的应用前景,并且与传统方法比较,该非接触式光声成像技术对于病灶有溃疡的区域的成像及检测更具优势。

图5 黑色素瘤小鼠耳朵血管及瘤体的光声成像实验
3 结论
本文我们首先介绍了非接触式光声成像的背景,分析了基于全光纤低相干迈克尔逊干涉仪的光学检测光声信号的原理,然后详细描述了非接触式光声信号检测的方法,最后,成功构建了非接触式光声成像系统,测试了系统的分辨率,通过模拟及在体实验验证了系统的成像能力,实验表明非接触式光声成像系统具高分辨成像生物组织的能力。另外,由于该光声成像系统的非接触的特性,因而更加方便于实际应用,使得该系统在生物医学研究中具有广阔的应用前景。同时,本文中光声信号检测所使用的低相干迈克尔逊干涉仪是OCT系统中的关键部件,因而可以方便的实现光声/OCT双模态成像系统,能够提供更丰富的生物组织信息。
[1] Rousseau G,Gauthier B,Blouin A,et al.Non-contact biomedical photoacoustic and ultrasound imaging[J].J Biomed Opt,2012,17(6):061217.
[2] Berer T,Hochreiner A,Zamiri S,et al.Remote photoacoustic imaging on solid material using a two-wave mixing interferometer[J].Opt Let,2010,35(24):4151-4153.
[3] Hochreiner A,Berer T,Grün H,et al.Photoacoustic imaging using an adaptive interferometer with a photorefractive crystal[J].J Biophoton,2012,5(7):508-517.
[4] Monchalin JP.Optical detection of ultrasound at a distance using a confocal Fabry-Perot interferometer[J].Appl Phys Lett,1985,47(1):14-16.
[5] Paltauf G,Nuster R,Haltmeier M,et al.Photoacoustic tomography using a Mach-Zehnder interferometer as an acoustic line detector[J].Appl Optics,2007,46(16):3352.
[6] Nuster R,Holotta M,Kremser C,et al.Photoacoustic microtomography using optical interferometric detection[J].J Biomed Opt,2010,15(2):021307.
[7] Gratt S,Wurzinger G,Nuster R,et al.Free beam fabry-perotinterferometer as detector for photoacoustic tomography[J].SPIE,2013,8800(21):880002.
[8] Wild G,Hinckley S.Acousto-Ultrasonic Optical Fiber Sensors:Overview and State-of-the-Art[J].IEEE Sens J,2008,8(7):1184-1193.
[9] Grün H,Berer T,Burgholzer P,et al.Three-dimensional photoacoustic imaging using fiber-based line detectors[J].J Biomed Opt,2010,15(2):021306.
[10] Yang Q,Loock HP,Kozin I,et al.Fiber Bragg grating photoacoustic detector for liquid chromatography[J].Analyst,2008,133(11):1567.
[11] Yarai A.Fiber Bragg grating applied multi-functional sensor based on pulsed photoacoustic technique[J].Procedia Engin,2010,5:1180-1183.
[12] Draguioti E,Pérennès F,Beard PC,et al.Optical fiber photoacoustic–photothermal probe[J].Opt Lett,1998,23(15):1235-1237.
[13] Govindan V,Ashkenazi S.Bragg waveguide ultrasound detectors[J].IEEE Trans Ultrason Ferroelectr Freq Control,2012,59(10):2304-2311.
[14] Chao CY,Ashkenazi S,Huang SW,et al.High-frequency ultrasound sensors using polymer microring resonators[J].IEEE T Ultrason Ferr,2007,54(5):957-965.
[15] Paltauf G,Schmidtkloiber H,Köstli KP,et al.Optical method for two-dimensional ultrasonic detection[J].Appl Phys Lett,1999,75(8):1048-1050.
[16] Paltauf G,Schmidt-Kloiber H,Guss H.Light distribution measurements in absorbing materials by optical detection of laser nduced stress waves[J].Appl Phys Lett,1996,69(11):1526-1528.
[17] Wilkens V.Characterization of an optical multilayer hydrophone for use as broadband ultrasound reference receiver—comparison with PVDF membrane hydrophones[J].Proc IEEE Ultrason Symp,2002,1(1):773-776.
[18] Chow CM,Zhou Y,Guo Y,et al.Broadband optical ultrasound sensor with a unique open-cavity structure[J].J Biomedl Opt,2011,16(1):017001.
[19] Schilling A,Yavaş O,Bischof J,et al.Absolute pressure measurements on a nanosecond time scale using surface plasmons[J].Appl Phy Lett,1996,69(27):4159-4161.
[20] Boneberg J,Briaudeau S,Demirplak Z,et al.Two-dimensional pressure measurements with nanosecond time resolution[J].Appl Phys A,1999,69(1):557-560.
[21] Yakovlev VV,Dickson W,Murphy A,et al.Ultrasensitive non-resonant detection of ultrasound with plasmonic metamaterials[J].Adv Mater,2013,25(16):2351.
[22] Pouet BF,Ing RK,Krishnaswamy S,et al.Heterodyne interferometer with two-wave mixing in photorefractive crystals for ultrasound detection on rough surfaces[J].Appl Phys Lett,1996,69(25):3782-3784.
[23] Carp SA,Venugopalan V.Optoacoustic imaging based on the interferometric measurement of surface displacement[J].J Biomed Opt,2007,12(6):064001.
[24] Zhang E,Laufer J,Beard P.Backward-mode multiwavelength photoacoustic scanner using a planar Fabry-Perot polymer film ultrasound sensor for high-resolution three-dimensional imaging of biological tissues[J].Appl Opt,2008,47(4):561-577.
[25] Li C,Wang RK,Wang Y.Noncontact photoacoustic imaging achieved by using a low-coherence interferometer as the acoustic detector[J].Opt Lett,2011,36(20):3975.
[26] Xu M,Wang L.Time-domain reconstruction for thermoacoustic tomography in a spherical geometry[J].IEEE T Med Imaging,2002,21(7):814-822.
