四逆散对心理应激肝郁证模型大鼠ERK1/2-CREB信号通路的影响*
2018-01-29王瑞婷王雅楠宋殿荣孟文曼张继雯许春月
王瑞婷 ,王雅楠 ,,宋殿荣 ,孟文曼 ,郭 洁 ,姜 晶 ,张继雯 ,许春月
心理应激是指机体在某种环境刺激作用下由于客观要求和应对能力不平衡所产生的一种适应环境的紧张反应状态[1]。刺激过强、时间过长的不良应激可导致神经-内分泌-免疫调节功能紊乱。手术作为一种应激源,可导致患者一系列不良应激反应发生。课题组前期对1 283例因妇科良性肿瘤择期手术患者临床调查发现,妇科术前患者中不良心理应激反应的发生率为64.15%,其中62.21%为肝气郁结证[2],四逆散可调节术前不良心理应激激素和神经递质的紊乱[3]。为进一步探讨四逆散改善心理应激肝郁证的作用及其机制,本研究采用慢性束缚制动结合孤养的方法制备心理应激肝郁证大鼠模型,通过观察四逆散对大鼠血浆和脑脊液应激相关激素、神经递质及海马和下丘脑部位细胞外信号调节蛋白激酶(ERK)1/2-cAMP反应元件结合蛋白(CREB)信号通路关键分子及c-fos mRNA和蛋白质表达的影响,试图阐明四逆散通过ERK1/2-CREB信号通路改善心理应激肝郁证的作用机制。
1 材料与方法
1.1 动物 健康雄性SD大鼠,级别SPF/VAF,体质量(190~210)g,由军事医学科学院卫生学环境医学研究所提供,许可证号为SCX K(军)2014-0001。
1.2 药物 四逆散颗粒剂(柴胡、白芍、枳实、炙甘草各10 g,北京康仁堂药业有限公司),艾司唑仑(1 mg/片,山东信谊制药有限公司)。
1.3 主要试剂 半定量PCR试剂盒和山羊抗兔IgG(H+L)二抗(Promega公司)。丝裂原活性蛋白激酶激酶 1/2(MEK1/2)、ERK1/2、CREB、c-fos 及内参GAPDH的特异性引物(由上海生工生物工程股份有限公司设计与合成),兔抗鼠p-MEK1/2一抗(abcam公司),兔抗鼠p-ERK1/2一抗、兔抗鼠p-CREB一抗、兔抗鼠c-fos一抗、兔抗鼠GAPDH一抗(Millipore公司),促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)、肾上腺素(E)、去甲肾上腺素(NE)和5-羟色胺(5-HT)酶联免疫吸附(ELISA)试剂盒(上海蓝基生物科技有限公司)。
1.4 主要仪器 高架十字迷宫及分析系统(SLY-ETS型),北京硕林苑科技有限公司;自制大鼠束缚筒;全自动多功能酶标仪(GF-M3000型),山东高密彩虹分析仪器有限公司;PCR扩增仪(PCRSystem9700),Gene Amp公司;水平电泳仪(cavoy);垂直电泳仪、转膜仪(DYCZ-24DN型);BIO-RAD凝胶成像系统(YQ-602BR1104型),美国伯乐公司。
1.5 方法
1.5.1 心理应激肝郁证模型的建立及分组 将120只大鼠正常饲养、自由饮食、适应性饲养1周后,随机分为正常对照组、模型空白组、四逆散组、艾司唑仑组各30只。应用慢性束缚制动结合孤养的方法制备心理应激肝郁证大鼠模型[4]:将大鼠依次放入自制的束缚筒内(筒长约20 cm,筒口内径最宽处5.5 cm,最窄处2.2 cm),通过移动闸门而逐步缩小大鼠的活动空间,调节到其不产生强烈反抗的紧张程度,每日束缚制动1次,持续时间由第1天3 h,以后每次增加30 min,连续21 d。造模大鼠在束缚制动期间禁食、禁水,其余时间放出,自由饮食。正常对照组不予任何干预,自由饮食,每笼5只。根据造模前后大鼠一般状态、体质量增长情况、高架十字迷宫实验验证心理应激肝郁证模型成功。
1.5.2 给药 大鼠给药剂量按人与动物体表面积折算[5],给药剂量=临床常用量×动物等效剂量系数(大鼠与人的等效剂量系数为0.018),灌胃容积10 mL/kg。四逆散组给予四逆散混悬液3.6 g/(kg·d)灌胃,艾司唑仑组给予艾司唑仑溶液0.36 mg/(kg·d)灌胃,模型空白组给予生理盐水灌胃,均自造模结束后第3天开始灌胃,2 mL/次,每日1次,连续5 d,正常对照组不予任何干预。
1.5.3 取材 于末次给药24 h后处死大鼠。取各组10只大鼠,股动脉采血 3 mL,4℃,3 000 r/min,离心15 min,取血浆,-20℃保存备用。取各组10只大鼠,枕骨大孔直接穿刺法取脑脊液100~200μL,-20℃保存备用。取各组10只大鼠,经0.1 mol PBS心脏灌注后取全脑,迅速分离出海马及下丘脑组织放入冻存管中,放入液氮中速冻后,-80℃保存备用。
1.5.4 ELISA法检测血浆和脑脊液CRH、ACTH、E、NE和5-HT的含量 采用ELISA法测定大鼠血浆和脑脊液CRH、ACTH、E、NE和5-HT含量。
1.5.5 半定量PCR法检测海马和下丘脑MEK1/2、ERK1/2、CREB及c-fosmRNA的表达 RNeasy Plus Mini试剂盒一步法分别提取各组大鼠海马和下丘脑组织总RNA,采用紫外分光光度仪测总RNA的浓度、纯度,采用1%琼脂糖凝胶电泳检测RNA的完整性,以提取的总RNA为模板,反转录成cDNA,以cDNA为模板,进行PCR扩增,PCR扩增后的产物进行2%琼脂糖凝胶电泳,凝胶扫描拍摄系统扫描后,运用Image J图像分析系统测定光密度值,目的基因与内参条带光密度值的比值作为结果进行统计分析。PCR反应体系:GoTap Green Master Mix2X 12.5μL,上游引物 10μmol/L 2μL,下游引物10μmol/L 2μL,cDNA模板4μL,无核酸酶水补至终体积25μL。PCR扩增条件:预变性(94℃4min),变性(94℃45 s),退火(56℃45 s),延伸(72℃ 45 s),30个循环。引物序列见表1。

表1 引物序列表Tab.1 Primer sequence table
1.5.6 Western blot法检测海马和下丘脑部位p-MEK1/2、p-ERK1/2、p-CREB 及 c-fos蛋白的表达 提取各组大鼠海马和下丘脑组织总蛋白,BCA法进行蛋白定量。各取50μg蛋白,按照4∶1体积加入5×蛋白上样缓冲液,煮沸5 min,蛋白变性后,进行SDS-PAGE凝胶电泳,电泳结束后,根据蛋白分子大小进行切胶,湿转至PVDF膜,p-MEK1/2、p-ERK1/2、p-CREB及内参 GAPDH蛋白分别用Western封闭液室温封闭90 min后,分别加入一抗(兔抗鼠p-MEK1/2抗体、p-ERK1/2抗体、p-CREB抗体、GAPDH抗体按1∶1 000稀释,兔抗鼠c-fos抗体按 1∶2 000稀释),4℃孵育过夜,Western洗涤液洗膜5次,10 min/次。加入二抗(山羊抗兔IgG(H+L)按 1∶5 000 稀释),室温水平摇床孵育 60 min,Western洗涤液洗膜5次,10 min/次。经过ECL曝光显色,BIO-RAD凝胶成像系统摄像扫描后,运用Image J图像分析系统测定条带灰度值,采用目的蛋白与内参条带灰度值的比值作为结果进行统计分析。
1.6 统计学方法 运用SPSS 23.0统计软件分析,结果以均值±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 心理应激肝郁证模型的建立
2.1.1 大鼠体质量增长情况 与正常对照组比较,造模组大鼠体质量增长缓慢,差异具有统计学意义(P<0.05)。见表 2。

表2 两组大鼠体质量增加量(与造模前体质量的差值,x±s)Tab.2 Body weight of rats(the difference before modeling,x±s)g
2.1.2 大鼠一般状态的变化 正常对照组和造模组大鼠造模前一般状态均正常:精神状态良好,反应活跃,情绪状态正常,皮毛光顺润泽,饮食睡眠正常,粪便呈球形或橄榄球形,干稀适中。造模结束后,正常对照组一般状态正常,造模组精神倦怠,反应迟缓,情绪低落,皮毛枯槁,饮食减少,嗜睡,大便稀溏。
2.1.3 大鼠高架十字迷宫实验 正常对照组大鼠造模前后高架十字迷宫实验结果差异无统计学意义(P>0.05)。造模组大鼠,与造模前比较,造模后进入开放臂次数百分比(OE%)及时间百分比(OT%)均明显减少,差异具有统计学意义(P<0.05)。造模后进入闭合臂次数百分比(CE%)和闭合臂时间百分比(CT%)明显增加,差异具有统计学意义(P<0.05)。见表3。

表3 两组大鼠造模前后高架十字迷宫实验结果(x±s)Tab.3 Resultsof thedesign of theelevated crosslabyrinth experiment beforeand after modeling(x±s)%
2.2 各组大鼠血浆和脑脊液CRH、ACTH、E、NE和5-HT的含量 与正常对照组比较,模型空白组血浆和脑脊液CRH、ACTH、E、NE水平明显升高,5-HT的水平明显降低,差异有统计学意义(P<0.05)。与模型空白组比较,四逆散组和艾司唑仑组均能明显降低血浆和脑脊液CRH、ACTH、E、NE的水平,升高5-HT的水平,差异有统计学意义(P<0.05)。见表4、表5。
2.3 各组大鼠海马及下丘脑部位MEK1/2、ERK1/2、CREB及c-fos mRNA的表达 与正常对照组比较,模型空白组大鼠海马和下丘脑部位MEK1/2、ERK1/2、CREBmRNA 的表达明显减少(P<0.05)。与模型空白组比较,四逆散组和艾司唑仑组大鼠海马和下丘脑部位MEK1/2、ERK1/2、CREB mRNA 的表达明显增加(P<0.05)。各组大鼠间海马和下丘脑部位c-fosmRNA的表达差异无统计学意义(P>0.05)。见表 6、图 1。
2.4 各组大鼠海马和下丘脑部位p-MEK1/2、p-ERK1/2、p-CREB及c-fos蛋白的表达 与正常对照组比较,模型空白组大鼠海马和下丘脑部位p-MEK1/2、p-ERK1/2、p-CREB 蛋白的表达明显减少,差异具有统计学意义(P<0.05)。与模型空白组比较,四逆散组和艾司唑仑组大鼠海马和下丘脑部位p-MEK1/2、p-ERK1/2、p-CREB 蛋白的表达明显增加,差异具有统计学意义(P<0.05)。各组大鼠间海马和下丘脑部位c-fos蛋白的表达差异无统计学意义(P>0.05)。见表 7、图 2。
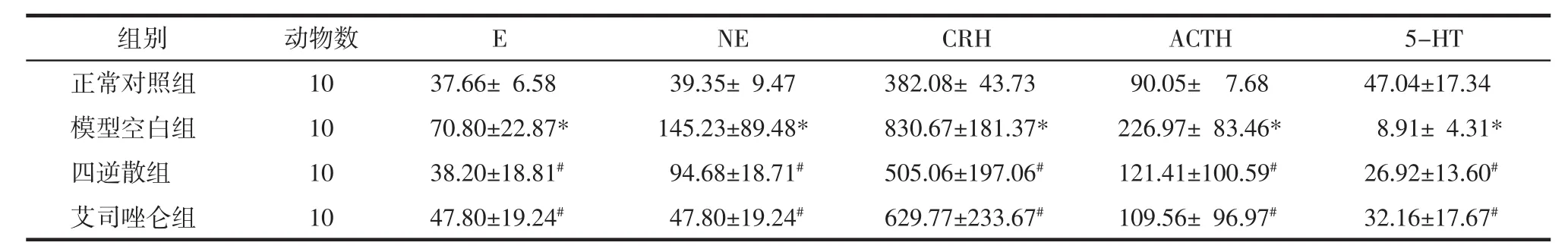
表4 各组大鼠血浆E、NE、CRH、ACTH和5-HT的含量(x±s)Tab.4 Levels of CRH,ACTH,E,NE and 5-HT in plasma(x±s)pg/mL
3 讨论
肝郁证与现代心理应激密切相关,均属于情志致病的范畴,且都表现出神经-内分泌-免疫网络调节(NIM)功能的紊乱,疏肝方药可通过调节心理应激相关激素及神经递质的水平改善肝郁证的作用[6-7]。肝主疏泄,能够调节气机、调畅情志、调和气血,是脏腑组织器官的调节中心。四逆散首载于《伤寒论》,由柴胡、白芍、枳实、炙甘草组成,具有疏肝理脾、透邪解郁、调和胃气的作用。课题组前期通过临床研究发现四逆散能够降低术前心理应激肝郁证患者的 CRH、ACTH、COR、E、NE、白介素-2(IL-2)含量,升高多巴胺(DA)、5-HT的含量,明显改善术前心理应激肝郁证患者的心理和躯体症状[3]。
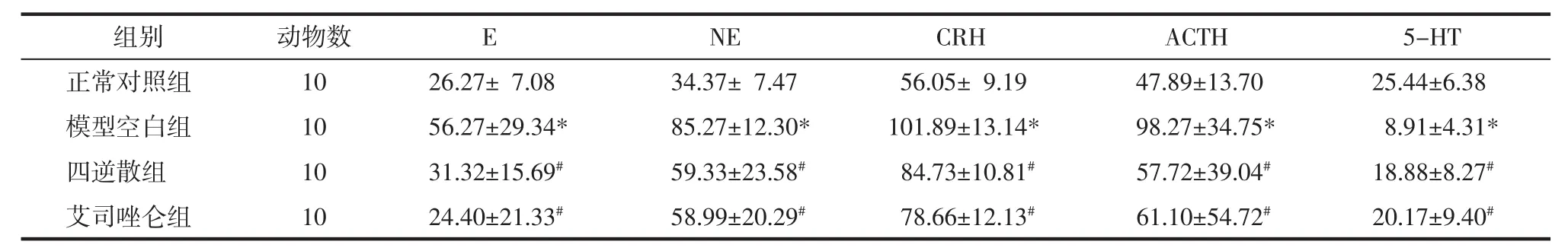
表5 各组大鼠脑脊液E、NE、CRH、ACTH和5-HT的含量(x±s)Tab.5 Levelsof E,NE,CRH,ACTH and 5-HT in cerebrospinal fluid(x±s)pg/mL
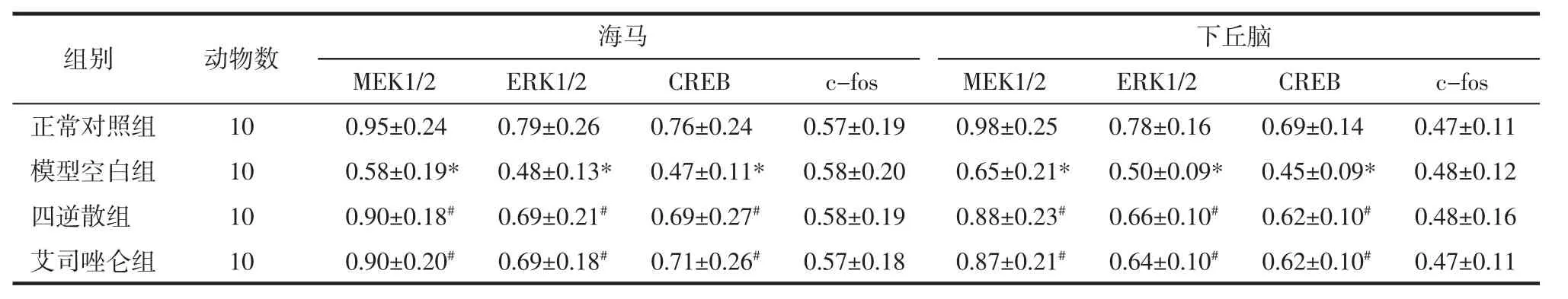
表6 各组大鼠海马和下丘脑部位MEK1/2、ERK1/2、CREB及c-fosmRNA的表达(x±s)Tab.6 Expression of MEK1/2,ERK1/2,CREB and c-fos mRNA in the hippocampusand hypothalamus(x±s)
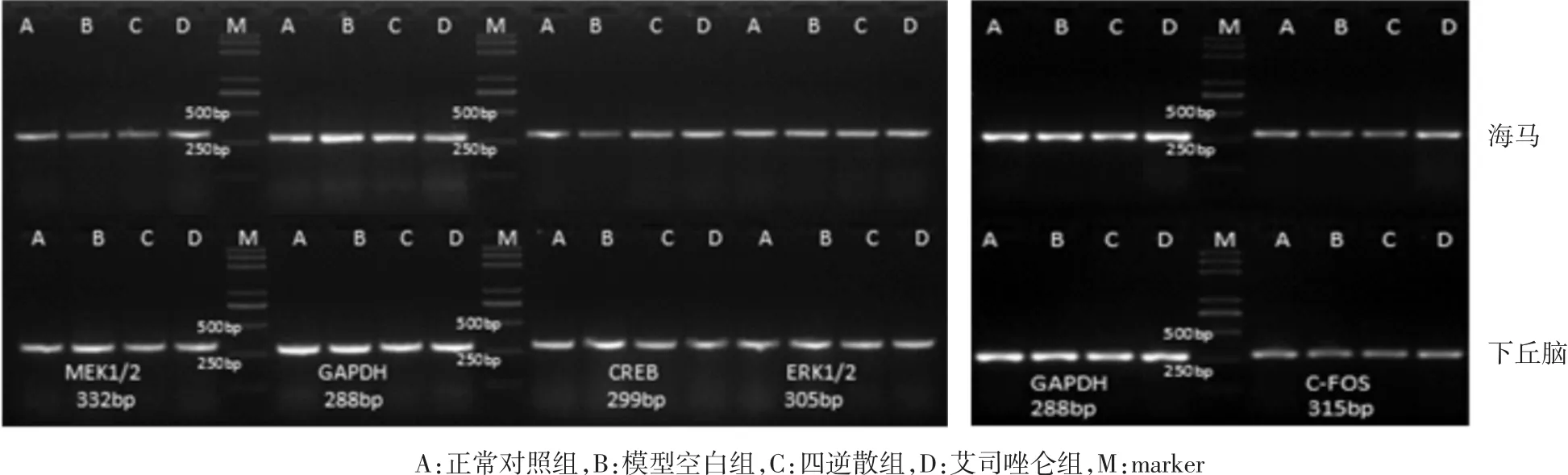
图1 各组大鼠海马和下丘脑MEK1/2、ERK1/2、CREB及c-fosmRNA的表达Fig.1 Expression of MEK1/2,ERK1/2,CREB and c-fos mRNA in the hippocampus and hypothalamus

表7 各组大鼠海马和下丘脑p-MEK1/2、p-ERK1/2、p-CREB及c-fos蛋白的表达(x±s)Tab.7 Expression of p-MEK1/2,p-ERK1/2,p-CREB and c-fos protein in the hippocampusand hypothalamus(x±s)

图2 各组大鼠海马和下丘脑p-MEK1/2、p-ERK1/2、p-CREB及c-fos蛋白的表达Fig.2 Expression of p-MEK1/2,p-ERK1/2,p-CREB and c-fos protein in the hippocampusand hypothalamus
本研究采用慢性束缚制动结合孤养的方法制备心理应激肝郁证大鼠模型,研究发现,心理应激刺激可升高大鼠血浆和脑脊液CRH、ACTH、E、NE水平,降低5-HT的水平。四逆散及艾司唑仑均能降低模型大鼠血浆和脑脊液CRH、ACTH、E、NE的水平,升高5-HT的水平,改善模型大鼠肝郁状态。
下丘脑为神经内分泌系统的中心,海马富含各种信使受体,其中糖皮质激素受体(GR)与HPA轴功能亢进释放的大量糖皮质激素结合,导致海马GR减少,海马神经元损伤,对HPA轴的负反馈调节作用减弱,使HPA轴处于持续亢进状态[8]。因此抑制海马和下丘脑神经元应激性损伤,恢复海马和下丘脑功能是调节神经内分泌平衡,调节情志的方法之一。ERK是一种蛋白酶细胞内信号分子,C REB是一种调节基因转录的蛋白质,CREB可通过ERK信号通路的磷酸化级联反应激活,参与调节神经元细胞存活、增殖、凋亡、修复的过程[9]。细胞受到刺激后通过连续的磷酸化级联反应(Ras/Raf/MEK/ERK)激活ERK1/2,活化的ERK1/2放大信号并将信号从细胞膜传导到细胞核中,使细胞核中的CREB蛋白磷酸化,p-CREB结合于DNA的特定部位并调节多种基因的转录。CREB可通过CREB蛋白与c-fos基因启动子区的cAMP反应元件(CRE)位点结合,对c-fos基因的表达进行调控[10],与脑源性神经营养因子(BD NF)基因启动子区CRE位点结合,对BDNF基因的表达进行调控[11]。大量研究表明ERK/CREB信号通路在心理应激性疾病的发病机制中发挥重要作用,心理应激状态下,ERK/CREB信号通路受到抑制,ERK、CREB的磷酸化水平下调,而不同的抗抑郁治疗可通过上调ERK、CREB磷酸化水平达到抗抑郁的作用[12-13]。本研究发现心理应激大鼠海马和下丘脑部位MEK1/2、ERK1/2、CREB mRNA及p-MEK1/2、p-ERK1/2、p-CREB 蛋白的表达明显降低,四逆散和艾司唑仑均能够上调肝郁证大鼠海马和下丘脑部位MEK1/2、ERK1/2、CREB mRNA及p-MEK1/2、p-ERK1/2、p-CREB 蛋白的表达,从而改善模型大鼠肝郁状态。
c-fos是参与细胞最早功能活动的基因,在细胞受到外部刺激后最先表达,被作为神经元活动的标志。在生理状态下c-fos基因在细胞内包括神经元中呈较低水平表达,当受到刺激时,可诱导中枢神经系统(CNS)中c-fos基因快速、急剧、灵敏的表达[14]。促皮质激素释放激素(CRF)是c-fos的下游靶基因,应激发生时下丘脑首先被激活,下丘脑室旁核部位的c-fos作为第三信使调节CRF的表达,启动HPA轴,进而影响与应激有关的神经内分泌免疫活动[15]。而c-fos基因的表达具有时效性,目前对慢性应激刺激时c-fos表达的研究观点不一,Matsuda等[16]研究显示慢性应激可以诱导c-fos持续表达。刘昊等[17]研究发现,慢性应激结束后0.5h c-fos蛋白及mRNA的表达明显升高,之后呈下降趋势,4 h时恢复正常。宋倩[18]则研究发现,慢性应激减少了小鼠海马区、前脑皮层及下丘脑室旁核c-fos的表达。本研究结果显示,各组大鼠海马和下丘脑部位c-fos的表达无明显变化。
综上所述,四逆散改善心理应激肝郁证,可能与降低血浆和脑脊液CRH、ACTH、E、NE的水平,升高5-HT水平有关,其机制可能与上调ERK1/2-CREB信号通路的活动有关,可能通过激活此信号通路磷酸化过程促进神经元应激性损伤的修复而发挥抗肝郁作用。
[1] 姜乾金.医学心理学[M].北京:人民卫生出版社,2002.
[2] 王雅楠,宋殿荣,孙秀丽,等.自编妇科择期手术术前心理应激量表的应用价值评价[J].世界中医药(增刊),2015,10(11):100-105.
[3]张俊博.四逆散对术前患者心理应激反应干预作用的临床研究[D].天津:天津中医药大学,2015.
[4] 李 健,赵志付.中医肝郁证动物造模方法多样性研究[J].中华中医药杂志,2012,27(11):2842-2847.
[5] 魏 伟,吴希美,李元建.药理实验方法学[M].北京:人民卫生出版社,2010.
[6] 赵荣华,刘进娜,李 聪,等.肝郁、脾虚和肝郁脾虚证模型大鼠下丘脑-垂体-肾上腺轴变化及柴疏四君汤的干预效应[J].中国中西医结合杂志,2015,35(7):834-838.
[7] 马玉峰,王嘉麟,邢 佳,等.柴胡疏肝散对肝气郁结证大鼠海马及下丘脑单胺类神经递质的影响[J].中西医结合心脑血管病杂志,2016,14(21):2494-2497.
[8] 贺文彬,张俊龙,陈乃宏.基于海马-HPA轴负反馈调控机制对中医肾脑关系的理论分析[J].中华中医药杂志,2016,31(9):3426-3428.
[9] Liu X,Wang X,Lu J.Tenuifoliside A promotes neurite outgrowth in PC12 cells via the PI3K/AKT and MEK/ERK/CREB signaling pathways[J].Mol Med Rep,2015,12(5):7637-7642.
[10]Ginty DD,Bonni A,Greenberg ME.Nerve growth factor activates a Ras-dependent protein kinasethat stimulatesc-fostranscription via phosphorylation of CREB[J].Cell,1994,77(5):713-725.
[11]Alboni S,Tascedda F,Corsini D,et al.Stress induces altered CRE/CREBpathway activity and BDNFexpression in thehippocampusof glucocorticoid receptor-impaired mice[J].Neuropharmacology,2011,60(7-8):1337-1346.
[12]Haghparast A,Fatahi Z,Alamdary SZ,et al.Changesin thelevelsof p-ERK,p-CREB,and c-fos in rat mesocorticolimbic dopaminergic system after morphine-induced conditioned place preference:the roleof acuteand subchronic stress[J].Cell Mol Neurobiol,2014,34(2):277-288.
[13]许明敏.针刺对抑郁模型大鼠前额叶皮质ERK1/2-CREBBDNF信号通路的影响[D].北京:北京中医药大学,2016.
[14]刘晓军,雷梅芳,张玉琴.即早基因c-fos与神经系统疾病的研究进展[J].天津医科大学学报,2011,17(1):137-139.
[15]卢晓虹,李凌江,李昌琦,等.应激对中枢神经系统即刻早期基因c-fos表达及HPA轴的调节作用研究[J].中国心理卫生杂志,2000,14(1):10-13.
[16]Matsuda S.Persistent c-fos expression in the brains of mice with chronic social stress[J].Neurosci Res,1996,26(2):157-170.
[17]刘 昊,徐爱军,高俊玲,等.慢性强迫游泳应激抑郁模型大鼠海马钙离子浓度和c-fos表达的改变[J].神经解剖学杂志,2010,26(1):73-77.
[18]宋 倩.急慢性应激对小鼠自发行为和空间学习记忆功能的影响及其机制[D].济宁:曲阜师范大学,2010.
