高山植物甘青铁线莲花冠下垂现象适应性意义
2018-01-27范宝强侯勤正王思源张世虎
孙 坤,范宝强,侯勤正,王思源,张世虎
(西北师范大学 生命科学学院,甘肃 兰州 730070)
花部特征的演化一直是进化生物学家关注的热点,但是其进化机制仍不明确.早在1970年,著名进化生物学家Stebbins提出“最有效的传粉者原则”[1],即花部特征是由当地最频繁、最有效的传粉者所塑造的[2].这一观点得到了来自物种水平和系统发育水平研究的支持[3-6].然而,近年来研究者们认识到花部特征的演化受到多种因子的影响[7-8],一系列非传粉者作用因子,如植食作用[9]、盗蜜行为[10]以及环境因素[11-13]等都会驱动植物花部结构特征的进化.因而,研究者们认为花部特征的进化可能处在特殊和复杂的综合选择体系中[14].
花朵下垂现象是植物与周围环境长期相适应的结果,这种花部特征的适应性意义表现在多个方面,例如花朵下垂可以强化昆虫吸引,从而增加传粉者的拜访几率,并提高传粉成功率[15-16];减少雨水冲刷对花粉和柱头的伤害,提高繁殖适合度[13,17-18];避免阳光直射对花粉的伤害,提高花粉活力[11,13,16];保障种子发育,提高植物结籽率[13,18].然而,少有学者对花朵下垂现象的适应性意义做系统综合研究.侯勤正等[13]从传粉者种类和数量、花粉雨水冲刷、阳光直射干扰、结籽率以及种子特征(种子大小特征和种子萌发率)等多个方面对灌木铁线莲(ClematisfruticosaTurcz.)花朵下垂现象做了系统研究,结果证明灌木铁线莲花朵下垂现象没有对主要传粉者的种类和数量产生影响,但是会通过花萼下垂形成的“伞”型结构有效避免了雨水对花粉冲刷以及阳光直射对花粉造成的伤害,同时也可以显著提高结籽率,并且还可以提高种子宿存花柱长度,从而提高种子扩散能力.灌木铁线莲属于毛茛科铁线莲属植物,主要分布在黄土高原及相邻干旱地区[19],其花朵下垂现象显然是对生境的有效适应[13].然而铁线莲属植物种类较多,且在地理分布上存在较大差异,例如甘青铁线莲主要分布于高海拔地区的高原草地或灌丛[20].地理分布上的差异所带来的生境差异是否会影响植物花部结构特征?或者说,类似的花部结构特征是否会因为生境的不同而表现出差异的适应性意义?显然,对于这一问题的回答有助于加深理解植物花部结构特征的适应性意义,并为探讨植物花结构的进化提供理论依据.
高山地区植物所面临的生态环境较为恶劣,例如低温、集中性强降雨、强紫外辐射、较高的昼夜温差等,以及由此带来的传粉昆虫种类和数量稀少,这些生物因子和非生物因子都会对植物的生存和繁殖造成影响.高山地区植物为应对恶劣自然环境会产生一系列适应性特征以保障繁殖[21],然而对于高原植物花部结构特征的适应性意义研究较少.文中以分布于海拔1 370~4 900 m高原草地或灌丛中的甘青铁线莲为对象,开展其花朵下垂现象的适应性意义研究.如前所述,尽管侯勤正等[13]对甘青铁线莲同属近缘种灌木铁线莲花朵下垂现象的适应性意义已做研究,然而类似的花部特征(花期花朵下垂)是否在完全不同的生境条件下产生差异的适应性意义仍未可知.文中通过设计甘青铁线莲花冠人为上举后雨水冲刷、不同时间段阳光直射等试验,探究过量雨水及强紫外线对甘青铁线莲花粉数量与质量两方面的影响,并结合人为花冠上举处理后访花昆虫行为的观察及其结籽率和种子萌发率的测定,探讨高海拔地区植物花冠下垂的适应性意义,并为进一步研究高海拔地区植物的进化及传粉生物学特性提供科学依据.
1 实验材料以及试验方法
1.1 材料采样地概况
研究地点位于甘南藏族自治州麻当乡,样地地处甘南州西北部,青藏高原和黄土高原的交接地带,地势西北高,东南低.境内平均海拔2 400 m,气候寒冷干燥,一年中气温较低,年均降雨量600~810 mm,年均气温4 ℃.由于地处于高原,天气多变,昼夜温差大,太阳辐射强烈.
1.2 实验材料
甘青铁线莲属于毛茛科铁线莲属的一种落叶藤本.一回羽状复叶,有5~7小叶;花单生,有时为单聚伞花序;花序梗粗壮,有柔毛;瘦果倒卵形,有长柔毛,宿存花柱长达4 cm.分布于我国新疆、西藏、四川、青海、甘肃、陕西等海拔1 370~4 900 m高原草地或灌丛中.
1.3 雨水冲刷花粉数量统计
在所选实验样地(甘南藏族自治州夏河县北部通往麻当乡的公路边)即将降雨前随机选取20朵花药刚开始散粉的花,标记并分成2组(每组10朵),将1组花的花冠人为处理(使用牙签、胶带固定)使之上举以接受雨水冲刷,另一组不作处理;同时在下雨前摘取10个不接受雨水冲刷的花作为该实验的自然对照组.当天为中雨天气(1 h内降水量为2.6~8.0 mm),雨水持续了大约50 min.待雨水结束后小心取回标记花朵,带回实验室,并检测上述三类花朵的花粉数目.
1.4 阳光直射花粉活力测定
1.4.1 离体花粉萌发条件测定 配置5%蔗糖、10%蔗糖、15%蔗糖3个浓度梯度的溶液,分别滴加少量硼酸摇匀完成培养基配置.选取花药刚刚开裂后第0~4 d的花粉置于培养基上进行花粉萌发实验(0 d表示花药开裂后即进行实验),25 ℃恒温箱中黑暗培养8 h后统计花粉总数和萌发花粉数,并计算花粉萌发率:萌发率=已萌发的花粉粒数目/花粉粒总数×100%.根据萌发率大小确定最佳萌发蔗糖浓度以及花粉持续时间.
1.4.2 阳光直射花粉活力测定 通过上述离体花粉萌发条件测定,发现5%蔗糖溶液下,花药开裂0 d后的花粉萌发率(85%)显著高于其他组合,因而选择此条件组合对阳光直射后花粉活力进行测定.选择天气晴朗,日照强烈的天气条件,在甘青铁线莲居群随机选取30朵刚开始散粉的花,做以下五类处理:自然对照、人为花冠朝上日照1 h、人为花冠朝上日照2 h、人为花冠朝上日照3 h、人为花冠朝上日照6 h.处理结束后,回收五类处理花朵,分别收集保存好花粉,在已筛选好的最适条件下,进行五类花粉的离体培养实验,25 ℃恒温箱中黑暗培养8 h后统计花粉总数和萌发花粉数,并计算花粉萌发率.
1.5 访花昆虫观察
在甘青铁线莲盛花期,观察两种状态花朵(自然下垂和人工上举)的访花昆虫种类、访花频率以及昆虫单次访花停留时间.观察方法采用Arroyo等的方法[22]进行,观察前选择10~20朵刚开放的花朵,在3 m外观察并记录访花昆虫的种类、访花行为及单次访花停留时间,累计观察时间不少于20 h.
1.6 单花结籽率及种子萌发率
随机选取60朵花苞状态下的花分为两组,一组(30朵)人工上举处理,另一组(30朵)作为自然对照,果实成熟后,收集并统计计算每个单花的结籽率.
做种子萌发率实验前首先对甘青铁线莲种子最佳萌发条件做预实验.选择成熟饱满的种子,分别置于15,20,25及30 ℃ 4个温度梯度的培养箱中(每组各30粒种子,并设置5个重复),并设置12 h光照,12 h黑暗的光周期处理,每天对每个培养皿中种子的发芽数进行统计,以胚根露出种皮作为种子萌发的标志,连续5 d没有种子萌发作为发芽结束状态,记录种子最终的发芽数并计算萌发率:萌发率=发芽种子数/供试种子数×100%.
根据上述预实验,发现在25 ℃下甘青铁线莲种子萌发率(51.73%±1.45%)显著高于其他温度,因而选择此温度条件对不同处理甘青铁线莲花朵的种子萌发率进行测定.随机选取60朵花苞状态下的花分为两组,一组(30朵)人工上举处理,另一组(30朵)作为自然对照,果实成熟后,收集两种状态的成熟种子并在25 ℃条件下做种子萌发实验(方法同预实验),最后统计计算种子萌发率.
2 结果
2.1 雨水冲刷花粉数量
自然状态下,甘青铁线莲单花花粉量为(1 414 932±32 229)个;花冠自然朝向(下垂)且雨水冲刷后花粉量为(1 338 575±84 247)个,与自然对照之间差异显著(P<0.05);而花冠人为上举且雨水冲刷后花粉数量(413 137±75 842)个,与自然对照之间差异显著,结果见图1(P<0.05,不同小写字母表示处理间差异显著,下同).
2.2 阳光直射花粉质量
自然状态下(花朵下垂)甘青铁线莲花粉萌发率为(81.30±5.39)%,在花冠朝向改变(人为上举处理)并接受日照1 h后,其花粉离体萌发率急速下降为(33.70±1.86)%,与自然对照之间差异显著(P<0.05).随后的日照2,3,6 h,花粉离体萌发率缓速下降,逐步趋向于0(图2).
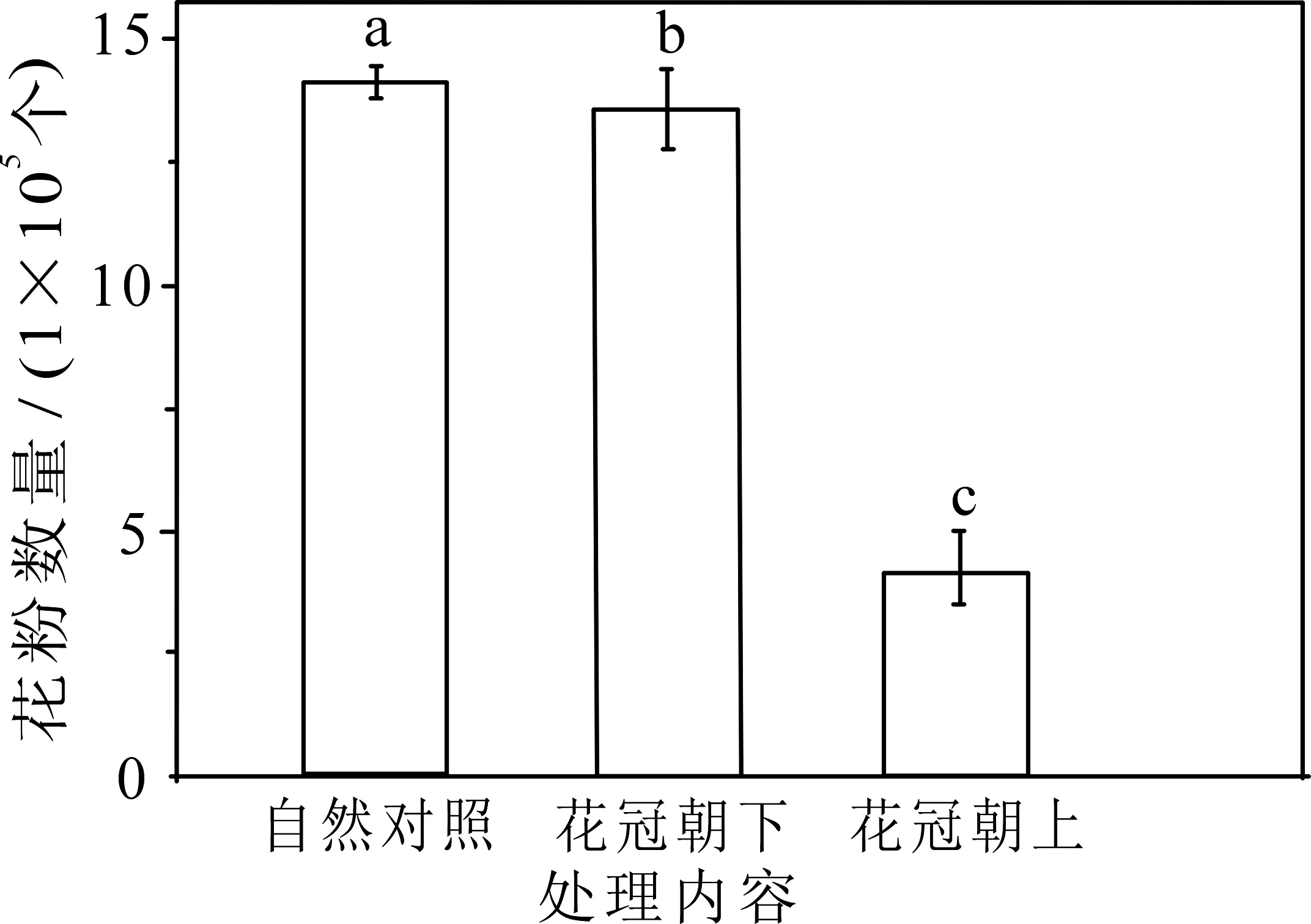
图1 雨水冲刷实验各处理间花粉数量比较
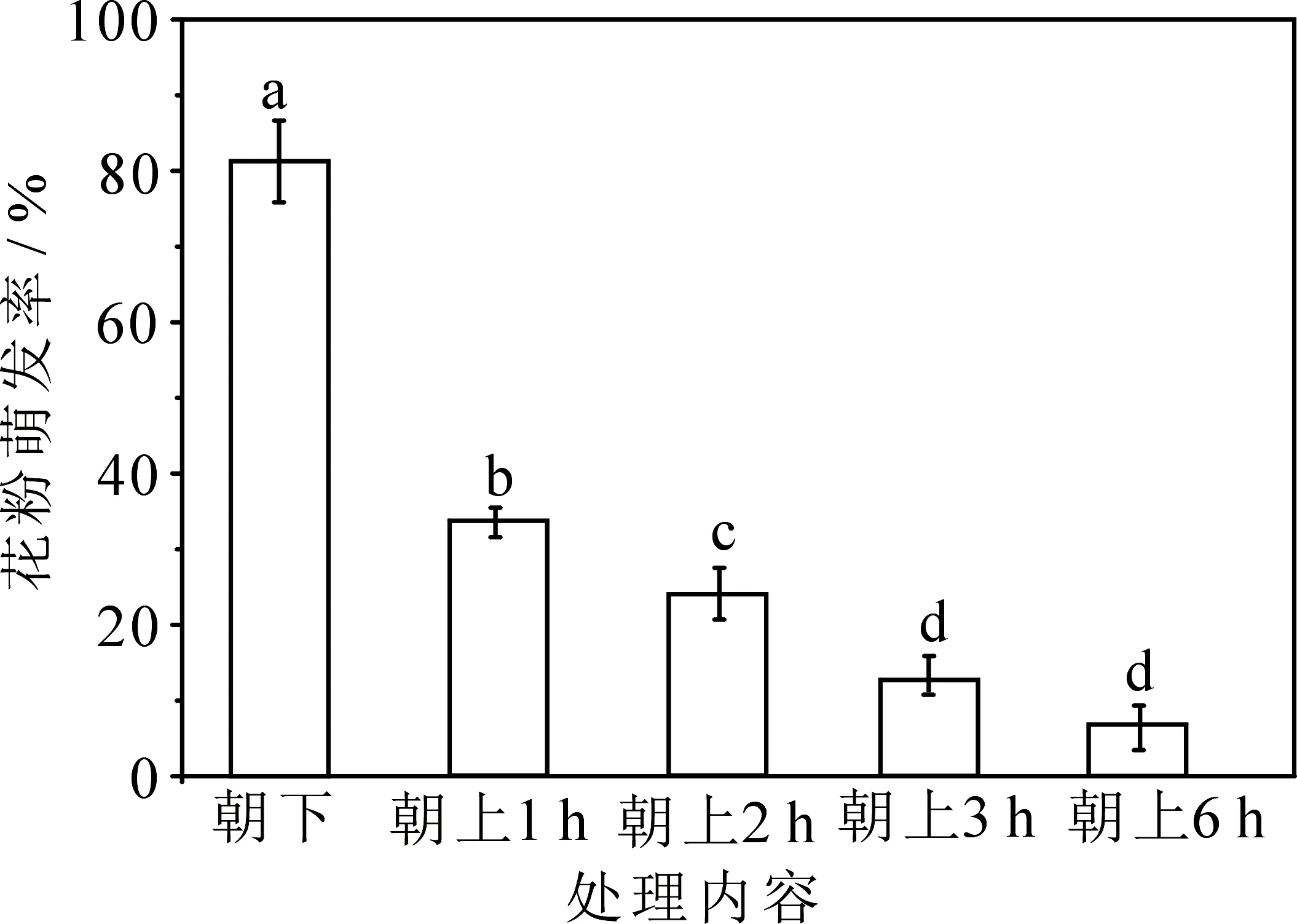
图2 强日照实验各处理间花粉萌发率比较
2.3 花冠朝下与访花昆虫
自然状态下(花朵下垂)甘青铁线莲的主要访花昆虫为中华蜜蜂(ApisceranaFabricius)和熊蜂(Bombusspp.),其访花频率分别为(0.14±0.05)次·朵-1·h-1和(0.24±0.09)次·朵-1·h-1;在花冠朝向改变(人为上举)后,主要传粉昆虫的种类没有发生变化,并且两种传粉者的访花频率分别为(0.14±0.07)次·朵-1·h-1,(0.26±0.09)次·朵-1·h-1)也与自然状态下相比较不存在显著差异(图3).在单次访花的停留时间上,中华蜜蜂和熊蜂单次访花停留时间分别为(14.80±3.27)s,(15.77±3.12)s,而在花冠人为上举处理后,两种昆虫的单次访花停留时间分别为(13.9±2.23)s,(15.38±3.31)s,与自然状态下比较没有显著差异(P>0.05,图4).
2.4 结籽率与种子萌发率
自然状态下(花朵下垂)甘青铁线莲单花结籽率为(77.82±2.95)%,而在花冠上举处理后的单花结籽率(30.37±3.83)%显著低于自然状态(图5).
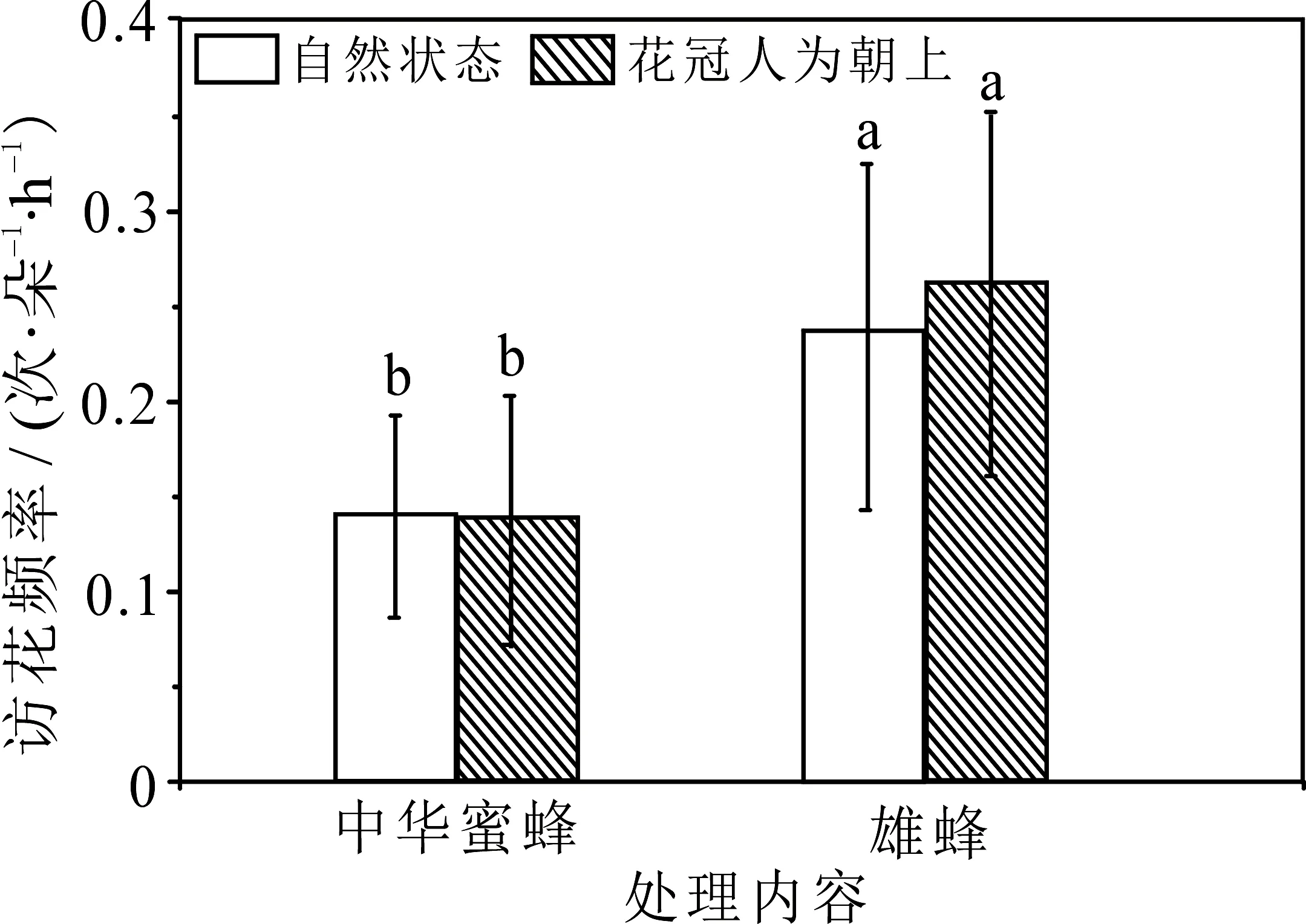
图3 花冠朝向对昆虫访花频率的影响
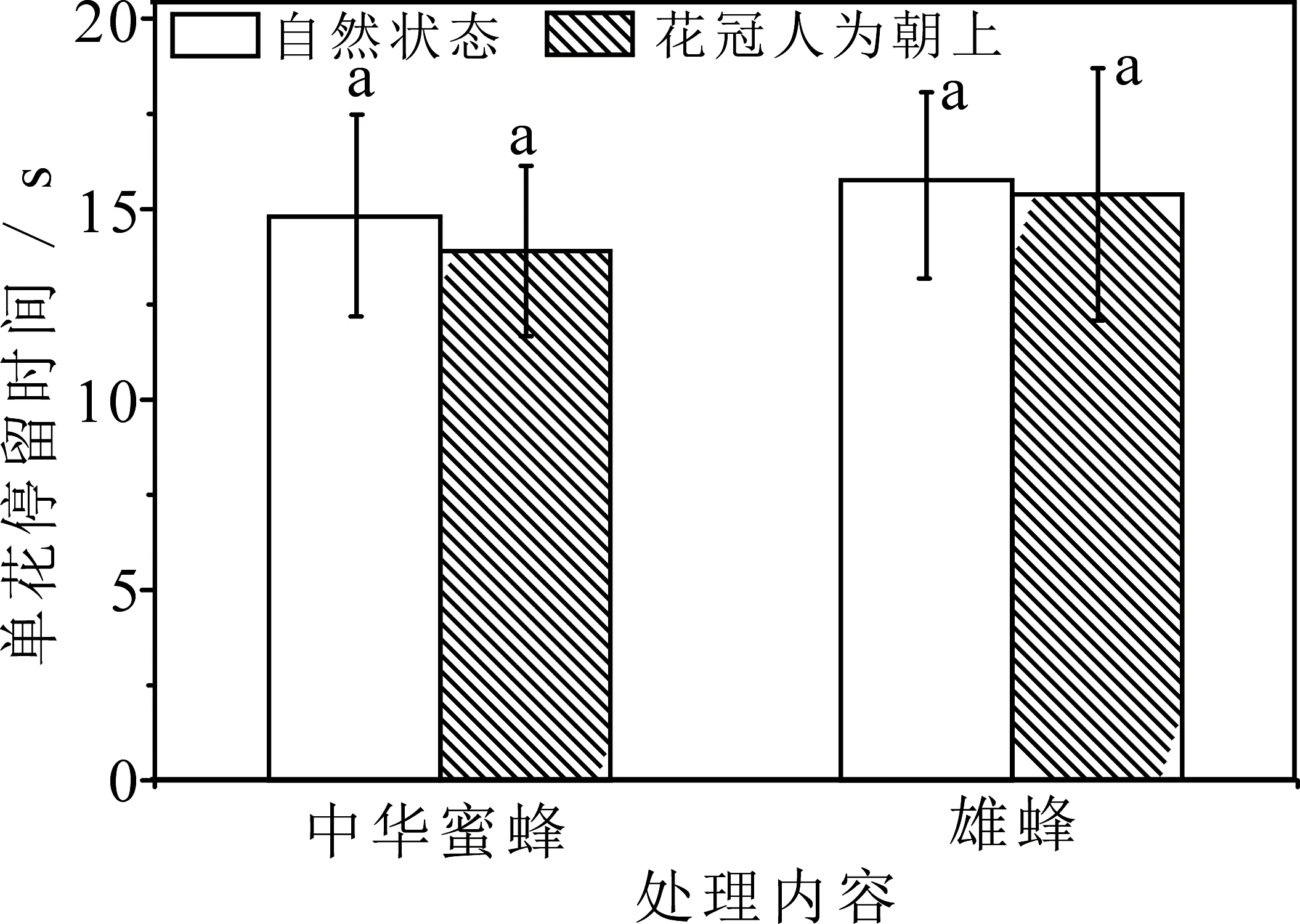
图4 花冠朝向对昆虫单花停留时间的影响

图5 花冠朝向对单花结籽率的影响
自然状态(即花冠朝下)甘青铁线莲种子的萌发率为(51.73±1.45)%; 而将花冠人为上举处理后的萌发率为(19.00±4.81)%,二者差异显著(图6).
3 讨论
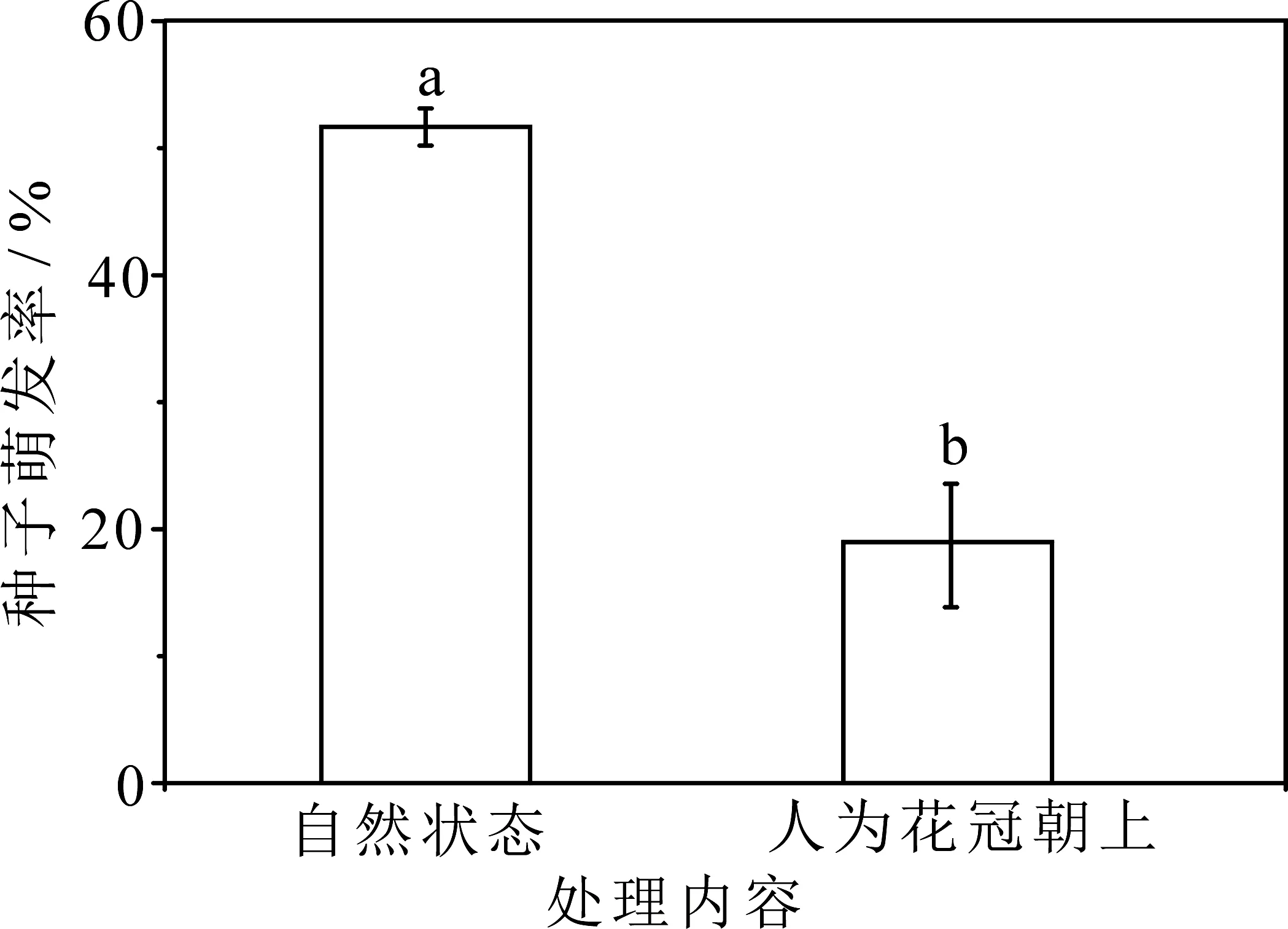
图6 花冠朝向对种子萌发率的影响
高山带较容易发生集中性降水并伴随着降温,集中性高强度降水容易造成花粉的损失并降低其萌发能力,同时还会造成花蜜稀释并影响访花者的拜访[23-25].高山带的另一个显著特征是强紫外辐射,而强紫外辐射会造成较大程度的花粉破坏[12,22].降水以及强紫外辐射作为选择压力促进了花结构和特征的适应性进化,例如喜马拉雅山莨菪(Anisodusluridus)的花梗运动[18]就是一种有效的适应高山环境的策略.在本研究中,甘青铁线莲花朵人工上举处理后,花粉数量和质量(花粉萌发能力)显著降低,花冠防雨能力和防阳光直射的能力显著下降(图2,图3),说明甘青铁线莲花朵下垂作为一种有效的环境适应策略提高了其雄性适合度,进而保障其繁殖成功.与已报到的喜马拉雅山莨菪类似,甘青铁线莲果期也存在花梗运动现象,即在甘青铁线莲果期花梗上举.但是由于甘青铁线莲果期花萼脱落,因而这种花梗运动并不能起到贮水功能,从而也不能由于水的保温作用而保障果实发育,进而提高种子产量和发芽力[18].尽管如此,甘青铁线莲在自然状态下(花朵下垂)其结籽率较高,并且其种子萌发率也较高,这就说明尽管不存在果期花梗运动(上举)后的水温优势,甘青铁线莲的这种花期花朵下垂而果期上举的花梗运动仍然可以保证其繁殖成功,而这种花梗运动显然也是高山植物为应对高山恶劣自然环境的有效适应.侯勤正等研究发现,分布于干旱地区的同属近缘种甘青铁线莲同样也具有类似的花梗运动,并且这种花梗运动也与植物的防雨和防阳光直射有关[13].具有差异地理分布的甘青铁线莲和灌木铁线莲其花梗运动现象在防雨和防阳光直射上具有相同的功能和适应性意义,进而我们猜测铁线莲属植物的这种花梗运动可能都具有相同的功能,且不会受到环境差异的影响.另一方面,花期对甘青铁线莲花冠上举处理后,其结籽率以及种子萌发率显著下降,表明甘青铁线莲的花期花冠下垂现象可以保障其繁殖,尽管这种保障作用的机理仍不清楚(花粉着落柱头障碍、胚珠败育等),但对于甘青铁线莲而言,花期花朵下垂现象无疑可以提高其结籽率,进而提高其雌性适合度,而这种现象作为一种稳定的环境适应策略得以选择和固定.花冠下垂提高雌性适合度并保障繁殖的进化策略在干旱区分布的灌木铁线莲中同样存在[13],表明花冠下垂的这种进化意义同样不会受到差异环境的影响.
吸引传粉者无疑是异花传粉植物花形态结构进化的主要驱动力,而花结构和形态的变化都会影响访花者对花朵访问[26].不少研究表明花朝向和角度的变化都会引起访花者种类和数量的变化,例如Sun和Yao[27]通过研究宝兴百合(Liliumduchartrei)所处的山坡位置与传粉者访花频率的关系,发现宝兴百合在不同的山坡位置会引起花角度变化,进而引起传粉者频率的变化.Wang等[28]通过人为改变地锦苗(Corydalissheareri)花朝向,发现花朝向的改变会引起传粉者(蜜蜂)访花行为和访花效率的变化.但也有证据表明,花朝向的改变并不一定会引起传粉者数量和频率的改变,例如侯勤正等[13]通过对灌木铁线莲花朵上举处理,发现与自然状态(花朵下垂)下的传粉者种类和数量并没有差异.文中结果显示,对甘青铁线莲花冠人工上举处理后,其主要传粉者的种类和访花频率都没有发生显著差异,同时主要传粉者对甘青铁线莲的单花停留时间也没有显著变化(图6,图7),这一结果与侯勤正等[13]的研究结果一致.甘青铁线莲与灌木铁线莲同属于铁线莲属植物,而两种植物的花朝向改变后的传粉者组成和访花频率都没有发生变化,考虑到两种铁线莲属植物的生境差异较大(前者主要分布于高海拔的高山地区,后者主要分布于低海拔的干旱地区),而差异的生境下两种铁线莲属植物在花朝向改变后都不会造成传粉者组成和访花频率的改变,我们猜测造成这种结果的原因可能是两种植物本身的花和花序结构特征对传粉者的吸引造成的.尽管两种铁线莲属植物的花大小存在差异(笔者观察,无实测数据),但在盛花期都会有大量花同时开放,这就在一定程度上大大增加了昆虫吸引效力.同时,部分单花的朝向改变虽然会对植物的花粉数量和质量、花蜜量和花蜜质量等造成影响[13,23-25],但一方面这种对花的影响在短期内的效果不大,另一方面这种花朝向改变在短期内也不会形成对访花昆虫的选择压力,亦即Lewontin适应峰学说(adaptive peaks)[28].当然,这种花朝向改变在较长时间后是否会造成传粉者组成和数量的变化,仍需要更多的实验证明.
4 结束语
本研究以分布于高海拔地区的甘青铁线莲为研究对象,将花朵人为上举改变其朝向后,研究了花粉数量和质量、访花昆虫、结籽率以及种子特征的变化,探讨了高山植物甘青铁线莲花期花冠下垂现象的适应意义.研究表明,甘青铁线莲花期花朵下垂现象对有效传粉昆虫产生的影响不大,但可以显著提高其雄性适合度和雌性适合度,并作为一种有效的适应策略保障其繁殖成功.
[1] STEBBINS G L.Adaptive radiation of reproductive characteristics in angiosperms,I:pollination mechanisms[J].AnnualReviewofEcologyandSystematics,1970,1(1):307.
[2] HUANG S Q.Most effective pollinator principle of floral evolution:evidence and query[J].ChineseBulletinofLifeSciences,2014,26(2):118.
[3] WHITTALL J B,HODGES S A.POLLINATO R.shifts drive increasingly long nectar spurs in columbine flowers[J].Nature,2007,447:706.
[4] PAUW A,STOFBERG J,WATERMAN R J.Flies and flowers in Darwin’s race evolution[J].Evolution,2009,63(1):268.
[5] JOHNSON S D,RAGUSO R A.The long-tongued hawkmoth pollinator niche for native and invasive plants in Africa[J].AnnalsofBotany,2016,117(1):25.
[6] PAUDEL B R,SHRESTHA M,BURD M,et al.Coevolutionary elaboration of pollination-related traits in an alpine ginger(Roscoeapurpurea) and a tabanid fly in the Nepalese Himalayas[J].NewPhytologist,2016,211(4):1402.
[7] GALEN C.Why do flowers vary?[J].Bioscience,1999,49(8):631.
[8] STRAUSS S Y,WHITTALL J B.Non-pollinator agents of selection on floral traits[J].EcologyandEvolutionofFlowers,2006,1439:120.
[9] CARIVEAU D,IRWIN R E,BRODY A K,et al.Direct and indirect effects of pollinators and seed predators to selection on plant and floral traits[J].Oikos,2004,104(1):15.
[10] ZHANG C,IRWIN R E,WANG Y,et al.Selective seed abortion induced by nectar robbing in the selfing plantComastomapulmonarium.[J].NewPhytologist,2011,192(1):249.
[11] HASE A V,COWLING R M,ELLIS A G.Petal movement in cape wildflowers protects pollen from exposure to moisture[J].PlantEcology,2006,184(1):75.
[12] ZHANG C,YANG Y P,DUAN Y W,et al.Pollen sensitivity to ultraviolet-B(UV-B) suggests floral structure evolution in alpine plants[J].ScienceFoundationinChina,2015,4(2):43.
[13] 侯勤正,任昱兰,文静,等.灌木铁线莲繁育系统特征及其花下垂现象的适应性意义[J].西北植物学报,2016,36(11):2283.
[14] 杨春锋,郭友好.被子植物花部进化:传粉选择作用的客观评价[J].科学通报,2005,50(23):2575.
[15] SHI G S,CHI Y Y.Increased seed set in down slope-facing flowers ofLiliumduchartrei[J].JournalofSystematicsandEvolution,2013,51(4):405.
[16] AYLOR D E.Survival of maize(Zea mays) pollen exposed in the atmosphere[J].AgriculturalandForestMeteorology,2004,123(3):125.
[17] MAO Y Y,HUANG S Q.Pollen resistance to water in 80 angiosperm species:flower structures protect rain-susceptible pollen[J].NewPhytologist,2009,183(3):892.
[18] WANG Y,MENG L L,YANG Y P,et al.Change in floral orientation inAnisodusluridus(Solanaceae) protects pollen grains and facilitates development of fertilized ovules[J].AmericanJournalofBotany,2010,97(10):1618.
[19] WANG W T,LI L Q.A revision ofClematissect.Fruticella(Ranunculaceae)[J].JournalofSystematicsandEvolution,2005,42(4):97.
[20] 孙光闻.甘青铁线莲[J].花木盆景:花卉园艺,2015(5):2.
[21] 彭德力,张志强,牛洋,等.高山植物繁殖策略的研究进展[J].生物多样性,2012,20(3):286.
[22] ARROYO M T K,ARMESTO J J,PRIMACK R B.Community studies in pollination ecology in the high temperate Andes of central Chile II.effect of temperature on visitation rates and pollination possibilities[J].PlantSystematicsandEvolution,1985,149(3-4):187.
[23] BYNUM M R,SMITH W K.Floral movements in response to thunderstorms improve reproductive effort in the alpine speciesGentianaalgida(Gentianaceae)[J].AmericanJournalofBotany,2001,88(6):1088.
[24] HUANG S Q,TAKAHASHI Y,DAFNI A.Why does the flower stalk ofPulsatillacernua(Ranunculaceae) bend during anthesis?[J].AmericanJournalofBotany,2002,89(10):1599.
[25] NORGATE M,BOYDGERNY S,SIMONOV V,et al.Ambient temperature influences australian native stingless Bee(Trigonacarbonaria) preference for warm nectar[J].PlosOne,2010,5(8):e12000.
[26] MELNDEZ-ACKERMAN E,CAMPBELL D R,WASER N M.Hummingbird behavior and mechanisms of selection on flower color inIpomopsis[J].Ecology,1997,78(8):2532.
[27] SUN S G,YAO C Y.Increased seed set in down slope-facing flowers ofLiliumduchartrei[J].JournalofSystematicsandEvolution,2013,51(4):405.
[28] WANG H,TIE S,YU D,et al.Change of floral orientation within an inflorescence affects pollinator behavior and pollination efficiency in a bee-pollinated plant,Corydalis sheareri[J].PlosOne,2014,9(4):e95381.
[29] LEWONTIN R C.Adaptation[J].ScientificAmerican,1978,239(3):212.
