ACTN4基因184T>A突变与儿童局灶节段性肾小球硬化的关系
2018-01-25柳春艳吕慧妍孙敏贾玲李锦玉安晓霞郝丽荣
柳春艳 吕慧妍 孙敏 贾玲 李锦玉 安晓霞 郝丽荣
原发性局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)是儿童激素抵抗性肾病综合征的常见原因,病理特征为部分毛细血管袢小叶非炎症硬化、足突融合消失。足细胞凋亡、脱落及上皮间质转分化是发病的初始环节[1-2]。辅肌动蛋白4(α-actinin-4,ACTN4)由ACTN-4基因编码的细胞骨架蛋白,有助于将肌动蛋白锚定至黏着斑以维持足细胞正常结构和功能[3-4],而ACTN-4基因突变导致足细胞机械特性改变和骨架结构破坏而引起足细胞减少及肾小球硬化[1]。研究发现ACTN基因同义突变465C>T[5]及杂合突变Y265H[6]可引起国外儿童原发性FSGS,但中国儿童FSGS与ACTN-4基因突变的研究较少,仅个别报道1-34C>T变异引起散发儿童FSGS[7],我中心前期检测到成年FSGS患者第2外显子区杂合错义突变184T>A(Ser62Thr),但该患者无后代,尚不明确此突变是否可引起儿童FSGS,因此,本研究拟明确ACTN4基因184T>A突变与儿童原发性FSGS的关系及发生率,并寻找新致病突变。
1 资料与方法
1.1 一般资料
收集2014年3月-2016年7月于黑龙江省医院肾内科及儿科住院并经肾活检病理检查确诊为儿童FSGS患者50例,男性29例,女性21例;年龄6~18岁,平均年龄为(11.64±3.78)岁;除外糖尿病、肥胖、系统性红斑狼疮、HIV感染、海洛因、药物、反流性肾病、孤立肾、肾切除等引起的继发性FSGS和其他继发性肾脏病;详细家族史调查,确保无肾病家族史。同时期选取于本院进行疫苗接种的尿常规正常、无肾病家族史的40例健康儿童作为对照组,其中男性23例,女性17例,平均年龄为(11.68±3.50)岁。本研究已获本院伦理委员会批准,所有受试者签署知情同意书。
1.2 方法
1.2.1 外周血细胞基因组DNA提取 采集患者及健康对照组成员的外周血样3~5 ml,EDTA抗凝,DNA提取试剂盒和蛋白酶-盐析法提取血白细胞DNA,DNA用氯酚法从头发毛囊提取。
1.2.2 引物设计 ACTN4基因序列来自于GenBank(U48734),第2外显子区引物自行设计,正向引物5'→3':AGTTTCCTCACATCTGCCTCC,反向引物5'→3':GTGGTCCTGGTTATCTACG。
1.2.3 PCR反应体系和条件 (1)反应体系为50 μl:10xPCR缓冲液 5 μl,MgCl2(25mmol/L)5 μl,La-TaqDNA 聚合酶(5 U/μl)0.5 μl,5 pmol/L的上、下游引物各1 μl,模板DNA1 μl,dNTP混合液(各10 mmol/L)1 μl; (2)反应条件:95℃预变性3 min,94℃变性30 s,55~60℃退火35 s,72℃延伸40~50 s,35个循环,72℃延伸5~8 min。
1.2.4 PCR产物鉴定 取1 μl产物加入5 μl 6×Loading buffer混匀后取5 μl加入1%琼脂糖凝胶电泳20 min(电压150 V),紫外灯下比较产物条带和DNA marker,确定PCR产物长度正确。
1.2.5 PCR产物纯化与测序 PCR产物纯化回收试剂盒(生工生物工程(上海)股份有限公司,货号SK1141)收集纯化PCR产物,用BIG dye terminator测序试剂盒、ET-terminator测序试剂盒和美国ABI 3730XL自动测序仪(美国Applied Biosystem)测序,采取重复和双向测序的方法,保证结果准确可靠。
1.2.6 碱基序列对比及SNP数据库搜寻 应用SeqMan软件将测序输出序列与模版序列比对,明确184T>A突变是否存在;同时寻找其他碱基变异位点,通过Chromas软件人工读序列图进行核实。发现碱基变异后查找SNP数据库确认是否为单核苷酸多态性。
2 结果
2.1 ACTN4基因的非同义突变
1名FSGS患者2号外显子区检测到杂合错义突变184T>A(图1),引起辅肌动蛋白4的第62位氨基酸由丝氨酸突变为苏氨酸(Ser62Thr);进一步检测患儿父母DNA,未发现上述突变。其余FSGS患者及健康对照组未检测到此突变,也未检测到其他突变。FSGS患者中184T>A(Ser62Thr)突变发生率为2.00%。
184T>A突变者情况:女,16岁,因“双下肢水肿半年,加重一周”入院。入院后检查:双下肢中度对称性凹陷性水肿,血压132/88 mmHg,尿常规显示:尿蛋白3+,尿红细胞3+,尿红细胞129.77/HPF;24 h尿总蛋白定量3.14 g,血白蛋白23.7 g/L,血胆固醇6.92 mmol/L,血甘油三酯2.64 mmol/L,血肌酐为123.6 μmol/L。免疫学指标均正常。肾活检光镜结果见图2:共12个肾小球,2个硬化肾小球,多个肾小球球囊粘连致节段性硬化,系膜细胞局灶节段性增殖,系膜基质轻度增多,系膜区轻度增宽。灶性肾小管萎缩,管腔狭窄,管腔内可见蛋白管型,重度肾间质病变,肾间质灶性增宽,灶性纤维化,可见灶性炎细胞浸润,以单核细胞为主,动脉壁轻度增厚。免疫荧光IgG染色阴性(见图2④),其余IgA、IgM、IgE、C4、C1q、HBsAg、HBcAg、HCV均阴性。电镜符合FSGS表现。因此诊断为原发性FSGS。患者对激素治疗反应较差,肾功能减退进展快,一年后再次入院已需透析治疗。肾穿刺活检病理学检查结果见图2。

图1 ACTN4基因第2外显子区杂合突变 184T>A测序结果

图2 ACTN4基因184T>A突变患者光镜检查结果
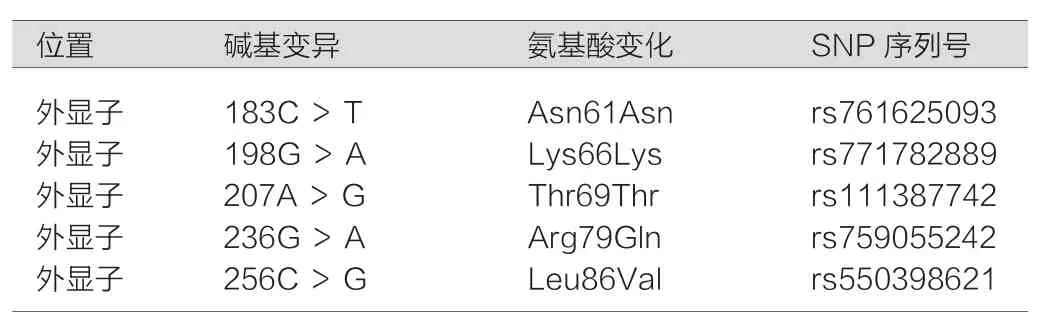
表1 ACTN4的单核苷酸多肽
2.2 单核苷酸多态(single nucleotide polymorphism,SNP)
50例FSGS患者共发现5种碱基变异,全部位于2号外显子,查询SNP数据库后证实均为SNP,其中rs759055242引起编码氨基酸由精氨酸变为谷氨酰胺,rs550398621引起编码氨基酸由亮氨酸变为缬氨酸,具体情况见表1。
3 讨论
FSGS是临床常见的原发性肾小球疾病之一,国外研究显示,FSGS占美国儿童NS的20%,肾活检比例的12.2%~18.7%;而国内研究显示,FSGS约占儿童终末期肾脏病的20%,占所有原发性肾小球病的3.4%~6.6%。FSGS的临床表现主要是大量蛋白尿,甚至呈肾病综合征,约1/3患者发病早期即表现为高血压,肾功不全。FSGS自发缓解率低,对激素及免疫抑制治疗反应较差,若不能正确诊治,超过50%的患者会在3~8年内进展至终末期肾脏病[8]。
FSGS按病因分为原发性FSGS、继发性FSGS、家族性FSGS,确切的发病机制不明,病理变化以部分肾小球部分毛细血管襻小叶的非炎症性硬化伴足突融合为特征,其中足细胞参与构成肾小球滤过屏障,而肌动蛋白参与组成足细胞骨架结构,负责维持足突结构和功能稳定,因此肌动蛋白异常将直接影响足细胞的生理功能,导致肾小球滤过屏障损伤,导致大量蛋白尿等NS表现。
ACTN4基因编码的α-actinin-4属于血影蛋白家族,广泛表达于足突及心肺等组织中[9],该蛋白能交联肌动蛋白微丝,参与调节细胞形态、稳定细胞黏附及介导细胞迁移和运动,是众多足细胞骨架蛋白中较重要的一种[1]。最初Kaplan等[3]通过研究常染色体显性遗传家族性FSGS患者发现ACTN4基因第8外显子区突变可导致FSGS,尽管这些突变不能引起α-actinin-4保守区变化,但已有报道[5]证实其致病作用。随后Weins[9]和王朝晖[10]等发现突变体 W59R、V801M、I149del、S262P、R348Q、K255E、R837Q、T259I、L316P等与FSGS相关。大多数ACTN4基因突变引起FSGS的机制是α-actinin-4与足细胞的丝状肌动蛋白结合增多[11],只有L316P突变型与丝状肌动蛋白结合减少,两种蛋白结合异常会干扰丝状肌动蛋白聚合和解聚,从而破坏细胞骨架、影响足细胞迁移[12],此外突变的α-actinin-4聚集于细胞膜和细胞核周围,形成微聚体,经过泛素化而损伤泛素-蛋白酶体系统,诱导内质网应激增强,加速细胞的凋亡[1,12]。
ACTN4基因位于19q13,包含21个外显子,既往研究[3,9,10]发现的致病突变位于第8外显子区及第10外显子区,且研究对象为成年家族性FSGS患者,仅有少数文献报道ACTN4的Y265H突变[6]和1-34C>T变异[7]引起原发性儿童FSGS。鉴于我课题组前期研究发现第2外显子区杂合错义突变184T>A(Ser62Thr)可引起成年原发性FSGS,且尚无研究报道ACTN4第2外显子区突变和儿童原发性FSGS的关系,因此收集儿童患者来研究184T>A基因突变与原发性FSGS的关系及其发生率十分必要。
我课题组对50例儿童原发性FSGS患者及40名健康儿童的ACTN4基因第2外显子区进行PCR扩增后做基因测序,结果发现1例携带杂合突变184T>A的患者,引起编码蛋白α-actinin-4的62位氨基酸从丝氨酸变为苏氨酸,进一步检测其父母DNA未检测到相同突变,推测可能是环境因素引起ACTN4基因在生殖细胞或者胚胎时期发生突变,变异的α-actinin-4与丝状肌动蛋白结合增多导致足细胞结构功能异常而引起FSGS。
需要注意的是,本例具有184T>A突变的16岁女患,一年后再次入院时已进入尿毒症期,需要透析治疗,与Feng D等[4]报道的携带Y265H 突变儿童肾功恶化快的临床表现类似,而与Kaplan[3]和Weins[9]报道的ACTN4基因突变介导的FSGS多数发病较晚,以成人多见且病情缓慢进展不同。184T>A突变和文献报道的另外两种突变即W59R 和S262F[9,13]共同提示,ACTN4基因突变介导的FSGS并非都有相似的发病年龄和病程。此外,由于本研究未对ACTN4基因的其他外显子区进行测序,可能导致实际引起原发性FSGS的致病突变被忽略,未来可继续进行全外显子检测以发现ACTN4基因的新致病突变。此外,本研究的样本量有限,可能导致ACTN4基因突变率计算存在误差和偏倚。本研究同时发现5种碱基变异,均位于外显子区,经过与SNP数据库比对后证实为已知SNP。
综上,50例儿童原发性FSGS患者中仅1例存在ACTN4基因突变184T>A,该突变发生率较低,不是引起本中心儿童原发性FSGS的常见突变。
[1]Cybulsky AV,Kennedy CRJ.Podocyte Injury Associated with Mutant α-Actinin-4[J].J Signal Transduct,2011(2011):563128.
[2]de Mik SM,Hoogduijn MJ,de Bruin RW,et al.Pathophysiology and treatment of focal segmental glomerulosclerosis: the role of animal models[J].BMC Nephrol,2013,14(1):1-10
[3]Kaplan JM,Kim SH,North KN,et al.Mutations in ACTN4,encoding alpha-actinin-4, cause familialfocal segmental glomerulosclerosis[J].Nat Genet,2000,24(24):251-256.
[4]Feng D,Steinke J M,Krishnan R,et al.Functional validation of an alpha-actinin-4 mutation as a potential cause of an aggressive presentation of adolescent focal segmental glomerulosclerosis:Implications for genetic testing[J].Plos One,2016,11(12):e0167467
[5]Komatsuda A,Wakui H,Maki N,et al.Analysis of mutations in alpha-actinin-4 and podocin genes of patients with chronic renal failure due to sporadic focal segmental glomerulosclerosis[J].Ren Fail,2003,25(1):87-93.
[6]Feng D,Krishnan R,Steinke J,et al.Functional implications of a novel point-mutation at an ACTN4 phosphorylation site[J].Faseb J,2015,29(Suppl 1):LB732.
[7]戴胜川,王朝晖,潘晓霞,等.原发性局灶节段性肾小球硬化患者 ACTN4 基因变异和多态性 [J].中华肾脏病杂志,2008,24(2):108-114.
[8]Tang X,Xu F,Chen DM,et al.The clinical course and longterm outcome of primary focal segmental glomerulosclerosis in Chinese adults[J].Clin Nephrol,2013,80(2):130-139.
[9]Weins A,Kenlan P,Herbert S,et al.Mutational and biological analysis of alpha-actinin-4 in focal segmental glomerulosclerosis[J].J Am Soc Nephrol,2005,16(12):3694-3701.
[10]王朝晖,马骏,朱斌,等.19例家族性局灶节段性肾小球硬化的临床研究[J].肾脏病与透析肾移植杂志,2009,18(1):35-38.
[11]Michaud JL,Chaisson KM,Parks RJ,et al.FSGS-associated α-actinin-4 (K256E) impairs cytoskeletal dynamics in podocytes[J].Kidney Int,2006,70(6):1054-1061.
[12]王倩,刘茂东,赵建月,等.家族性局灶节段性肾小球硬化致病基因的研究进展[J].临床肾脏病杂志,2015,15(6):379-382.
[13]Choi HJ,Lee BH,Cho HY,et al.Familial focal segmental glomerulosclerosis associated with an ACTN4 mutation and paternal germline mosaicism[J].Am J Kidney Dis,2008,51(5):834-838.
