水杨酸盐对大鼠听觉中枢代谢功能影响的研究△
2018-01-25易彬鲍伟奇石润杰左传涛吴聪黄治物吴皓
易彬 鲍伟奇 石润杰 左传涛 吴聪 黄治物 吴皓
水杨酸盐是一种临床上常用的非甾体类解热镇痛药物,最常见的副作用为耳毒性和胃肠道反应等。以往研究发现水杨酸类药物除了直接对耳蜗产生影响外,也能穿越血脑屏障直接影响中枢系统[1~3]。
有关耳鸣产生机制的假设有许多种,随着科学的进展,越来越多的研究聚焦于耳鸣的中枢化机制[4, 5]。听觉通路上任一部分(耳蜗、听神经及听觉中枢等)的损伤和异常都可能成为耳鸣的诱因;中枢可塑性是指中枢为了主动适应和反应外界环境各种变化,神经系统发生结构和功能的改变,并维持一定时间的能力;中枢神经系统在耳鸣形成和发展的整个过程中,通过自身的可塑性不断地产生各种改变[6, 7]。之前许多学者以正电子发射断层显像/X线计算机体层成像(PET/CT)为研究手段,发现了一系列耳鸣状态下中枢神经系统代谢改变的影像学结果[4, 8, 9],显示了微型PET/CT(micro positron emission computed tomography,microPET/CT)在耳鸣中枢研究中的前景。为此,本研究拟通过对大鼠进行水杨酸钠腹腔注射建立耳鸣模型,以听觉惊跳反射间隔前刺激抑制实验(gap-prepulse inhibition of the acoustic startle reflex,GPIAS)检测耳鸣样行为,再运用microPET/CT观察耳鸣大鼠相关脑区的大脑功能活动状况,为探讨耳鸣的产生机制提供依据。
1 材料与方法
1.1实验动物分组及给药方法 8周龄SPF 级的健康雄性SD大鼠(购自上海斯莱克实验动物有限公司)24只,体重180~300 g,耳廓反射阳性,无强噪声暴露及耳毒性药物应用史,适应性喂养1周后,随机分为4组,每组6只,分别为:正常对照组(等量生理盐水腹腔注射);急性注射组(400 mg/kg水杨酸钠腹腔单次注射);慢性注射组(200 mg/kg水杨酸钠腹腔注射,每天两次,间隔大于8小时,持续14天);慢性恢复组(水杨酸钠注射方法与C组相同,14天注射完毕后停止,继续常规饲养14天作为恢复期)。水杨酸钠购于上海Sigma-Aldrich公司,以生理盐水溶解为100 g/L溶液。
1.2研究方法 急性注射组在注射两小时后、慢性注射组在第15天上午(离最后一次注射间隔大于8小时)、慢性恢复组在停止注射后第15天上午分别进行GPIAS检测和microPET/CT检测,正常对照组直接按流程进行检测。检测前所有大鼠均禁食8小时。
1.2.1听觉惊跳反射间隔前刺激抑制实验 GPIAS检测在噪声屏蔽良好的房间(声压级≤25 dB A)内进行。大鼠在实验时先置于透明有孔洞的树脂玻璃制动物固定装置内以限制其活动,然后放入载有敏感压电转换器的隔音箱内(MED-ASR-PRO1, 美国MED公司);声刺激信号由TDT(RZ6,美国Tucker Davis Technologies公司)产生,通过悬挂在固定器侧方10 cm的高频喇叭传出。当动物发生惊跳反射后,身体的重力改变会通过压电传感器传入系统,产生相应波形并自动记录和计算峰值。GPIAS实验中不同时程的间隙空白插在刺激噪声前100 ms,刺激噪声为100 dB SPL的白噪声,上升/下降时间5 ms,持续时间50 ms,背景噪声为65 dB SPL的3个不同频率(6、12、16 kHz)纯音。实验间隔为30~35 s,避免前面刺激产生的不应期影响动物对后面刺激的反应;无间隙空白的实验与上述顺序一样,间隙空白设为0 ms;每只大鼠实验时间约为30 min。GPIAS主要检测指标是前刺激抑制率(%),表示听觉惊跳反射间隔前刺激对惊跳反射的抑制程度,公式为GPIAS% =(1-gap/no gap)× 100%,其中gap表示有间隙空白作为前刺激时诱发的波幅,no gap表示没有空白仅有惊跳刺激时所诱发的波幅。
1.2.2microPET/CT扫描 应用小动物专用PET设备Inveon MM micro-PET/CT scanner (Siemens公司)进行microPET/CT扫描。PET/CT显像剂;氟化脱氧葡萄糖(18F-FDG)由复旦大学附属华山医院PET中心制备。大鼠以异氟烷麻醉,尾静脉注射18F-FDG溶液,放置于PET/CT系统中,注射完毕后45 min行microPET/CT扫描(约20分钟)。实验过程中注意记录大鼠的体重以及注射器内的放射性剂量(在注射前后均进行测量),并记录测量时间。
1.2.3microPET/CT数据采集及分析 对于microPET全身衰减校正图像,采用OSEM3D/MAP算法根据CT图像进行相应校正勾画。先使用自动匹配的刚性融合,必要时进行手工调整。每只大鼠的图像应用PMOD 3.4(PMOD Technology, Switzerland)软件进行图像分析并自动标准化,以和模板一致。应用Schiffer图集[10]覆盖标准化的CT图像以获取模板内58个脑区的18F-FDG平均标准摄取值(mean standardized uptake values,mean SUV),计算公式:SUV=[组织放射性浓度(kBq/cc)×体重(g)/ 有效注射放射性剂量(kBq)]。
采集下丘及听皮层作为听觉中枢区域,小脑作为非听觉中枢的对照区域,共3个脑区作为感兴趣区(regions-of-interest, ROIs),取双侧平均值,电脑自动显示全脑(globe)平均SUV值,最终算出各脑区与全脑SUV比值以进行统计分析。
1.3统计学方法 根据数据分布和方差齐性检验,采用SPSS 18.0软件(美国IBM公司)进行独立样本Student’st检验,行单因素方差分析及Student-Newman-Keuls(SNK)事后检验;若方差不齐,则取Log10后进行比较。P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠听觉惊跳反射前抑制试验结果 与正常对照组相比,慢性注射组GPIAS值在12和16 kHz明显下降,差异有统计学意义(P<0.05),提示该组大鼠出现耳鸣样行为,造模成功;急性注射组和慢性恢复组的所有频率GPIAS值差异均无统计学意义(P>0.05),说明单次注射水杨酸盐未诱发大鼠耳鸣样行为,且耳鸣样行为在停止水杨酸钠注射14天后消失(表1)。

表1 四组大鼠不同频率背景声下的GPIAS值±s)
注:与正常对照组比较,*P<0.05
2.2各组大鼠18F-FDG microPET/CT成像结果 四组的全脑区平均SUV值比较显示,与正常对照组比较,急性注射组全脑区SUV值显著升高(P<0.01),慢性注射组轻微升高,慢性恢复组轻微降低,但差异均无统计学意义(P>0.05)。提示急性注射组呈现全脑代谢活跃状态,而其他三组未出现显著变化(表2,图1)。
各脑区SUV与全脑SUV比值中,与正常对照组比较,慢性注射组下丘及听皮层与全脑SUV比值明显升高(P<0.01),提示该组大鼠这两个脑区神经活跃度升高;小脑的比值则差异无统计学意义(P>0.05)。急性注射组的听皮层脑区比值相对升高(P<0.01),说明该组大鼠听皮层神经活跃度升高;下丘和小脑比值无明显升高(P>0.05);慢性恢复组全脑区SUV值或各脑区与全脑区SUV值比值与对照组差异无统计学意义(表2,图1)。
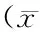
表2 四组大鼠全脑平均SUV值及各脑区与全脑SUV比值±s)
注:与正常对照组相比较,**P<0.01
3 讨论
耳鸣的发生和发展都十分复杂,至今成因都不明确[6, 11~15],因此,找到其病因并进行对症治疗非常值得研究。通常认为耳鸣是外周病变和中枢病变共同作用的结果,耳鸣一般由耳蜗病变所引发,外周的异常传入或者听力损失都可引起听觉通路上的神经活动性改变[16],包括从耳蜗、听神经到最高级别的听觉皮层中的每个部位;外周有耳鸣产生的基础,中枢加重、放大了触发因素的后续影响,甚至单纯的中枢病变也可能产生耳鸣[3~6,17]。外周异常信号输入后,听觉中枢原本的稳态被打破,进而引起大脑兴奋性和抑制性的失衡,中枢在自我维稳中不断产生可塑性变化以达到新的平衡,抑制性降低和/或兴奋性增强进一步导致中枢听觉相关区域活动性的改变(主要是增强),从而感知到持续的耳鸣[4, 18~22]。尽管对耳鸣的发生机制已经进行了大量的研究,但已有的理论机制尚不能解释所有的耳鸣现象,显然还不够全面和完善,需要从其他新的角度和途径去研究耳鸣。
水杨酸盐是应用最为广泛的建立耳鸣动物模型的药物之一[17~19, 23, 24 ]。临床上服用水杨酸盐类药物的患者耳鸣和/或听力下降的程度在开始服药的最初几天会逐渐增加,随后平稳、波动或衰减,停药后几天内通常会消失[18],提示其导致的耳鸣和听力下降是可逆的。目前常用动物行为学方法检测水杨酸注射建立耳鸣动物模型是否成功[25]。从本研究结果看,反复多次的慢性水杨酸钠注射组大鼠产生了耳鸣样行为,说明耳鸣动物造模成功。
作为动物模型研究的新手段,microPET/CT的空间分辨率相较于PET/CT大大提高,可用于定量检测大鼠脑中各主要结构的代谢速度,也可用于半定量研究大鼠脑可塑性和脑激活。文中结果显示,单次注射水杨酸钠后2小时,急性注射组大鼠全脑都出现了活跃状态,而三个脑区中仅听皮层出现了相对性活跃,提示这可能是动物的应激状态或者是药物对于听觉系统的急性作用造成的。经过14天反复多次注射水杨酸钠后,在药物代谢8小时后再对大鼠进行microPET/CT检测,可见慢性注射组虽然全脑整体活跃度(全脑平均SUV值)略微上升(与对照组比较,P>0.05),但是非听觉中枢区域的小脑活跃度并没有变化,听觉中枢的下丘和听皮层却都出现了相对性的代谢率上升,提示这两个脑区相较于正常大鼠已经形成新的活跃状态;这与该组耳鸣行为学检测结果相吻合。在近几年的耳鸣动物microPET研究中,Paul等[19]应用水杨酸盐(250 mg/kg)2天发现耳鸣大鼠下丘及听皮层葡萄糖摄取率升高,而丘脑区域有所升高但未到达显著差异;Wallhausser-Franke等[26]发现,耳鸣沙鼠除了听皮层的神经活跃度上升外,包括下丘及外侧丘系在内的其他皮层神经活跃性都是下降的,与本研究结果有所差异。这两项研究的耳鸣动物模型与本研究的实验动物、水杨酸盐使用方法和放射性核素种类都存在差异,这些都可能造成结果不同,尚需要进一步的实验来研究[4, 19, 26];但是,大部分以耳鸣患者为研究对象的临床PET研究支持听觉相关脑区神经活跃度升高[4],因此推断,在中枢可塑性的引导下,听觉中枢脑区的功能逐渐发生了相应变化,其活跃度上升导致了持续耳鸣。

图1 各组大鼠18F-FDGmicroPET/CT显像图片 注:左起一、二列为microPET显像的反式轴状位的下丘及听皮层图像,第三列为mi-croPET显像的矢状位小脑脑区图像,第四列为microPT和CT显像融合后的冠状位图像。
综上所述,慢性注射水杨酸盐可使大鼠产生耳鸣,且耳鸣大鼠下丘、听皮层的葡萄糖代谢率上升,提示在中枢可塑性的作用下,中枢听觉系统部分脑区呈现神经活跃度升高的状态,但是水杨酸盐诱发耳鸣的完整机制及其他相关脑区的状态、相互关系,需要更进一步的研究去揭示。
1 Campbell S,Macqueen G.The role of the hippocampus in the pathophysiology of major depression[J]. J Psychiatry Neurosci, 2004, 29: 417.
2 Hu SS,Mei L,Chen JY, et al. Effects of salicylate on the inflammatory genes expression and synaptic ultrastructure in the cochlear nucleus of rats[J]. Inflammation, 2014, 37: 365.
3 Hu SS,Mei L,Chen JY, et al. Expression of immediate-early genes in the dorsal cochlear nucleus in salicylate-induced tinnitus[J]. Eur Arch Otorhinolaryngol,2016,273:325.
4 Elgoyhen AB,Langguth B,De Ridder D, et al. Tinnitus: perspectives from human neuroimaging[J]. Nat Rev Neurosci, 2015, 16: 632.
5 胡守森,黄治物,吴皓,等. 水杨酸盐诱发大鼠听皮层中Egr-1基因表达的改变[J]. 听力学及言语疾病杂志, 2012, 20:561.
6 黄治物,吴皓.耳鸣中枢化机制与临床诊疗[J]. 临床耳鼻咽喉头颈外科杂志, 2014, 28: 222.
7 Hu SS,Mei L,Chen JY, et al. Expression of immediate-early genes in the inferior colliculus and auditory cortex in salicylate-induced tinnitus in rat[J]. Eur J Histochem, 2014, 58: 2294.
8 Lockwood AH,Wack DS,Burkard RF, et al. The functional anatomy of gaze-evoked tinnitus and sustained lateral gaze[J]. Neurology, 2001, 56: 472.
9 Langguth B,Eichhammer P,Kreutzer A, et al. The impact of auditory cortex activity on characterizing and treating patients with chronic tinnitus-first results from a PET study[J]. Acta Otolaryngol(Suppl),2006,556:84.
10 Schiffer WK,Mirrione MM,Biegon A, et al. Serial microPET measures of the metabolic reaction to a microdialysis probe implant[J]. J Neurosci Methods, 2006, 155: 272.
11 Baguley D,McFerran D,Hall D. Tinnitus[J]. Lancet, 2013, 382: 1600.
12 Langguth B,Kreuzer PM,Kleinjung T, et al. Tinnitus: causes and clinical management[J]. Lancet Neurol, 2013, 12: 920.
13 Eggermont JJ. The auditory cortex and tinnitus - a review of animal and human studies[J]. Eur J Neurosci, 2015, 41: 665.
14 王洪田,黄治物,李明,等.耳鸣诊治基本原则与耳鸣习服疗法[J]. 听力学及言语疾病杂志, 2007, 15: 346.
15 盛海斌,黄治物,吴皓.耳蜗突触病变和隐性听力损失 [J]. 听力学及言语疾病杂志, 2016, 24: 614.
16 Norena AJ,Eggermont J. Enriched acoustic environment after noise trauma reduces hearing loss and prevents cortical map reorganization[J]. J Neurosci, 2005, 25: 699.
17 Chen GD,Stolzberg D,Lobarinas E, et al. Salicylate-induced cochlear impairments, cortical hyperactivity and re-tuning, and tinnitus[J]. Hear Res, 2013, 295: 100.
18 Cazals Y, Auditory sensori-neural alterations induced by salicylate[J]. Prog Neurobiol, 2000, 62: 583.
19 Paul AK,Lobarinas E,Simmons R, et al. Metabolic imaging of rat brain during pharmacologically-induced tinnitus[J]. Neuroimage, 2009, 44: 312.
20 Roberts LE,Eggermont JJ,Caspary DM, et al. Ringing ears: the neuroscience of tinnitus[J]. J Neurosci, 2010, 30: 14972.
21 Schecklmann M,Landgrebe M,Poeppl TB, et al. Neural correlates of tinnitus duration and distress: a positron emission tomography study[J]. Hum Brain Mapp, 2013, 34: 233.
22 Huang ZW,Luo Y,Wu Z, et al. Paradoxical enhancement of active cochlear mechanics in long-term administration of salicylate[J]. J Neurophysiol, 2005, 93: 2053.
23 Jin Y,Luo B,Su YY, et al. Sodium salicylate suppresses GABAergic inhibitory activity in neurons of rodent dorsal raphe nucleus[J]. PLoS One, 2015, 10:e0126956.
24 Cazals Y,Horner KC,Huang ZW.Alterations in average spectrum of cochleoneural activity by long-term salicylate treatment in the guinea pig: a plausible index of tinnitus[J]. J Neurophysiol, 1998, 80: 2113.
25 Lobarinas E,Hayes SH,Allman BL. The gap-startle paradigm for tinnitus screening in animal models: limitations and optimization[J]. Hear Res, 2013, 295: 150.
26 Wallhausser-Franke E,Braun S,Langner G.Salicylate alters 2-DG uptake in the auditory system: a model for tinnitus?[J]. Neuroreport, 1996, 7:1585.
