慢性睡眠剥夺和高脂饮食与咽喉反流性疾病相关性的实验研究
2018-01-25张晨彬李木张延平李丽娜蒋兴旺宋徽潘耀郭彦谷冯勃
张晨彬 李木 张延平 李丽娜 蒋兴旺 宋徽 潘耀 郭彦谷 冯勃
咽喉反流性疾病(laryngopharyngeal reflux disease, LPRD)是指胃内容物,包括胃酸、胃蛋白酶、胆汁酸、胰酶等,反流至食管上括约肌以上部位,引起咽喉部组织损伤,导致一系列症状和体征的总称[1],主要表现为咽异物感、咳嗽、多痰、声嘶等症状。近年来LPRD的发病率明显增加,Altman等[2]发现1990年至2001年间因LPRD就诊于耳鼻喉科的人次增加了500%,并提示LPRD的发病与人们的生活方式存在一定的相关性。研究提示慢性睡眠剥夺和高脂饮食可能与LPRD的发生存在一定的相关性[3,4]。为此,本研究模拟多数LPRD患者的生活习惯,将大鼠同时给予慢性睡眠剥夺和高脂饮食饲养后监测其咽部及食管pH值的变化,探讨慢性睡眠剥夺和高脂饮食与LPRD发生的相关性。
1 材料与方法
1.1实验动物及分组 选择成年雄性健康8周龄SD大鼠16只(购自维通利华动物有限公司,北京)体重250~350克。按照随机数字法分为实验组和对照组,每组8只,实验组大鼠给予睡眠剥夺加高脂饲料喂养,对照组普通喂养, 连续喂养2个月。所有动物饲养于自动控制明暗环境中,恒温恒湿,自由获食和饮水,大鼠在动物房适应环境 3 天后开始实验。所有实验动物的处理协议遵守严格的批准程序,由解放军309医院动物伦理委员会批准以及与国家实验动物使用指南一致。
1.2LPRD动物模型的建立 实验组采用改良多平台水平面法建立大鼠慢性睡眠剥夺模型[5]。制作30 cm×30 cm×30 cm 鼠箱,其中有4个高8.0 cm、直径6.3 cm的圆形平台,在平台周边注满水,水面低于平台面约1.0 cm,水温保持在20 ℃,大鼠在平台上可以自由进食、饮水,但不可睡眠,若睡眠则肌肉松弛落入水中,只能爬上平台保持清醒状态,如此反复即形成睡眠剥夺。睡眠剥夺前两天训练大鼠爬上平台,水温可以在10 ℃左右, 低水温造成不适可以刺激大鼠爬上平台,并在平台上保持平衡,学会正常进食, 对于不能正常上台的大鼠进行手动帮助上台或及时剔除。实验开始后用鱼缸加热器保持水温在20 ℃,上午9点至下午5点将大鼠放入鼠箱中,完成每天8小时睡眠剥夺后将动物取出放回常规鼠笼中喂养,并对玻璃缸进行清理换水,如此反复2个月至实验结束(图1);实验期间使用智能网络摄像机监控大鼠,对于无法配合实验的动物及时剔除。对照组也置于同样的睡眠剥夺鼠箱内,但站立的平台直径为16 cm,大鼠在平台上可以自由睡眠。
图1 实验组大鼠慢性睡眠剥夺实验情况
在进行慢性睡眠剥夺造模的同时,实验组大鼠给予高脂饲料(北京华阜康生物科技股份有限公司生产,主要成分为酪蛋白、糊精、蔗糖、纤维素、豆油、猪油、多种矿物质、多种维生素、胆碱等,其中含蛋白26%、碳水化合物26%、脂肪35%),对照组给予普通大鼠维持饲料(北京华阜康生物科技股份有限公司生产,主要成分为大豆粕、鱼粉、植物油、麸皮、玉米、次粉、多种维生素和矿物质,其中粗蛋白≥18%、粗纤维≤5%、脂肪≥4%)。
1.3大鼠一般情况观察及双探头上消化道pH值监测 两月后测量每只大鼠的体重,观察毛发、生活状态、食欲行为、动物死亡情况,比较两组之间的差异;并使用HYW型上消化道pH值动态测试仪(北京长安汉德森电子有限公司)的双探头电极同时检测大鼠咽部及食管pH值。大鼠腹腔注射麻醉(1%戊巴比妥腹腔注射,首次麻醉每100 g体重使用0.4 ml麻醉剂,每小时腹腔追加注射首次剂量的1/4戊巴比妥维持麻醉)后,仰卧于手术台上,用橡皮筋套住上门齿来固定头部,用医用胶带固定四肢,胸部备皮,参考电极固定于胸骨柄中点,按照预实验数据,经口插入电极至距离门齿约9.5厘米处食管内,使远端传感器(pH1)位于食管中下段腔内,近端电极(pH2)放置于环状软骨下缘1厘米食管入口处,使食管粘膜包裹近端传感器探头,同时记录食管pH1探头检测值和咽部pH2探头检测值,共监测10小时。实验室温度设定为25 ℃,实验结束后,大鼠需单独放一个笼子中休息一天。
实验结束后将数据导入计算机,手工判读检测结果,需要满足以下条件方可认定为发生一次反流事件[6]:①pH值下降至<4,持续5秒以上;②咽喉部pH值的下降与食管内远端传感器pH值下降同时发生,或在其发生后立即出现,咽喉部pH最低值应大于食管远端处的pH最低值;③pH值下降不是在进食或吞咽时发生;④咽喉部感受器的pH值下降是快速的。剔除伪差后,使用pH值监测仪附带软件进行数据分析,记录10小时内pH值<4的总时间百分率(反流指数)、pH值<4的反流次数(次)和最长反流持续时间(min);将实际检测时间内检测到的数据换算成24小时数值[24小时总反流次数=(实际反流次数×24)÷实际检测时间],比较两组动物上述3项指标的差异。
1.4统计学方法 采用STATA 12.0统计软件对数据进行统计学分析,均采用双侧检验,P<0.05为差异有统计学意义。非正态分布定量资料的描述,计算中位数、最小值、最大值、下四分位数(Q1)、上四分位数(Q3),使用shapiro-wilk进行正态性检验,组间比较采用Wilcoxon秩和检验。
2 结果
2.1两组大鼠一般情况比较 实验组大鼠毛发光泽度下降,暴躁易怒,夜间撕扯打架,实验后较实验前体重增长50.63±19.72 g;对照组大鼠毛发光泽度正常,情绪稳定,实验后较实验前体重增长60.00±21.55 g,两组差异无统计学意义(P>0.05)。模型构建过程中无大鼠死亡。
2.2两组大鼠咽部及食管pH值监测结果 实验组大鼠咽部pH2探头检测显示反流指数、最长反流时间和24小时总反流次数均明显增多,均明显高于对照组(P<0.05),提示实验组大鼠出现了LPRD,典型的反流曲线见图2、图3;食管pH1探头监测显示反流指数和24小时总反流次数增多,均明显高于对照组(P<0.05),实验组最长反流时间比对照组延长,但差异无统计学意义(P>0.05)(表1)。
3 讨论
昼夜节律是自然界中普遍存在的一种自然现象,是机体为了更好地适应环境,在进化过程中自然选择作用下获得的。昼夜节律发生的物质基础是位于下丘脑的视交叉上核的生物钟,通过控制能量、生长、情绪和衰老来调节器官和活动以及休息的周期。消化系统与大脑之间存在双向调控网络联系,包括中枢神经系统、自主神经系统和肠神经系统,交感神经和副交感神经系统将中枢和消化系统紧密联系起来并形成一个动态反馈环路,通过此环路可以影响生物节律和睡眠调节通路,提示睡眠紊乱和消化系统生理变化之间存在相互联系。现代生活方式的改变使得人们昼夜节律被打乱,睡眠不足已经成为越来越广泛的问题,研究结果显示近1/3的成年人存在睡眠不足,65岁以上老人约有67%存在睡眠障碍,使部分人处于睡眠剥夺状态[7,8]。睡眠剥夺可以造成人的应激反应,使人处于一种兴奋状态,但是随着应激时间的延长、兴奋状态的持续,神经内分泌系统以及内环境都将发生变化,造成机体的生理和病理改变,对中枢神经系统、消化系统以及内分泌系统等都会产生影响。研究发现慢性睡眠剥夺导致大鼠胃排空速率明显降低,胃电活动呈紊乱状态,而胃排空延迟可能引发反流,提示睡眠缺乏可能与LPRD的发生有关[3]。此外细胞因子在调节睡眠和觉醒周期中起重要作用,国外研究提示睡眠缺乏可以活化白细胞介素(interleukin,IL)和肿瘤坏死因子(tumor necrosis factor,TNF),而IL-1、IL-6和TNF是控制胃食管反流病患者炎症反应的关键因素[9],被认为是反流性疾病的生物标志物[10],进一步提示睡眠缺乏与LPRD之间可能存在相关性。
脂肪的摄入量特别是胆固醇和饱和脂肪酸的摄入量与胃食管反流病的发生呈正相关[11],其发病机制可能是高脂饮食能延缓胃的排空,减缓胃内气体排人肠内的速度,而高脂食物又使食管下括约肌压力下降,增加一过性食管下括约肌松弛的发生机会,导致反流更易发生,进而诱发或加重气道功能的改变,引起咳嗽等LPRD症状[4],而且高脂饮食者多数合并肥胖和阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS),OSAS患者中有58.6%同时伴咽喉反流症状[12],因此高脂饮食可能也和LPRD发病密切相关。
本研究将大鼠同时给予慢性睡眠剥夺和高脂饮食2个月后观察大鼠咽部及食管pH值变化,结果显示,实验组大鼠咽部反流指数、最长反流时间及24小时总反流次数均明显高于正常对照组,可见连续反流的典型曲线,提示实验组发生了LPRD;而实验组食管下段pH电极记录到的结果提示除最长反流时间外,反流指数和24小时总反流次数也比对照组明显增高(P<0.05),提示睡眠剥夺和高脂饮食导致的LPRD不一定同时合并胃食管反流,此结果也支持LPRD与胃食管反流病是两种不同疾病的学说。

图2 实验组大鼠发生单次反流曲线截图 可见在13:11分至13:14分之间发生一次pH1和pH2的同时下降,符合反流事件发生标准。
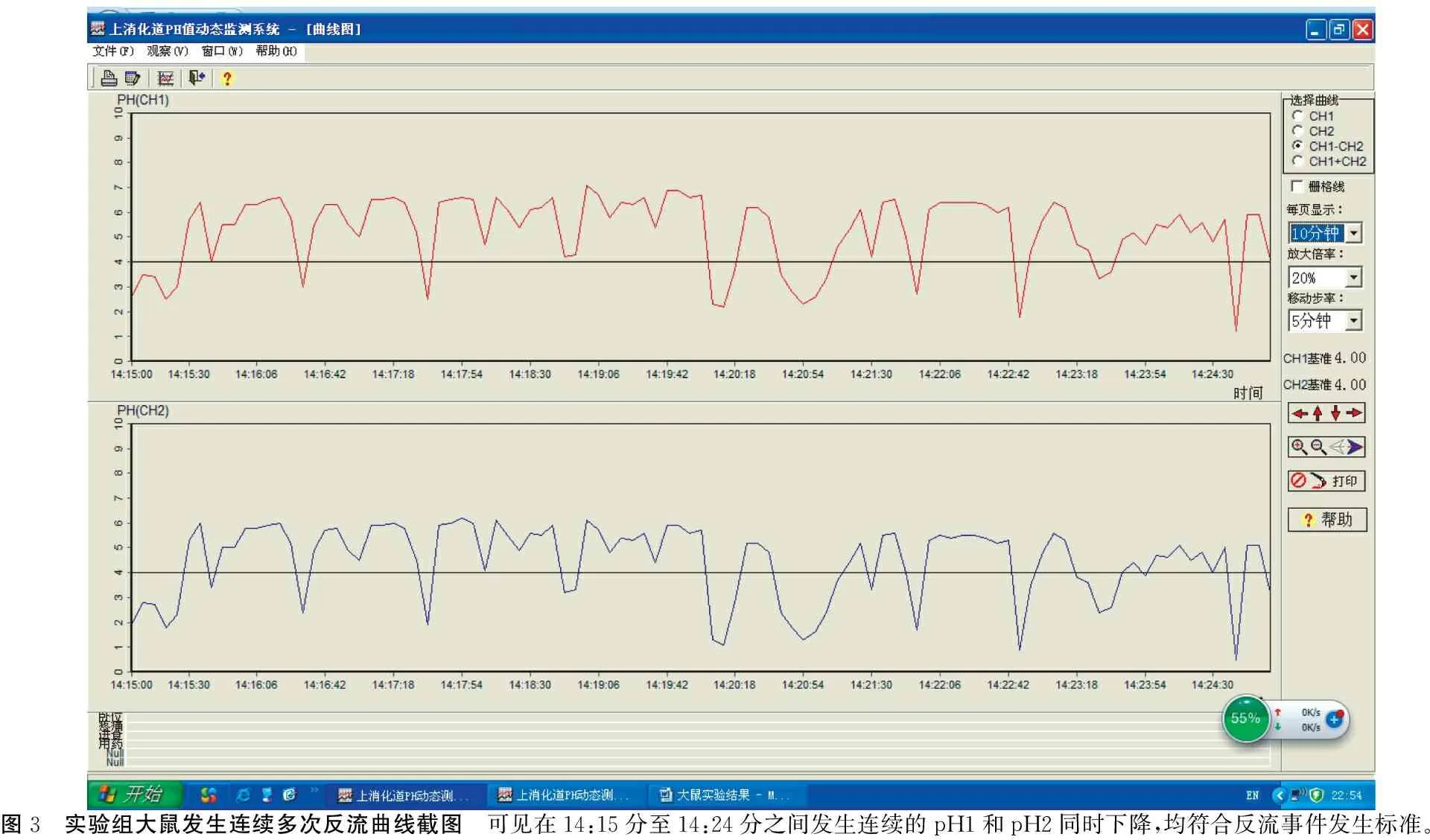
图3 实验组大鼠发生连续多次反流曲线截图 可见在14:15分至14:24分之间发生连续的pH1和pH2同时下降,均符合反流事件发生标准。

表1 实验组和对照组大鼠食管pH1及咽部pH2探头检测结果
目前对于LPRD的发病机制还不完全清楚,有关LPRD动物模型尚未见明确报道。已经报道的动物模型制备的一种方法是通过手术切除贲门括约肌[13]、植入食管支架[14]、限制幽门功能[15]等内源性方法,制成胃食管反流病动物模型,进而观察胃食管反流的咽喉部表现;另一种方法是直接向动物咽喉部涂抹酸、胃蛋白酶、胆盐[16]等溶液的外源性方法,观察反流对咽喉部的影响。这些方法多数是非生理性反流,探讨的多为胃食管反流病的食管外表现,而临床上很多LPRD患者无反酸、烧心症状,也无明显解剖学结构异常,因此内源性方法制作的动物模型不能解释人LPRD的发病。LPRD是一个涉及多方面因素的长期慢性过程,单纯通过局部化学刺激损伤咽喉粘膜难以完全解释LPRD的发生和发展,因此外源性方法只能用于研究咽喉和食管粘膜损伤和防御的机制。上述两种动物模型也未涉及神经、情绪、应激等相关因素对发病的影响,与临床LPRD发病危险因素无显著相关性,得到的研究结果无法全面解释LPRD发生和发展的过程,加上这些动物模型制作费时费力,实验动物常因感染导致死亡,因此用于LPRD的研究存在较大的局限性。本研究采用的改良多平台水面法对大鼠进行睡眠剥夺,根据大鼠昼伏夜出的生活习性,选择性剥夺大鼠白天睡眠,实验中大鼠只可站立于四周充满水的平台上,困倦时可进入非快速眼动期,当大鼠进入快速眼动期时,全身骨骼肌张力明显降低,颈部肌张力降低引起节律性低头、触水,从而无法进入快速眼动期睡眠而觉醒,如此反复使大鼠的生物节律被打乱,构建慢性睡眠剥夺模型;同时为了使动物模型更接近临床多数LPRD患者的生活习惯,在实验过程中给实验组大鼠喂食高脂饲料,以期与现代人长期熬夜、进食高脂饮食的生活习惯一致,文中结果显示实验组大鼠出现了典型的LPRD,说明本研究所采用的LPRD动物模型造模方法成功,也提示慢性睡眠剥夺和高脂饮食与LPRD发病存在密切的关系。且本研究所采用的方法简单,容易操作,实验过程中动物无明显痛苦,更加符合实验动物学的3R原则,因此,慢性睡眠剥夺和高脂饮食可能成为制造LPRD动物模型的一种新方法,该动物模型有望成为进一步研究LPRD发病机制以及新的诊断治疗措施的载体,但慢性睡眠剥夺和高脂饮食两种是单独起作用还是协同作用、动物咽喉及食管粘膜组织学观察还需要进一步研究证实。
1 中华耳鼻咽喉头颈外科杂志编辑委员会咽喉组,中华医学会耳鼻咽喉头颈外科学分会咽喉学组.咽喉反流性疾病诊断与治疗专家共识(2015)[J].中华耳鼻咽喉头颈外科杂志, 2016,51:324.
2 Altman KW, Stephens RM, Lyttle CS, et al.Changing impact of gastroesophageal reflux in medical and otolaryngology practice[J]. Laryngoscope,2005,115:1145.
3 王景杰,黄裕新,秦明,等.睡眠剥夺对大鼠胃运动及相关胃肠激素影响的研究 [J].解放军医学杂志,2005,30:124.
4 吴萍,孙会会,陈胜芳,等.高脂饮食与胃食管反流性咳嗽的临床研究[J].中华消化杂志,2014,34:121.
5 Suchecki D,Tufik S.Social stability attenuates the stress in the modified multiple platform method for paradoxical sleep deprivation in the rat[J].Physiol Behav,2000,68:309.
6 张立红,李娜,郑宏伟,等. 咽喉反流的初步诊断[J]. 中华耳鼻咽喉头颈外科杂志,2009,44:105.
7 Bonnet MH, Arand DL. We are chronically sleep deprived[J]. Sleep,1995,18:908.
8 Foley D, Ancoli-Israel S, Britz P, et al. Sleep disturbances and chronic disease in older adults: results of the 2003 National Sleep Foundation sleep in America survey[J]. J Psychosom Res,2004, 56:497.
9 Khanijow V, Prakash P,Emsellem HA, et al. Sleep dysfunction and gastrointestinal Diseases[J]. Gastroenterology & Hepatology,2015, 11:817.
10 Campagnolo AM,PristonJ,Thoen RH, et al. Laryngopharyngeal reflux: diagnosis, treatment, and latest research[J]. Int Arch Otorhinolaryngol,2014,18: 184.
11 Wu P,Zhao XH,Ai ZS,et al.Dietary intake and risk for reflux esophagitis:a case-control study[J].Gastroenterol Res Pract,2013,2013:691026.
12 Erylmaz A, Erisen L,Demir UL,et al. Management of patients with coexisting obstructive sleep apnea and laryngopharyngeal reflux disease[J]. Eur Arch Otorhino- laryngol,2012,269: 2575.
13 Xu XB, Hu Y,Wang Y,et al. Expression of claudin-3 in the esophagus and larynx of rat reflux model[J]. Auris Nasus Larynx,2014,41: 539.
14 Feng G,Zhang, Z,Diao C, et al. A bama minipig model of laryngopharyngeal reflux and the change of laryngopharyngeal mucosal ultrastructure[J]. J Neurogastroenterol Motil,2015,21: 182.
15 Habesoglu TE, Habesoglu M,Surmeli M. et al. Histological changes of rat soft palate with exposure to experimental laryngopharyngeal reflux[J]. Auris Nasus Larynx,2010, 37: 730.
16 Vageli, DP, Prasad ML,Sasaki CT. Gastro-duodenal fluid induced nuclear factor-kappaappaB activation and early pre-malignant alterations in murine hypopharyngeal mucosa[J].Oncotarget,2016,7: 5892.
