噪声暴露对大鼠ABR反应阈及下丘中小清蛋白、钙视网膜蛋白及钙结合蛋白表达的影响*
2018-01-25徐涛罗彬孙敬武刘丛利宋朝
徐涛 罗彬 孙敬武 刘丛利 宋朝
噪声性听力损失是一种常见后天性感音神经性聋的,多因长期噪声环境暴露或短时强噪声暴露所致,表现为暂时性阈移或永久性阈移。声创伤后听觉通路中变化主要有机械损伤学说、氧化自由基学说、钙离子平衡失调学说、谷氨酸兴奋性中毒学说及兴奋性与抑制性神经递质的变化学说等[1~5];钙离子作为细胞信号通路中的第二信使,通过与钙结合蛋白(calcium-binding proteins,CBPs)作用,参与细胞迁移、胞外分泌、细胞间的离子转运和信息调控、细胞的增殖、分化及凋亡等多种生物学效应;缓冲蛋白作为CBPs家族成员,主要参与对细胞内钙离子浓度的调控,其中以小清蛋白(parvalbumin,PV)和钙视网膜蛋白(calretinin,CR)最具代表性,钙结合蛋白D-28K(calbindin D-28K,CB)也被广泛的研究。研究表明,PV、CR和CB在中枢神经系统中表达丰富,其特异性地、互不重叠地表达于中枢神经系统γ-氨基丁酸(gamma-aminobutyric acid,GABA)能中间神经元的亚群中,并具有神经保护作用[6]。下丘(inferior colliculus,IC)作为听觉传导通路上的重要中继站,拥有丰富的神经元,本研究拟通过观察噪声暴露后大鼠IC中PV、CR及CB表达水平变化,探讨噪声暴露后中枢传导通路的变化,进一步探讨噪声致耳聋、耳鸣的可能发病机制。
1 材料与方法
1.1实验动物与分组 选取2~3月龄、体重200~250 g的健康雄性SPF级SD大鼠22只,随机分成对照组(8只)和噪声组(14只);所有动物经检查,全身无明显畸形,耳廓反射存在,耳镜检查无明显异常;无耳毒性药物接触史及强噪声暴露史;双耳ABR反应阈均在25 dB SPL以下。
1.2实验方法
1.2.1噪声暴露方法 动物经腹腔注射7%的水合氯醛(500 μl/kg)麻醉后行ABR检测,然后噪声组大鼠于隔声室内置入专用保温器皿内,右耳用耳模橡胶封堵,左侧外耳道朝向扬声器(上海创木,CP-75A),扬声器距外耳道口约3 cm,暴露于中心频率为16 kHz、带宽为一个倍频程、声强为116 dB SPL的噪声(由专业人员经Adobe audition3,Version 3软件合成),暴露1小时后保温复苏;对照组大鼠置于相同容器内远离噪声暴露源,保温至苏醒。
1.2.2ABR检测 所有动物在噪声暴露前及暴露后第7天用Tucker-Davis Technologies 系统3(TDT,美国)检测双耳ABR。大鼠两耳连线与头顶正中矢状线交点处接正电极,鼻尖接地电极,检测耳对侧乳突处接负电极,分别以8、12、16、20、24及32 kHz短音闭合声场给声,刺激间隔为10次/秒,扬声器(TDT公司,EC1)软管置于检测耳外耳道内,采集波的滤波范围为300~3 000 Hz,叠加1 024次;声强自100 dB SPL开始以5 dB梯度逐次降低; ABR波形采集记录及分析由BioSigRP软件(TDT公司)完成,反应阈判断标准为记录的ABR波形中波Ⅲ刚消失且两次检测波形不重合时的最小声强加5 dB。
1.2.3下丘PV、CR及CB表达量检测 噪声暴露后第7天完成ABR测试后,麻醉状态下断头,快速取出两组大鼠脑组织,置于富氧的低温人工脑脊液中,于震动切片机(德国 LEICA,VT1200S)中对脑组织进行冠状位切片,始自尾端,层厚约300 μm,对照大鼠脑谱图分别取出双侧下丘组织;细胞裂解液(上海生工,PL005)低温裂解30 min后取上清液,采用BSA试剂盒(上海生工,SK3051)进行蛋白质浓度测定,以上样缓冲液均一浓度后充分混匀,置入沸水中浴10 min后室温冷却,行蛋白质印迹试验:分离电压120 V,转膜电流280 mA,一抗为Swant公司CB300(1∶1 000)、CR7699/3H(1∶1 000)、PV235(1∶1 000),蛋白标准品来自Bio-rad公司,内参β-tubulin(1∶1 000)采用Cell Signaling公司产品,使用Millpore公司进口分装二抗,发光试剂盒由Bio-rad公司提供,法国Vilber Lourmat,Fusion Solo 2作凝胶成像及图像采集。
1.3统计学方法 实验所得数据采用SPSS 19.0软件行统计学分析,组间比较采用t检验,以P<0.05为差异有统计学意义。应用Graphpad 5.0作图,图像结果采用Image J软件进行灰度分析,灰度值越大,表示表达越强。
2 结果
2.1两组ABR反应阈比较 噪声暴露前两组动物双耳各频率ABR反应阈差异无统计学意义(P>0.05),组间反应阈比较亦无显著性差异(P>0.05);噪声暴露后第7天,噪声组大鼠暴露耳8、12、16、20、24及32 kHzABR反应阈均较噪声暴露前显著升高,发生了显著的阈移(P<0.001),而对照组双耳反应阈及噪声组非暴露耳反应阈较暴露前差异无统计学意义(P>0.05)(表1)。
2.2两组大鼠下丘PV、CR及CB表达量 噪声暴露后第7天,噪声组大鼠暴露侧下丘PV和CR的表达量较非暴露侧显著增加,分别增加了21.80%(P<0.05)和30.79%(P<0.01)(表2),且噪声组大鼠非暴露侧下丘中PV及CR表达量较对照组双侧平均表达量亦显著增加,分别增加61.39%及17.91%(P<0.01);而噪声组两侧下丘中CB的平均表达量明显低于对照组,较对照组下降19.63%(P<0.05),但两侧的表达量之间差异无统计学意义(P>0.05)(表2,图1~3)。

表1 各频率两组噪声暴露前及暴露后第7天左、右耳ABR反应阈
注:*与噪声组噪声暴露前双耳及噪声暴露后非暴露耳比较,P<0.001

表2 暴露后第7天PV、CR及CB蛋白在对照组及噪声组左、右侧下丘中表达
注:*与对照组均值及同组右侧下丘比较,P<0.05;△与对照组双侧平均值比较,P<0.01
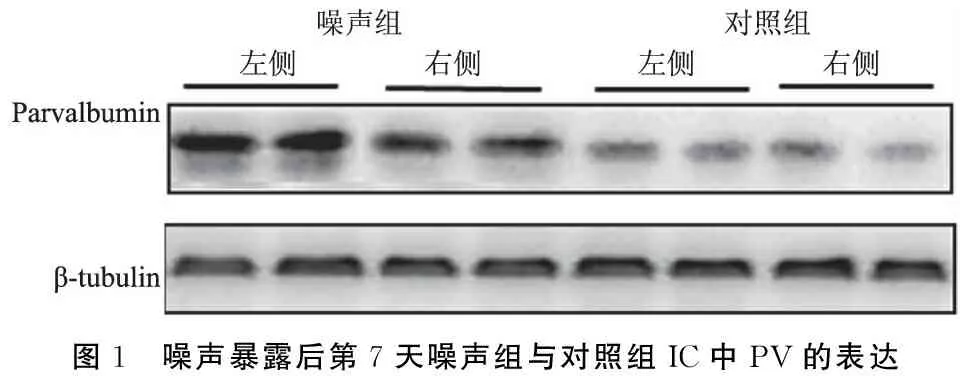
图1 噪声暴露后第7天噪声组与对照组IC中PV的表达
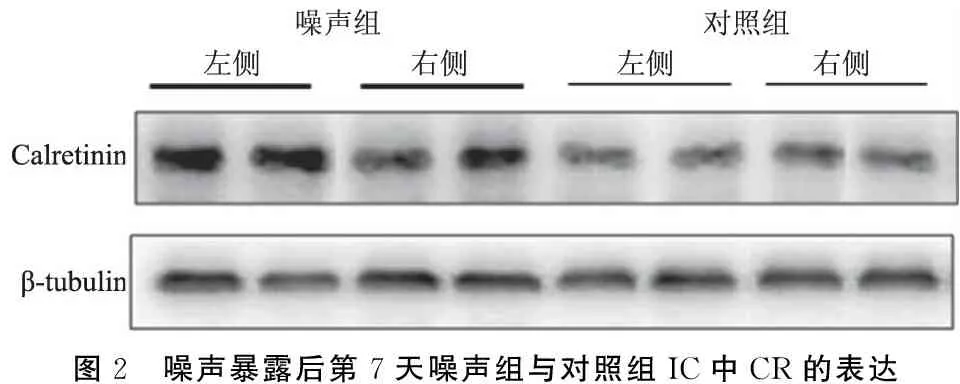
图2 噪声暴露后第7天噪声组与对照组IC中CR的表达
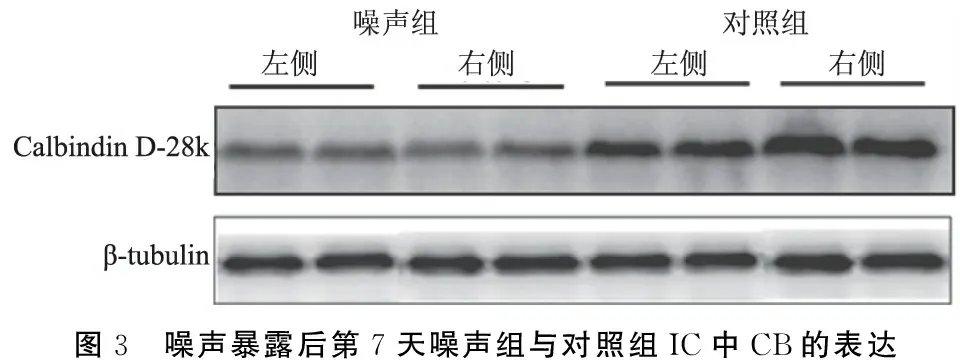
图3 噪声暴露后第7天噪声组与对照组IC中CB的表达
3 讨论
研究显示,在噪声暴露后早期,实验对象多表现为ABR反应阈升高,多认为与短期的内耳形态学改变有关,包括柱状体的屈曲膨胀、螺旋器变性塌陷、毛细胞静纤毛的损伤以及耳蜗内电位的抑制等[7];将南美栗鼠清醒状态下暴露于中心频率4 kHz、带宽一个倍频程、声强为86 dB SPL的噪声场中24小时,发现所有动物噪声暴露后4~12 kHz ABR反应阈显著提高,平均值为43 dB SPL[7];本课题组也曾将大鼠在清醒状态下暴露于频率4 kHz以上、100 dB SPL的白噪声中,在暴露后0.5~2小时后大鼠双耳ABR反应阈较暴露前均显著提高,提高15~50 dB不等,但是经休息后逐渐恢复,至暴露后第14天,反应阈基本恢复正常[8]。文中结果显示,将大鼠在中心频率16 kHz、带宽一个倍频程、声强116 dB SPL的噪声环境中暴露1 h后,8、12、16、20、24及32 kHz频率ABR反应阈均显著升高,与以往大多数实验结果相符。
研究发现,噪声暴露的声强、频率及暴露时间与听觉系统损伤及损伤后修复程度也存在着很大的联系[9];Browne等[10]将大鼠在麻醉状态下单耳暴露于中心频率16 kHz、1/10倍频程、115 dB SPL噪声中1小时,测得所有动物暴露耳ABR反应阈均提高,但在暴露后第8天低频反应阈基本恢复正常,而高频(16 kHz和32 kHz)反应阈无明显变化,并且在暴露后第16天,除1 kHz较第8天无显著变化外,其余频率反应阈均再次升高,暴露后第32天,所有频率的反应阈较暴露后第8天均显著升高;指出在暴露后第8天低频段听阈的恢复提示在外周听觉器官或中枢听觉通路中可能同时存在着修复与适应的过程,认为,暴露后早期的反应阈提高系因耳蜗内毛细胞及外毛细胞的损伤导致,而阈值下降后又再次升高可能是外周听觉器官与中枢听觉通路发生了一系列的改变导致;且噪声暴露后单纯的毛细胞损伤、修复与适应可能不能完全解释噪声暴露后听阈的变化,噪声暴露后还可能导致耳鸣等症状。Turner等[11]在2006年以惊跳反射的行为方法检测出大鼠经与本研究相同噪声环境及暴露条件后出现了耳鸣症状;有研究证实,噪声暴露可以导致听觉通路中一系列兴奋性和抑制性反应的失衡[4]。下丘作为听觉传导通路中的重要中继站,其分层结构具有对音频定位的功能,也是听觉传导通路中神经元数量最多的部位之一[12],并且其解剖位置恒定。因此,通过下丘观察噪声暴露后大鼠ABR反应阈改变时听觉通路的变化也是可靠的。
CBPs作为具有神经保护功能的蛋白质家族,已被证明由神经元的活动来调节,被广泛用于研究听觉系统变化。从本研究结果看,噪声暴露后第7天,暴露组动物暴露侧下丘中PV和CR的表达量较非暴露侧显著增加,且非暴露侧下丘中PV和CR的表达量较对照组双侧下丘的平均表达量也显著增高。Idrizbegovic等[13]研究发现,噪声刺激后,小鼠下丘中PV和CB免疫阳性的神经元中两种蛋白的表达量显著增加,指出,由于CBPs的神经保护作用,噪声过度刺激后,这些神经元中CBPs家族成员PV和CB表达量的增加可能是它们对过度刺激的保护作用。然而,噪声暴露后第7天,本研究测得噪声组大鼠的CB表达量较对照组降低,Browne等[10]也测得噪声暴露后当天暴露侧听皮层及耳蜗核中CB的表达量明显减少,到第32天,耳蜗核中CB表达量有所提高,他们认为,CB在暴露后的减少可能是由于暴露后听觉系统过分的兴奋毒性导致CB合成紊乱,影响了其作为胞质钙的缓冲功能,从而不再能够保护细胞免受兴奋性毒性损伤,随着听觉功能的修复,CB的表达量在暴露后第32天再次上升。
Forster等[14]曾行大鼠单侧耳蜗切除,观察大鼠单耳听力损失后中枢听觉通路中CB的变化,发现在单耳听力损失同侧的下丘中央核中CB阳性神经元数量显著增加,认为这是听觉脑干神经元网络为了调整信号的突然变化而产生的适应性改变。然而,在本研究中,噪声暴露后第7天并没有发现暴露组两侧下丘中CB表达量存在显著性差异,且噪声组CB的表达量较对照组下降;可能是由于本研究仅观察到噪声暴露后第7天,有一定的局限性,噪声暴露后下丘CB的表达量可能在更短期或远期发生着变化,这有待于今后进一步观察。
CB在中枢听觉通路中的表达量还会随年龄的增长呈现明显的下降趋势[15],故实验动物的种类、大小、月龄及实验条件、方法的不同,对研究结果均可能有影响。此外,本研究在噪声组中,采用耳模橡胶封堵非暴露耳,虽然非暴露耳ABR反应阈较暴露前及对照组无显著差异,但非暴露侧下丘中PV、CR表达量显著高于对照组双侧下丘的平均值,提示噪声暴露仍有可能通过骨导影响非暴露耳,这也有可能在一定程度上影响实验结果。
综上所述,噪声暴露后大鼠ABR反应阈升高,下丘PV、CR表达水平上升,CB表达水平下降,这些变化可能参与了噪声性聋、耳鸣及其它听觉功能异常的发病机制。
1 Le Prell CG, Yagi M, Kawamoto K, et al. Chronic excitotoxicity in the guinea pig cochlea induces temporary functional deficits without disrupting otoacoustic emissions[J]. Acoust Soc Am, 2004, 116:1044.
2 Maurel D, Comps-Agrar L, Brock, C, et al. Cell-surface protein-protein interaction analysis with time-resolved FRET and snap-tag technologies: application to GPCR oligomerization[J]. Nat Methods, 2008, 5:561.
3 Miller JM, Brown JN,Schacht J. 8-iso-prostaglandin F(2alpha), a product of noise exposure, reduces inner ear blood flow[J]. Audiol Neurootol, 2003, 8:207.
4 Wang H, Brozoski TJ, Turner JG, et al. Plasticity at glycinergic synapses in dorsal cochlear nucleus of rats with behavioral evidence of tinnitus[J]. Neuroscience,2009, 164:747.
5 Yamashita D, Jiang HY, Schacht J, et al. Delayed production of free radicals following noise exposure[J]. Brain Res, 2004, 1019:201.
6 Zhou C, Li C, Yu HM, et al, Neuroprotection of gamma-aminobutyric acid receptor agonists via enhancing neuronal nitric oxide synthase (Ser847) phosphorylation through increased neuronal nitric oxide synthase and PSD95 interaction and inhibited protein phosphatase activity in cerebral ischemia[J]. Neurosci Res, 2008, 86:2973.
7 Nordmann AS, Bohne BA, Harding GW. Histopathological differences between temporary and permanent threshold shift[J]. Hear Res, 2000, 139:13.
8 刘芳丽, 罗彬, 孙敬武, 等.噪声暴露对大鼠ABR 反应阈及听皮层谷氨酸脱羧酶67 表达的影响[J]. 听力学及言语疾病杂志, 2014, 22:268.
9 Clark WW. Recent studies of temporary threshold shift (TTS) and permanent threshold shift (PTS) in animals[J]. Acoust Soc Am, 1991, 90:155.
10 Browne CJ, Morley JW, Parsons CH. Tracking the expression of excitatory and inhibitory neurotransmission-related proteins and neuroplasticity markers after noise induced hearing loss[J]. PLoS One, 2012, 7:e33272.
11 Turner JG, Brozoski TJ, Bauer CA, et al. Gap detection deficits in rats with tinnitus: a potential novel screening tool[J]. Behav Neurosci, 2006, 120:188.
12 Pouyatos B, Morel G, Lambert-Xolin AM, et al. Consequences of noise- or styrene-induced cochlear damages on glutamate decarboxylase levels in the rat inferior colliculus[J]. Hear Res, 2004, 189:83.
13 Idrizbegovic E, Bogdanovic N, Canlon B. Sound stimulation increases calcium-binding protein immunoreactivity in the inferior colliculus in mice[J]. Neurosci Lett, 1999, 259:49.
14 Forster CR, Illing RB. Plasticity of the auditory brainstem: cochleotomy-induced changes of calbindin-D28k expression in the rat[J]. Comp Neurol, 2000, 416:173.
15 Ouda L, Burianova J, Syka J. Age-related changes in calbindin and calretinin immunoreactivity in the central auditory system of the rat[J]. Exp Gerontol, 2012, 47:497.
