重金属污染区与非污染区平车前生物量分配的比较
2018-01-25刘文胜赵运林
文 珂 ,刘文胜 ,赵运林
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2.湖南省环境资源植物开发与利用工程技术研究中心,湖南 长沙 410004)
矿山开采在提供人类所需原材料的同时,也形成了大面积重金属污染的环境。长期生长于污染土壤的植物为适应所处环境,其表型特征将发生改变[1],甚至形成具有重金属抗性的矿山生态型 (Metallophyte)[2-3]。探明植物适应重金属污染的相关表型特征是揭示形成植物抗性的生态机理,进而有可能使这种进化特征在重金属污染的植物修复方面得到应用的重要环节[4-5]。
个体大小、种子大小与数量以及生物量分配模式等均为重要的植物生长、生殖性状,也是植物适应环境的重要表征[6]。许多研究表明,在较高浓度重金属胁迫条件下,植物生长将受到抑制,导致单株生物量降低[7-8],并且植物的抗性种群与同物种的非抗性种群相比单株生物量较低[9-10];另有研究则表明一定浓度重金属能促进植物生长,进而提高总生物量[11];甚至有研究显示一些植物的抗性种群生物量高于非抗性种群[12]。与此同时,有研究显示,在重金属胁迫条件下,根受到伤害程度最深,其生物量分配比例在胁迫条件下将减少;也有许多研究则显示,重金属抗性种群的植物个体将更多的能量投资于根或者繁殖器官,从而适应其所处环境[13-16]。因而,需要更多生长于重金属污染区与非污染区植物生长、生殖特征的对比研究,以期揭示植物对重金属环境的生态适应模式。
平车前Plantago depressa为车前科一年生草本植物,在我国广泛分布。该植物生长迅速,抗逆性强,能够忍耐铅(Pb)、锌(Zn)等多种重金属[6]。该植物能在重金属污染区完成生长、生殖过程,是一种对多种重金属具有抗性的植物,是研究植物对矿山适应方式的良好材料。
本研究选取已有20多年开采历史的兰坪铅锌矿区为研究区域,选择重金属污染与非污染土壤自然生长的平车前作为研究对象,通过对2个种群植物的个体大小、种子大小与数量、生物量分配开展对比研究,探讨该植物对土壤重金属污染的适应方式,将揭示植物对重金属适应的生态机制,同时也为利用该植物进行矿山恢复提供科学依据。
1 研究方法
1.1 样地选择
兰坪铅锌矿区位于云南省怒江州兰坪县金顶镇3.5 km处,是我国铅锌矿储量最高的矿山。该矿始开采于1990年,至今已有20多年历史。兰坪县年平均气温为11.3 ℃,年降水量为1 008 mm,冬春干旱,夏季多雨,具有典型的亚热带、山地主体型季风气候特点。
平车前是兰坪铅锌矿区较常见的植物,在矿区能生长、结实[16-17]。本文选择由尾矿堆积24 a后自然恢复形成的马桑Coriaria nepalensis灌丛作为污染区,该区(以下简称污染区)土壤Cd、Pb、Zn等重金属含量均远高于Ⅲ类土壤环境质量标准(GB15618—1995);选择矿区附近生长有平车前的农田土壤作为非污染区 (以下简称非污染区),该区土壤各重金属含量均低于Ⅲ类土壤环境质量标准 (GB15618—1995)(见表1)。

表1 污染区与非污染区土壤基本理化性质†Table 1 Basic physical and chemical properties of soil samples from heavy metals polluted and non-polluted areas
1.2 样品采集
于2015年8月底至9月初,在兰坪铅锌矿区污染区和非污染区样地利用样线法开展平车前植株及土壤样品采集。即在2个样地分别设置1条150 m的样线,样线上每隔5 m采集一个植物样品(样线上无平车前分布的除外)。植物采集为整株采集(包括根、茎、叶、果穗等),平车前根系在土壤中分布较深,为采集所有的根,每个植物样品土壤挖取的深度达0.5 m。非污染区共采集27株,污染区共采集23株,共计50株平车前样品。样品采集后放至塑封袋,并带回实验室进行下一步分析。
1.3 表型检测
用游标卡尺测量所有植株高度、根长、叶片长度、叶片宽度等形态学指标 (均选取最长根、最大叶片进行测量),统计根数量、叶片数量、每株小穗数、每穗种子数等指标。
测量指标完成后,将样品用自来水冲洗,自然晾干。将每份植株样品区分为根、叶、花序轴和蒴果4个部分,装入信封中,在65℃烘箱中烘烤48 h至恒质量,用万分之一天平称量各部分质量。
生物量分配采用Reekie[18]的方法进行计算,各指标计算公式如下:
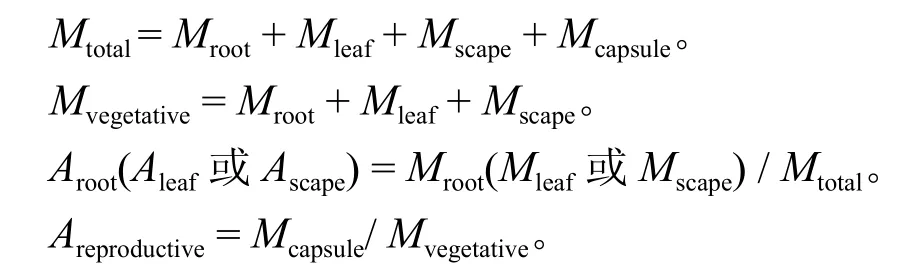
式中:Mtotal为总生物量,Mroot为根生物量,Mleaf为叶生物量,Mscape为花序轴生物量,Mcapsule为蒴果生物量,Mvegetative为营养器官生物量,Aroot为根生物量分配,Aleaf为叶生物量分配,Ascape为花序轴生物量分配,Areproductive为生殖分配。
1.4 数据处理
植物表型、种子大小、生物量分配的相关指标利用SPSS13.0统计软件中的Independent-Samples T-Test 进行差异显著性分析。
2 结果与分析
2.1 个体大小
植物个体大小是其对环境适应的综合体现。表2显示,与非污染区相比,污染区生长的平车前植株高度由20.50 cm降至17.03 cm,降低了16.9%;叶片长度也由4.91 cm下降为4.18 cm,降低了14.9%;每植株的叶片数量、叶片宽度、须根数量、主根长度则未发生显著变化。

表2 重金属污染区、非污染区平车前形态特征比较†Table 2 Comparisons of morphological characteristics between heavy metals polluted and nonpolluted Plantago depressa
两个样地植物生物量比较结果显示,污染区平车前单株生物量为1.62 g,在2.33~0.85 g 之间;非污染区平车前总生物量为2.73 g,在 4.87~1.21 g 之间,污染区总生物量较非污染区有明显下降 (t=3.136,P=0.003),降低了40.66%。叶(t=4.011,P<0.001)、蒴果(t=2.696,P=0.011)、花序轴(t=3.248,P=0.002)均显示出相同的趋势(见图1);污染区与非污染区平车前根生物量差异不显著(t=1.427,P=0.160)。

图1 污染区与非污染区平车前各器官生物量Fig. 1 Biomass of different organs of Plantago depressa from polluted and non-polluted soils
2.2 种子大小与数量
种子大小与数量是植物适应环境的主要表现。平车前为穗状花序的植物,果实为蒴果。种子数量比较结果显示,污染区的每植株穗数(t=3.255,P=0.003)、每穗果实数(t=2.343,P=0.023)、每果实的种子数 (t=2.633,P=0.011) 显著低于非污染区,其值分别由非污染区的7.11、44.42、9.05下降至污染区的3.75、32.43和7.90,分别下降了47.26%、27.00%和12.71%。同时,种子千粒重由非污染区的0.39 g降为污染区的0.31 g,下降了20.5%(t=2.609,P=0.014)(见表3)。这说明污染区的种子大小、数量均较非污染区的显著降低。

表3 污染区、非污染区平车前种子大小与数量的比较†Table 3 Comparisons of seed size and number of Plantagodepressa from polluted and non-polluted soils
生物量分配是植物对环境适应的重要策略[18]。图2的平车前生物量分配显示,污染区根生物量分配比例为0.44,非污染区根生物量分配比例为0.27,污染区较非污染区有较高的根生物量分配(t=-3.509,P<0.001)。非污染区繁殖分配为0.18,污染区繁殖分配为0.16,t检验显示二者无显著差异(t=0.717,P=0.477)。非污染区茎叶生物量分配比例为0.53,高于污染区茎叶生物量的0.42(t=3.444,P=0.001)。
3 讨 论
3.1 个体大小
个体大小具有较大的可塑性,是植物适应环境的重要表征。本研究显示污染区平车前叶片大小和数量、单株生物量等均较非污染区的低,说明平车前的生长已受到较高浓度Pb、Zn等重金属的明显抑制。已有的许多研究均显示,在较高浓度重金属胁迫下,植物个体将变小[6,11,19-21]。本研究与这些研究结果一致,说明高浓度重金属胁迫植物生长受到抑制,植株变小是一个普遍现象。另一方面,许多研究还显示,抗性种群 (矿山生态型) 比非抗性种群 (非矿山生态型) 具有更低的个体生物量[2]。本研究污染区平车前个体变小也有可能是该植物在长期的胁迫下,已形成了抗性种群的原因。现场调查显示平车前在重金属高污染区能正常开花、结实,其种子也能萌发并形成幼苗,这些均符合重金属抗性种群的相关特征。当然,需要有更多的研究,例如盆栽实验来进一步证实污染区平车前是否已形成抗性种群。
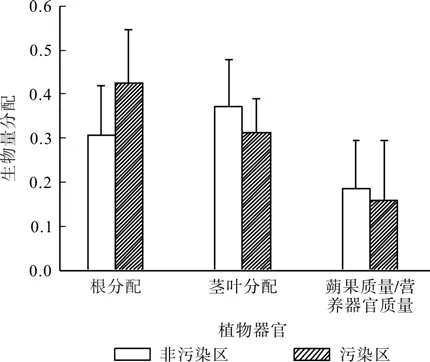
图2 污染区与非污染区平车前生物量分配的比较Fig. 2 Comparison of biomass allocation in Plantago depressa from polluted and non-polluted soils
3.2 种子大小与数量
种子大小与数量是植物有性繁殖能力的主要指标,能较好地指示植物对环境的适应方式。本研究结果显示,污染区平车前的种子大小、数量均显著低于非污染区,这说明重金属污染对平车前生殖器官的发育产生了明显的抑制作用。车前属Plantago植物受重金属胁迫的许多研究显示,种子大小与数量是植物适应胁迫的重要方式。例如,李晓红等[22]发现铝 (Al) 胁迫下车前P.asiatica种子千粒重没有发生显著变化,开花数量则明显减少,说明该植物是通过减少种子产量而不是降低种子质量来适应胁迫环境的。郭水良等[23]对北美车前P. virginica的研究得出与李晓红等[22]相同的结果。本研究污染区平车前的种子大小、数量则均显著低于非污染区,其原因可能是该植物通过降低种子数量与质量来适应胁迫环境。
3.3 生物量分配
生物量分配是植物适应环境的重要方式。本研究结果显示,平车前重金属污染区根生物量分配比例较非污染区高,这可能是该植物对重金属胁迫环境适应的一种方式。陈香等[13]对车前和北美车前、Nieet al.[19]对博落回Macleaya cordata重金属胁迫下的研究均显示,重金属胁迫条件下植物根生物量分配比例较未胁迫条件下低。其原因是根作为植物最重要的络合重金属的部位,它受到胁迫伤害最显著,因而生物量降低明显。本研究结果与这些研究结果不同。Huanget al.[15]对齿果 酸 模Rumex dentatus、Zalecka和 Wierzbicka[21]对 石 竹Dianthus chinensis、Schwartz[24]、Whiting等[25]和Haines[26]对遏兰菜Thlaspi arvense的研究结果均显示,抗性 (矿山生态型) 比非抗性种群(非矿山生态型) 具有更高的根生物量分配比例,本研究与这些研究结果一致。这说明平车前长期在高重金属胁迫环境下生长,可能已形成抗性种群。同时,该生态型可能产生了相应的适应机制,帮助植物即使在高重金属胁迫条件下,仍然能够增加根的生物量分配比例[15]。Huanget al.[15]已报道植物器官中不同的酸性转化酶活性可能是抗性植物增加根生物量分配比例的机制之一。还需要更多的研究以揭示这种适应机制。
[1]Wu F Z, Yang W Q, Zhang J,et al.Cadmium accumulation and growth responses of a poplar (Populus deltoids×Populus nigra)in cadmium contaminated purple soil and alluvial soil[J]. Journal of Hazardous Material, 2009, 177: 268-273.
[2]Antonovics J, Bradshaw A D, Turner R G. Heavy metal tolerance in plants[J]. Advances in Ecological Research, 1971, 7: 1-8.
[3]谢明吉, 柯文山, 王万贤, 等. 铜胁迫下两种海州香薷的膜脂过氧化水平及抗氧化能力比较[J]. 生态学杂志, 2005, 24 (8):935-938.
[4]王一峰, 岳永成. 重金属污染区与非污染区乌苏里风毛菊对铅胁迫的生理抗性[J]. 生态学杂志, 2014, 33(9): 2388-2394.
[5]Liu F, Chen J M, Wang Q F. Trade-offs between sexual and asexual reproduction in a monoecious speciesSagittaria pygmaea(Alismataceae): the effect of different nutrient levels[J].Plant Systematics and Evolution, 2009, 277: 61-65.
[6]陆引罡, 黄建国, 滕 应, 等. 重金属富集植物车前草对Ni的响应[J]. 水土保持学报, 2004, 18(1): 108-114.
[7]吴福忠, 杨万勤, 张 健, 等. 镉胁迫对桂花生长和养分积累、分配与利用的影响[J]. 植物生态学报, 2010, 34(10): 1220-1226.
[8]Wierzbicka M, Panufnik D.The adaptation ofSilene vulgaristo growth on a calamine waste heap (S. Poland) [J]. Environmental Pollution, 1998, 101: 415-426.
[9]Wilson J B. The cost of heavy-metal tolerance: an example[J].Evolution, 1998, 42: 408-413.
[10]曹 玲, 王庆成, 崔东海. 土壤镉污染对四种阔叶树苗木叶绿素荧光特性和生长的影响[J]. 应用生态学报, 2006, 17(5):769-772.
[11]陈 香, 陆耀东, 黄 伟, 等. 铝胁迫对入侵植物北美车前生长特性和生物量分配的影响[J]. 广西植物, 2011, 31(4): 495-500.
[12]杨肖娥, 龙新宪, 倪吾钟, 等. 古老铅锌矿山生态型东南景天对锌耐性及超积累特性的研究[J]. 植物生态学报, 2001,25(6): 665-672.
[13]陈 香, 胡雪华, 肖宜安, 等. 铝胁迫下北美车前和车前生长及叶绿素荧光特性的比较研究[J]. 植物研究, 2011, 31(6):680-685.
[14]刘富俊, 黎云祥, 廖咏梅, 等. 异质性重金属镉胁迫下克隆整合对匍匐茎草本植物积雪草生长的影响[J]. 植物生态学报,2011, 35 (8): 864-871.
[15]Huang W X, Huang Y, Ye F Y,et al.Effects of copper on phenology and reproduction inRumex dentatusfrom metalliferous and non-metalliferous sites[J]. Ecotoxicology and Environmental Safety, 2011, 74: 1043-1049.
[16]齐丹卉, 刘文胜, 李世友, 等. 兰坪铅锌矿区植被恢复初期土壤种子库与地上植被关系的研究[J]. 西北植物学报, 2013,33(11): 2317-2325.
[17]刘文胜, 齐丹卉, 苏焕珍,等. 兰坪铅锌矿区植被恢复初期土壤种子库的季节动态[J]. 中南林业科技大学学报, 2016, 36(9): 1-6.
[18]Reekie E G. An explanation for size-dependent reproductive allocation inPlatago major[J]. Canadian Journal of Botany,1998, 76: 43-50.
[19]Nie J, Liu Y, Zeng G,et al.Cadmium accumulation and tolerance ofMacleaya cordata: a newly potential plant for sustainable phytoremediation in Cd-contaminated soil[J]. Environmental Science and Pollution Research, 2016, 23: 10189-10199.
[20]王利宝, 朱宁华, 鄂建华. Pb、Zn等重金属对樟树、栾树幼苗生长的影响[J]. 中南林业科技大学学报, 2010,30(2):44-47.
[21]Zalecka R, Wierzbicka M. The adaptation ofDianthus carthusianorumL. (Caryophyllaceae) to growth on a zinc-lead heap in southern Poland[J]. Plant and Soil, 2009, 246: 249-257.
[22]李晓红, 李 蕴, 胡雪华, 等. 铝胁迫对车前生殖特性的影响[J]. 井冈山学院学报(自然科学版), 2009, 30(10): 5-7.
[23]郭水良, 盛海燕. 北美车前种群密度制约的统计分析[J]. 植物研究, 2002, 22(2): 236-240.
[24]Schwartz C, Morel J L, Saumier S,et al. Root architecture of the Zn-hyperaccumulator plantThlaspi caerulescensas affected by metal origin, content and localization in soil[J]. Plant and Soil,1999, 208: 103-115.
[25]Whiting S N, Leake J R, McGrath S P,et al. Positive response to Zn and Cd by roots of the Zn and Cd hyperaccumulatorThlaspi caerulescens[J]. New Phytologist, 2000, 45: 199-210.
[26]Haines B J. Zincophilic root foraging inThlaspi caerulescens[J].New Phytologist, 2002, 155: 363-372.
