基于MATLAB轨迹跟踪研究重金属铜对鲢幼鱼自发游泳行为的影响
2018-01-24靖锦杰黄应平雷帮军涂志英
靖锦杰 黄应平, 袁 喜 雷帮军 蒋 清 涂志英,
(1. 三峡大学水利与环境学院, 宜昌 443002; 2. 三峡大学三峡地区地质灾害与生态环境湖北省协同创新中心, 宜昌 443002;3. 三峡大学计算机与信息学院, 宜昌 443002; 4. 三峡库区生态环境教育部工程研究中心, 宜昌 443002)
铜是水体常见的重金属污染物, 对水生无脊椎动物、两栖动物和鱼类等水生生物均具有较强的毒性, 能通过生物富集和生物放大效应对水生生态系统产生重要影响[1—3], 日益引起人们对其的普遍关注[4]。
鲢(Hypophthalmichthys molitrix) 属鲤形目鲤科, 是我国四大家鱼之一, 也是长江重要的经济鱼类且广泛分布在全国各大水系[5]。已有研究表明重金属对鲢幼鱼和鱼胚胎均具有明显的毒性[6], 且对鲢肝组织SOD和CAT活性影响显著[7]。此外, 长江沉积物中铜的富集系数较高, 对中华倒刺鲃(Spinibarbus sinensis)的游泳能力[8]和草鱼(Ctenopharyngodon idellus)幼鱼的临界游速和耗氧率均有显著抑制作用[9]。
视频是记录鱼类行为的一般形式。鱼类行为研究的主要问题就是怎样从拍摄的视频中高效准确的提取鱼类行为数据。用传统方法获取诸如鱼的位置、方向、摆幅、频率等数据一般是通过手动测算实现的。手动测算具有劳动密集、主观依赖性强等缺点, 从而导致监测效率低、行为精准度受限[10]。 近几年来, 计算机视觉技术也应用到鱼类的行为学研究之中, Rillahan等[11]采用多台摄影机记录实验鱼的三维坐标信息, 通过HTI模型291超声波遥测系统精确描绘其运动轨迹, 定量研究运动行为, 石小涛等[12]利用Swis Track软件分析鲢幼鱼游泳行为, Huang等[13]利用一套实时监测系统分析了斑马鱼(Barchydanio rerio var)对不同浓度的溴氰菊酯行为响应关系。本研究利用MATLAB软件, 研究重金属铜离子浓度对鲢幼鱼自发游泳行为的影响,采用原子吸收分光光度法检测鱼体内各部位重金属含量的变化, 从生理上分析运动行为变化的原因,探索环境因子对鱼类的影响, 为生物预警和水质监测等方面提供理论参考。
1 材料与方法
1.1 实验材料
实验所用的鲢幼鱼由宜都水产市场提供, 鱼体长为(10.4±0.5) cm, 体质量为(13.7±1.3) g。实验鱼在180 cm×40 cm×60 cm的鱼缸中驯化2周。按照鱼体重的5%, 每天08:00投喂渔用配合饲料(粗蛋白质≥45%, 脂肪≥10%, 粗纤维≤3%, 粗灰分≤17%)。用空气泵向鱼缸内充氧, 光照为自然光照,水温用一套循环冷水仪控制, 保证实验装置中水温为(20±1)℃。实验前禁食48h, 避免消化活动对实验产生影响[14]。
1.2 实验装置
本文所有的视频数据采集通过简易计算机视觉系统(图1), 该系统包括1个白色LED灯组成的光源、一台摄像机和一台含图像采集卡电脑。LED光源安装在水槽的正下方用来增加亮度和减少阴影, 并确保实验鱼处于均匀光照背景下进行拍摄。摄像机安装在实验水槽的正上方, 镜头正对下方水面, 将摄像头调到能正常覆盖全部水槽即可[15]。试验拍摄得到的视频图像分辨率为720×480像素, 帧率为15帧/s。实验使用玻璃水槽的长×宽×高为50 cm×40 cm×25 cm, 实验时水位为10 cm。
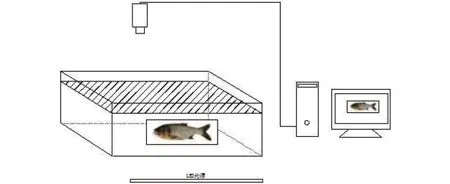
图1 鱼类行为视频监控装置Fig. 1 The video monitoring device for fish behavior
1.3 实验步骤
正式实验前, 根据水质对淡水鱼急性毒性测定方法(GB 12997-91)完成预实验, 设置5个不同水体铜浓度曝露96h, 选50尾鱼测定96h-LC50的值为4.05 mg/L; 根据预实验结果, 设置5个不同浓度组(0、1、2、3、4 mg/L), 将健康的30尾鱼随机放入5个梯度水槽中暴露96h, 暴露期间不喂食, 每日定时换水(日换水量为水体的50%)并补充相应浓度的CuSO4溶液以保持水体铜浓度基本恒定, 其他实验条件不变。之后逐一将实验鱼转移到视频监控装置中(浓度和之前暴露水槽一致), 监控记录鱼60min的行为变化, 取最后5min的运动视频[10], 观察鱼的呼吸频率, 再用MATLAB软件将图像分割, 用光流法分析出鱼体中心点的位子, 最后利用坐标得到速度、加速度、运动路程等关系图; 实验结束后, 立即将鱼麻醉, 解剖, 取其肝脏、鳃、肌肉组织,利用原子吸收仪得到不同部位的重金属铜含量。
1.4 测试方法及主要参数
呼吸频率的测定实验全程由高清摄像头记录, 现场视频观测得到鱼5min呼吸频率Vf, 呼吸频率计算公式如下:
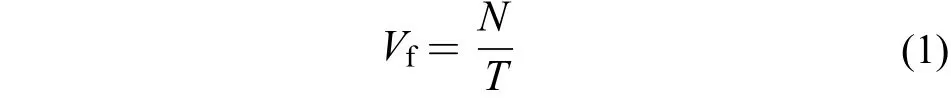
式中,N表示记录时间段鱼呼吸的总次数,T表示记录时长。
游泳速度、加速度及总路程的测定将实验录好的视频, 导入到由MATLAB编程得到的CT函数中, 处理成图片格式后进行标记, 运行MATLAB软件, 即可自动输出实验鱼的位置坐标,利用两点之间距离公式和速度加速度运动学基本公式, 可得到运动路程, 速度, 加速度等主要实验参数, 计算公式如下:
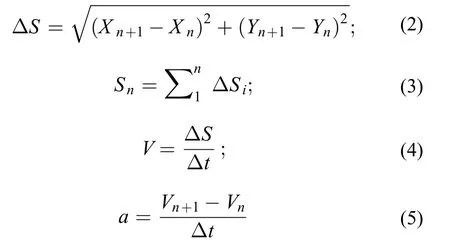
式中, ΔS表示连续两帧时间内实验鱼的运动距离;Xn,Yn表示前一帧实验鱼的位置坐标;Xn+1,Yn+1表示连续的后一帧的位置坐标;Sn表示前n帧的运动总距离;V表示实验鱼的运动速度;a表示实验鱼的运动加速度;Vn,Vn+1表示连续两帧的速度; Δt表示每帧所用的时间(帧率为15帧/s)。
各组织中重金属含量的测定在视频录制完毕后, 将实验鱼用丁香酚溶液(丁香酚溶液/乙醇=1/9, 5 mL混合液溶入10 L水中)麻醉(5min), 取其肝脏、鳃、肌肉组织并于-40℃低温保存。将各组织样本(以相同处理方法的6尾鱼组织为1个样本)称量, 取湿重, 放置于消解罐(50 mL)中消解, 采用原子吸收分光光度计测定组织Cu2+含量。
1.5 数据处理
实验数据以Excel 2003 进行常规计算, 实验数据在SPSS20.0中进行单因素方差分析(One-way ANOVA)和最小显著差数法(LSD)检验差异显著性。统计数据表示为平均值±标准误(mean±SE), 显著性水平为P=0.05。
2 结果
2.1 水体铜离子对鲢幼鱼运动时长和呼吸频率的影响
急性水体铜暴露对鲢幼鱼的运动时长影响显著(F5,29= 74.39,P≈0.000<0.001)。随着水体铜离子浓度增加, 运动时长逐渐减小, 与对照组相比, 在2.00和4.00 mg/L时影响显著(图2)。分别比对照组减少了37.90%和72.41%; 由图3可知, 呼吸频率在1.00 mg/L时略有升高但不显著, 当浓度升至2.00和3.00 mg/L, 呼吸频率显著下降(P<0.05), 在4.00 mg/L时铜离子的影响极其显著(P<0.001), 此时鲢呼吸压迫明显。
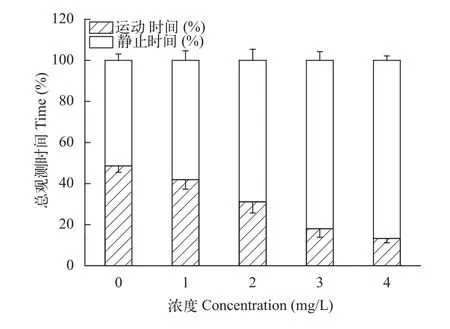
图2 急性铜暴露对鲢幼鱼运动时间比的影响Fig. 2 The effect of acute copper exposure on the moving of juvenile silver carp
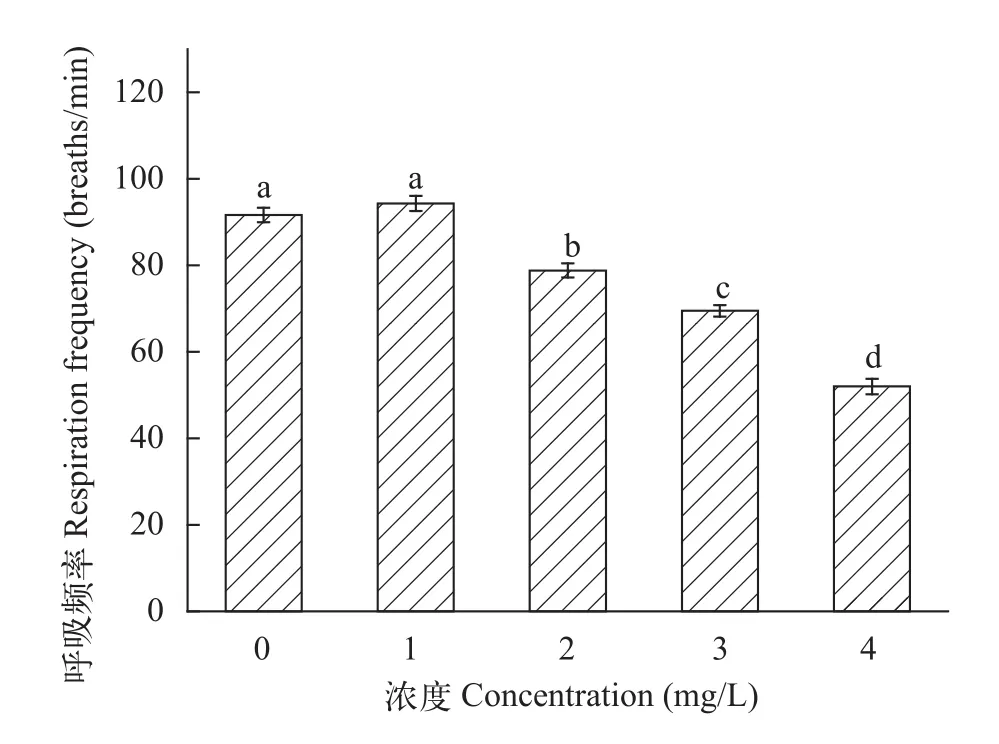
图3 急性铜暴露对鲢幼鱼呼吸频率的影响Fig. 3 The effect of acute copper exposure on respiratory rate of juvenile silver carp
2.2 水体铜离子对鲢幼鱼5min的运动速度及加速度和总路程的影响
图4 是在每个浓度下随机选取一条鱼分析其运动坐标而生成的[10]。结果表明随着浓度的增大, 鲢幼鱼的平均速度逐渐减小, 在正常情况下平均速度为44.86 mm/s, 而在最大浓度4 mg/L时, 其平均速度为29.50 mm/s, 利用最小显著差数法(LSD)检验可知两者差异显著(组距15.36>LSD0.01=4.146)。
加速度可以看作鱼突遇危险快速逃避的能力,由图4可知随着浓度增加, 加速度逐渐减小, 0时的正加速度为66.98 mm/s2, 2 mg/L时为68.13 mm/s2, 但两者差异性不明显, 而与4 mg/L时加速度为45.18 mm/s2存在显著差异(P<0.05), 且所有组的实验鱼在加速运动过程中的数值要大于减速运动的值。
由速度图形中提取的实验鱼运动5min总距离可以被看作一个描述实验鱼运动行为的单一行为参数[10]。这个总距离可以通过公式(2)得到相邻两点的距离再将所有小段求和得到的, 通过统计学分析得到5min内运动距离的均值和标准误。在0和1 mg/L时并无显著差异, 0与2和3 mg/L相比差异性明显(P<0.05)而在4 mg/L时差异性更加显著(P<0.001), 随浓度增大, 实验鱼的总运动距离下降(图5)。
2.3 鲢幼鱼鳃、肝脏和肌肉组织铜含量特征
采用静水急性毒性试验法测定铜对鲢的毒性,统计铜污染暴露24h、48h、96h后鲢幼鱼的死亡率,由直线内插法计算[9]获得LC50分别为8.03、6.54和4.05 mg/L, 根据96 hLC50×0.1计算安全浓度为0.4 mg/L, 急性铜离子暴露对鲢幼鱼鳃(F=1.69;P=0.498)、肝脏(F=2.37;P=0.095)和肌肉(F=1.73;P=0.298)组织干重的铜含量均无显著影响。重金属含量大小顺序为肝脏>鳃>肌肉(图6)。
3 讨论
3.1 水体铜离子对鲢幼鱼运动时长和呼吸频率的影响
运动时长和呼吸频率可作为直观判断鲢幼鱼运动能力强弱的参数指标, 本研究发现, 随着铜离子浓度升高, 鲢幼鱼对应的运动时长和呼吸频率均减小。相关研究表明低温胁迫对南方鲇(Silurus meridionalis)和瓦氏黄颡鱼(Pelteobaggrus vachelli)呼吸频率影响明显[16], 姜礼潘等[6]也发现热污染对鱼类呼吸频率影响显著, 随着温度的升高而逐渐变大。水体铜离子对杂交鲟白细胞、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性的影响表现出一定剂量效应关系: 同一浓度时, 随着暴露于铜离子的时间延长, 各指标逐渐降低且白细胞和抗氧化酶活性明显降低, 说明高浓度水体铜抑制其免疫和抗氧化功能, 随着浓度的增大, 杂交鲟的呼吸频率和摆尾频率逐渐减小[17];黄溢明等[18]在研究重水体铜离子对鲫(Carassius auratus)和鲤(Cyprinus carpio)呼吸机能影响时发现, 鲤科鱼对重金属离子较为敏感, 铜离子易与鳃上皮分泌的黏液结合成一种不溶解性的金属蛋白质化合物, 影响呼吸作用, 浓度越大, 影响越严重,结果与本研究相似。
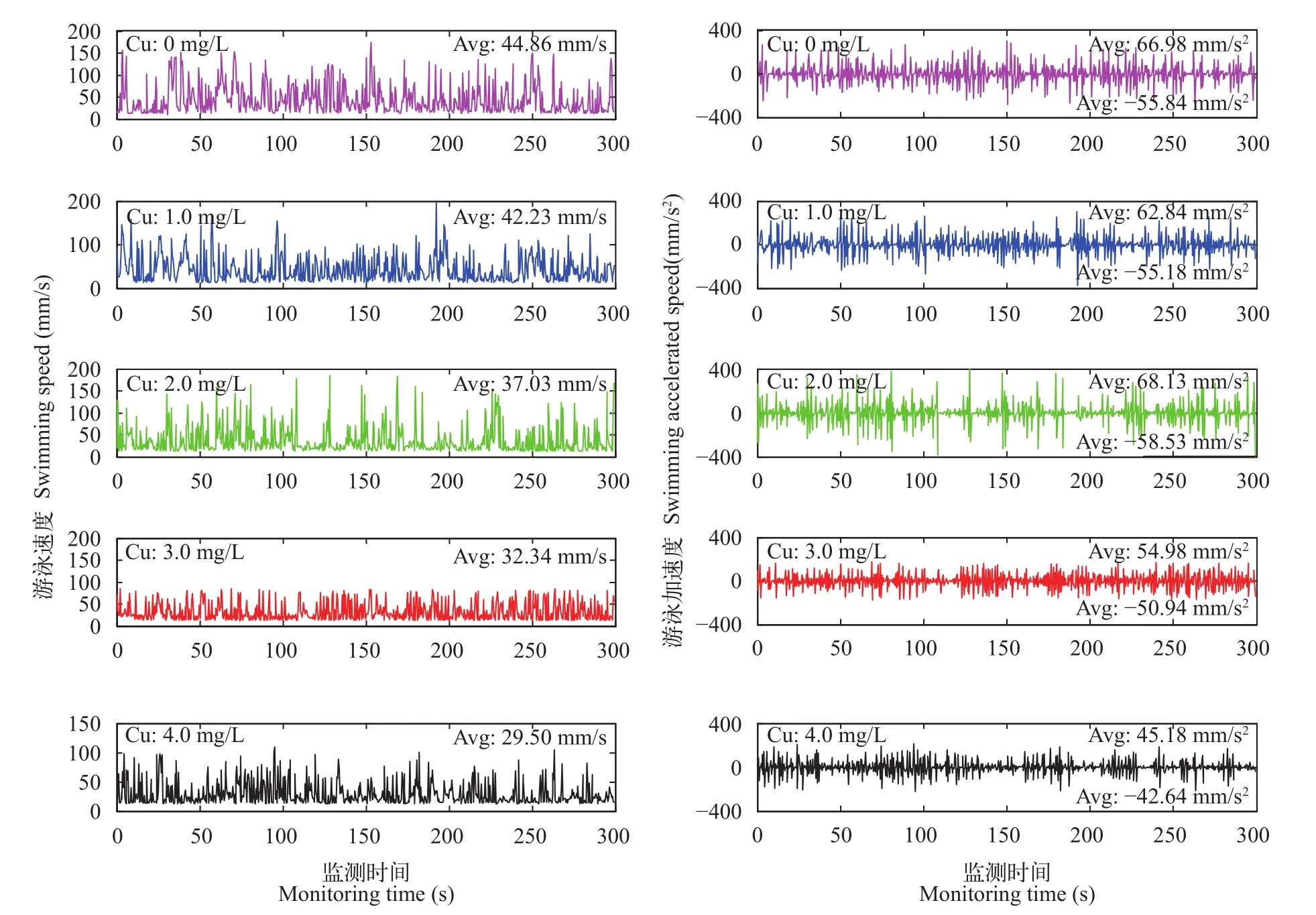
图4 急性铜暴露对鲢幼鱼5min内速度和加速度的影响Fig. 4 The effect of acute copper exposure on the velocity and acceleration of juvenile silver carp in 5min period
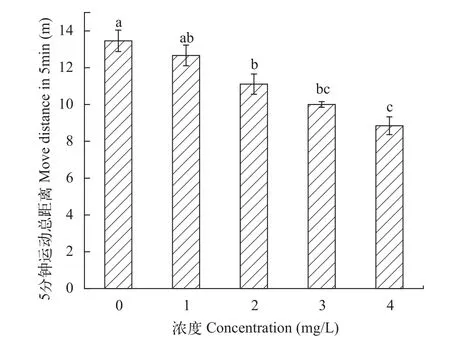
图5 急性铜暴露对鲢幼鱼5min运动总距离的影响Fig. 5 The effect of acute copper exposure on total distance of juvenile silver carp in a 5-min period
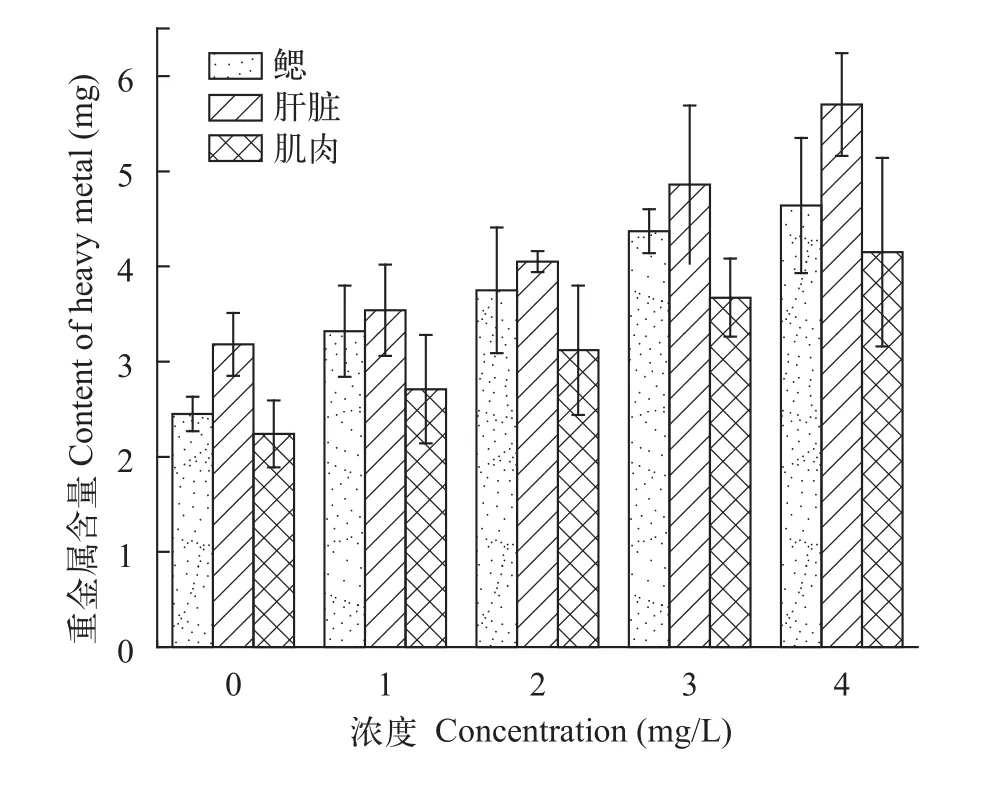
图6 急性铜暴露后铜离子在鲢幼鱼鳃, 内脏及肌肉中的含量Fig. 6 Copper contents of gill, liver and muscle of juvenile silver carp after acute exposure
3.2 水体铜离子暴露对鲢幼鱼游泳行为的影响
游泳速度是鱼类游泳能力最为直接的评价指标, 主要包括巡航(续航)游泳速度、冲刺游泳速度、临界游泳速度等。目前, 越来越多的学者倾向于使用临界游泳速度评价鱼类的游泳能力, 但在整个鱼类生活史来看, 鱼类的巡航速度是最常用的1个指标, 并且鱼类对环境变化反应敏锐, 因此研究鱼类自发游泳速度的变化可以作为检测水体污染严重程度的一个重要指标。Huang等[13]利用视频技术研究斑马鱼对不同溴氰菊酯浓度短暂暴露后行为响应关系时发现, 在实验开始阶段, 游泳速度先增加后降低; Zhu等[12]在利用立体视觉系统实时监测水生生物的3D行为时发现, 随着酒精浓度的增加, 金鱼(Carassius auratus)的速度, 5min运动的总路程呈增加趋势, 这些游泳速度, 总路程, 总转角等可以很好的描述鱼类的自发运动, 这种详细、连续振荡型动物运动信息更有说服力, 更利于系统分类和精确区分复杂的动物表型。中华倒刺鲃幼鱼在急性铜暴露96h后, 其相对临界游泳速度、相对爆发游泳速度、最大代谢率受铜暴露影响显著, 铜暴露导致以上各参数值下降[8]; 草鱼幼鱼的相对临界游泳速度以及耗氧率均暴露96h后呈下降趋势[9], 本研究发现随着铜离子浓度增大, 运动平均速度, 加速度和运动总路程均被抑制, 结果与上述研究相似[19—21]。据文献[22]报道, 水体中的铜会影响鱼体内琥珀酸脱氢酶(SDH)的活性, 从而影响体内有氧代谢, 使鱼类游泳速度, 运动路程降低, 这也可能是本研究中的鲢在铜溶液中暴露后游泳能力下降的原因。标记与监测技术直接决定了行为学研究的尺度和精度, 近年来, 水生动物行为学的研究开始采用基于计算机视觉系统的图像处理技术, 潘洋等[23]通过视频检测方法, 建立了刺参运动行为评价体系,以运动路程、累积运动时间、平均运动速度和最大运动速度为实验指标, 综合评价刺参的运动行为生态特征, 为刺参的野外检测和水产养殖提供了精确的数据支持。通过鱼的游泳速度、加速度、运动总路程等行为特征来反应水体的污染程度, 比使用致死率更迅速、准确, 且更适合用于野外在线监测。
3.3 鲢幼鱼鳃、肝脏和肌肉组织铜含量特征
高浓度的Cu对于鱼类的行为反应、生理指标和组织结构等产生较大影响, 可表现出较强的毒性,引起鱼类中毒甚至死亡[24], 但是由于不同区系生物受生活环境等因素的影响, 对铜的耐受性和敏感度存在很大的差异[25], Gioda等[1]对脂鲤(Leporinus obtusidens)进行了长期铜暴露研究发现铜暴露处理后脂鲤肝和肌肉中的铜含量与对照组无显著差异;而张怡等[8]对中华倒刺鲃用急性铜暴露96h后发现,鱼体肝脏、鳃和肌肉组织铜含量无显著变化的情况, 袁喜等[9]在研究急性铜对草鱼的影响时也发现类似规律。在本研究中, 水体铜暴露对鲢幼鱼肝脏、鳃和肌肉组织铜含量影响均不显著, 和上述结果相近, 鳃直接暴露在重金属环境中, 因而测得积累较大; 肝脏是金属硫蛋白(Cu-MT)合成的主要场所, 含量增加明显; 而肌肉代谢较慢, 而且没有直接暴露于重金属[26,27]。因此, 鱼类对重金属的累积量为肝脏>鳃>肌肉。Cu-MT含量增加, 加速了Cu2+在鱼体内的代谢进程, 多余的Cu2+结合蛋白进入血液循环, 并排泄到体外[28]。因此急性铜暴露后, 各组织重金属累积量均无显著差异。重金属产生的环境胁迫产生的应激行为反应机理十分复杂, 有待进一步的研究。
[1]Gioda C R, Loro V L, Pretto A,et al. Sublethal zinc and copper exposure affect acetylcholinesterase activity and accumulation in different tissues ofLeporinus obtusidens[J].Bulletin of Environmental Contamination and Toxicology, 2013, 90(1): 12—16
[2]Eyckmans M, Celis N, Horemans N,et al. Exposure to waterborne copper reveals differences in oxidative stress response in three freshwater fish species [J].Aquatic Toxicology, 2011, 103(1): 112—120
[3]Barwick M, Maher W. Biotransference and biomagnification of selenium copper, cadmium, zinc, arsenic and lead in a temperate seagrass ecosystem from Lake Macquarie Estuary, NSW, Australia [J].Marine Environmental Research, 2003, 56(4): 471—502
[4]Hu Z Z. Biomagnincation of Heavy Metalsin Common Fish from Mangrove Areas of China [D]. Xiamen University, 2009 [虎贞贞. 红树林地区常见鱼类对重金属的生物放大作用的研究. 厦门大学, 2009]
[5]Wang S Y, Liao W G, Chen D Q,et al. Analysis of ecohydrological characteristics of the four chinese farmed carps spawning grounds In the middle reach of the Yangtze River [J].Resources and Environment in the Yangtze Basin, 2008, 17(6): 892—897 [王尚玉, 廖文根,陈大庆, 等. 长江中游四大家鱼产卵场的生态水文特性分析. 长江流域资源与环境, 2008, 17(6): 892—897]
[6]Jiang L P, Huang M G. The influence of heavy metals to embryonic development of grass carp, silver carp [J].Environmental Science, 1979, 1(2): 2 [姜礼燔, 黄穆桂. 重金属对草鱼、鲢鱼胚胎发育的影响. 环境科学, 1979,1(2): 2]
[7]Gao X L, Yue S Q,W L M,et al. Primary report on effects of heavy metals on activities of SOD and CAT in the liver tissue of Silver carp [J].Journal of Agricultural University of Hebei, 2003, 26(4): 130 [高晓莉, 岳淑芹, 王丽敏,等. 重金属对鲢鱼肝组织SOD和CAT活性影响研究简报. 河北农业大学学报, 2003, 26(4): 130]
[8]Zhang Y, Xia J G, Cao Z D,et al. Effects of acute copper exposure on the swimming performances of juvenile Spinibarbus [J].Chinese Journal of Ecology, 2013, 32(9):2451—2456 [张怡, 夏继刚, 曹振东,等. 急性铜暴露对中华倒刺鲃幼鱼游泳能力的影响. 生态学杂志, 2013,32(9): 2451—2456]
[9]Yuan X, Huang Y P, Jing J J,et al. Effect of copper exposure on metabolism behavior of juvenile grass carp(Ctenopharyngodon idella) [J].Journal of Agro-Environment Science, 2016, 35(2): 261—265 [袁喜, 黄应平, 靖锦杰, 等. 铜暴露对草鱼幼鱼代谢行为的影响. 农业环境科学学报, 2016, 35(2): 261—265]
[10]Zhu L, Weng W. Catadioptric stereo-vision system for the real-time monitoring of 3D behavior in aquatic animals[J].Physiology & Behavior, 2007, 91(1): 106—119
[11]Rillahan C, Chambers M D, Howell W H,et al. The behavior of cod (Gadus morhua) in an offshore aquaculture net pen [J].Aquaculture, 2011, 310(3): 361—368
[12]Shi X T, Hu Y S, Wang B,et al. Using free software Swis Track to learn swimming behavior of silver carp [J].Acta Hydrobiologica Sinica, 2014, 1(3): 588—591 [石小涛,胡运燊, 王博,等. 运用免费计算机软件Swis Track分析鲢幼鱼游泳行为. 水生生物学报, 2014, 1(3): 588—591]
[13]Huang Y, Zhang J, Han X,et al. The use of zebrafish(Danio rerio) behavioral responses in identifying sublethal exposures to deltamethrin [J].International Journal of Environmental Research and Public Health, 2014,11(4): 3650—3660
[14]McKenzie D J, Martinez R, Morales A,et al. Effects of growth hormone trans genesis on metabolic rate, exercise performance and hypoxia tolerance in tilapia hybrids [J].Journal of Fish Biology, 2003, 63(2): 398—409
[15]Yu X, Hou X J, Lu H D,et al. Anomaly detection of fish school behavior based on features statistical and optical flow methods [J].Transactions of the Chinese Society of Agricultural Engineering, 2014(2): 162—168 [于欣, 侯晓娇, 卢焕达, 等. 基于光流法与特征统计的鱼群异常行为检测. 农业工程学报, 2014(2): 162—168]
[16]Peng J L, Cao Z D, Fu S J. Effect of acute low temperature stress on oxygen consumption rate and ventilation frequency inSilurus meridionalisandPelteobag vachelli[J].Agricultural Science & Technology, 2007, 35(25):73—78 [彭姜岚, 曹振东, 付世建. 急性低温胁迫对南方鲇和瓦氏黄颡鱼耗氧率和呼吸频率的影响. 安徽农业科学, 2007, 35(25): 73—78]
[17]Zhang H. Effect of four kinds of heavy metal ions on the behavioral and physiological index of hybrid sturgeon[D]. Agricultural University of Hebei. 2014 [张华. 四种重金属离子对杂交鲟行为及生理指标的影响. 河北农业大学, 2014]
[18]Huang Y M, Mou L Y, Ma J C,et al. The effects of heavy metal ions on the respiratory movements in carp and crueian carp [J].Acta Scifntiarum Naturalium Universitatis Sunyaatseni, 1987(4): 84—89 [黄溢明, 牟凌云, 马际春, 等. 重金属离子对鲫鱼和鲤鱼呼吸运动机能的影响. 中山大学学报: 自然科学版, 1987(4): 84—89]
[19]Mallatt J. Fish gill structural changes induced by toxicants and other irritants: a statistical review [J].Canadian Journal of Fisheries & Aquatic Sciences, 1985,42(4): 630—648
[20]John K R, Jayabalan N. Sublethal effects of endosulfan on the histology and protein pattern of Cyprinuscarpio, gill[J].Journal of Applied Ichthyology, 1993, 9(9): 49—56
[21]Pinkney A E, Wright D A, Hughes G M. A morphometric study of the effects of tributyltin compounds on the gills of the mummichog,Fundulus heteroclitus[J].Journal of Fish Biology, 2006, 34(5): 665—677
[22]Thirumavalavan R. Effect of copper on carbohydrate metabolism fresh water fish, Catlacatla [J].Asian Journal of Science and Technology, 2010, 5: 95—99
[23]Pan Y. Quantitative research on motor behavioral rhythms of sea cucumberApostichopus japonicus(Selenka)[D]. Institute of Oceanology, Chinese Academy of Sciences. 2015 [潘洋. 刺参运动节律行为的数量化研究. 中国科学院研究生院(海洋研究所). 2015]
[24]Cai W C, Qu Y J. Toxicity of Cu2+to fish during early developmental stages [J].South China Fisheries Science,2009, 5(5): 75—79 [蔡文超, 区又君. 重金属离子铜对鱼类早期发育阶段的毒性. 南方水产, 2009, 5(5): 75—79]
[25]Wang Z, Jin X W, Wang Z J. Taxon-specific sensitivity differences of copper to aquatic organisms [J].Asian Journal of Ecotoxicology, 2014, 9(4): 640—646 [王振,金小伟, 王子健. 铜对水生生物的毒性:类群特异性敏感度分析. 生态毒理学报, 2014, 9(4): 640—646]
[26]Zhou X W, Zhu G N, Jilisa M,et al. Effects of the interaction of copper, zinc and cadmium on the accumulation of lead in the tissues of theCarassius auratus[J].Agro-environmental Protection, 2002, 21(1): 23—25 [周新文, 朱国念, Jilisa M, 等. 重金属离子Cu Zn Cd的相互作用对Pb在鲫鱼组织中积累的影响. 农业环境科学学报, 2002,21(1): 23—25]
[27]Zhou Y F, You Y, Wu W,et al. Dynamic changes of metallothioneinn in different tissues ofCarassius auratusexposed to different concentrations of zinc [J].JiangsuJournal of Agricultural Sciences, 2009, 25(4): 18—21 [周彦锋, 尤洋, 吴伟, 等. 重金属锌胁迫下鲫鱼不同组织中金属硫蛋白的动态变化. 江苏农业学报, 2009, 25(4):18—21]
[28]Ghedira J, Jebali J, Bouraoui Z,et al. Metallothionein and metal levels in liver, gills and kidney of Sparusaurata exposed to sublethal doses of cadmium and copper [J].Fish Physiology & Biochemistry, 2010, 36(1): 101—107
