棘胸蛙致病性蜡样芽孢杆菌的分离鉴定及病理组织观察
2018-01-24吕耀平刘子明黄富友傅旭豪
吕耀平 金 晶 施 倩 陈 洁 刘子明 陆 君 黄富友 傅旭豪
(1. 丽水学院生态学院, 丽水 323000; 2. 宁波大学海洋学院, 宁波 315211; 3. 丽水市中心医院, 丽水 323000;4. 丽水市水产技术推广站, 丽水 323000)
棘胸蛙(Quasipaa spinosa)俗称石蛙、石鸡, 分布在我国浙江、江西、福建和湖南等省, 因其肉质鲜美, 富含赖氨酸、亮氨酸等多种人体必需氨基酸,具有较高的食用与药用价值[1], 为近几年蛙类养殖的主要品种之一。棘胸蛙养殖环境要求较高, 极易受到病害侵袭, 其中烂皮病是养殖过程中较为常见的病害之一[2], 发病初期表现为食欲减退, 头背部皮肤变淡无光泽, 发病后期出现溃烂, 严重时指骨和和颌骨外露, 关节肿大。同时该病具有传染性, 死亡率极高, 给生产带来了极大的损失[3]。皮肤作为两栖类防御外部侵害的第一道防线, 可以抵御病原体感染, 防止皮肤表层水分的流失, 同时其特殊的生理化学构造蕴藏着丰富的微生物群落, 形成的共生系统为两栖类生存必不可缺的[4,5]。烂皮病的发生直接破坏了棘胸蛙第一道免疫防线, 因此了解该病的发病机制对防治病害具有重要意义。本试验从患烂皮病病蛙中分离筛选病原菌, 对其进行革兰氏染色、形态观察、生理生化和分子鉴定, 观察回归感染后病蛙主要组织器官的病理变化, 初步探究棘胸蛙烂皮病的发病机理, 并进一步研究致病菌的药敏特性, 旨在丰富棘胸蛙病原资料以及为棘胸蛙的病害防治提供理论依据。
1 材料与方法
1.1 实验材料
患烂皮病和健康棘胸蛙均由浙江省丽水市鼎鑫生物工程有限公司提供, 病蛙5只, 规格为(175±25) g/只。健康成蛙50只, 规格为(100±16) g/只。
1.2 病症观察
观察病蛙的外观症状, 在解剖镜下观察病蛙的皮肤及内脏并用Nikon数码相机拍照记录。取腹水进行水浸片观察, 排除霉菌和寄生虫感染后, 再进行细菌的分离与纯化培养。
1.3 病原菌分离纯化
在无菌条件下, 取患病棘胸蛙肝脏、肌肉、肠等组织, 于无菌玻璃匀浆器中研磨、稀释后涂布于营养琼脂培养基, 28℃培养24h后, 肉眼观察菌落形态、大小、隆起度、颜色等, 挑取不同形态单个优势菌落分别接种于绵羊血琼脂培养基, 28℃培养24h后观察菌落生长及溶血情况, 将具有溶血性的单菌落于胰蛋白胨大豆琼脂固体培养基(TSA) 28℃下进行纯化培养[6]。
1.4 病原菌的鉴定
革兰氏染色取28℃培养24h的细菌培养物,根据何昭阳等[6]方法进行革兰氏染色鉴定, 用草酸铵结晶紫初染、碘液媒染、95%乙醇脱色、番红染色液复染, 干燥后于光学显微镜(麦克奥迪实业集团有限公司, BA210)下观察并记录。
生化鉴定取28℃培养24h细菌培养物按照李绍戊等[7]方法进行糖发酵(蔗糖、葡萄糖、麦芽糖、纤维二糖、乳糖、鼠李糖、蕈糖、阿拉伯糖)、醇发酵(甘露醇、山梨醇)及其他生化实验(氧化酶、触酶、乙酰甲基甲醇(v-p)、丙二酸盐、柠檬酸盐、硫化氢、七叶苷、鸟氨酸脱羟酶、精氨酸双水解、赖氨酸脱羧酶、水杨苷、吲哚、明胶水解、硝酸盐、甲基红(M-R))。
16S rDNA鉴定取28℃培养24h菌悬液1 mL, 12000 r/min离心2min; 弃上清液, 加超纯水100 μL, 煮沸10min; 冰浴5min, 12000 r/min离心2min, 取上清液, -20℃保存, 备用。以菌株DNA为PCR扩增模板, 细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA基因, 引物由生工生物工程(上海)有限公司合成。
PCR反应条件: 25 μL反应体系, 每管依次加入超纯水17.5 μL、10×PCR Buffer 2.5 μL、dNTP mix(10 mmol/L each) 0.5 μL、上下游引物各1 μL、模板1 μL。94℃预变性5min, 以下条件PCR扩增:94℃变性45s, 55℃复性45s, 72℃延伸90s, 共33个循环, 72℃再延伸10min。PCR扩增后产物经 1% 琼脂糖凝胶电泳检测, 用AXYGEN琼脂糖凝胶DNA回收试剂盒回收纯化PCR产物。所得产物连接至pGEM-T载体后转化到大肠杆菌感受态细胞Top10, 阳性克隆送生工生物工程(上海) 有限公司测序。
1.5 人工回归感染实验
按照杭小英等[8]方法进行回归感染试验。取60只健康蛙, 于水箱中暂养2周。将筛选出的菌株接种于TSA平板上, 28℃培养24h, 用0.65%的无菌生理盐水洗下菌苔制成菌悬液, 梯度稀释使菌液浓度为104、105、106、107和108CFU/mL。试验采用肌肉注射法, 每组浓度各10只, 每只蛙注射剂量为0.5 mL, 对照组注射等量无菌0.65%生理盐水, 连续观察10d。
1.6 组织病理观察
按照樊威等[9]方法, 取人工染病棘胸蛙和健康棘胸蛙的肝、肌肉、肺、舌, 用10%的中性福尔马林固定, 石蜡包埋, 切片, HE染色, 中性树胶封片,于光学显微镜下观察并记录。
1.7 药物敏感性检测
取0.2 mL培养菌液均匀涂布于TSA琼脂平板上, 等距贴上药敏纸片4片/平板, 后将处理好的平板倒置于培养箱中, 28℃培养24h, 测定其抑菌圈直径(平行重复3次), 以平均值±标准差(x±SD)表示, 直径小于10 mm为不敏感或低度敏感, 10—15 mm为中度敏感, 大于15 mm为高度敏感[10]。选用常用药敏纸片: 妥布霉素、氨苄西林、头孢他啶、链霉素、卡那霉素、四环素和庆大霉素。
2 结果
2.1 病症观察
对健康的棘胸蛙和患病棘胸蛙进行外部特征和解剖观察(图1), 图1a和图1b为健康棘胸蛙的外部特征图和解剖图, 图1c和图1d为患病棘胸蛙的外部特征图和解剖图。由图可见患病棘胸蛙头部皮肤表层脱落, 真皮层腐烂, 露出肌肉(图1c), 解剖发现肝部严重充血、淤血(图1d)。取腹水水浸片观察, 未发现有霉菌和寄生虫感染。
2.2 病原菌的鉴定
革兰氏染色鉴定从患烂皮病棘胸蛙病灶部位分离筛选出3种菌, 分别将其命名为BS1、BS2和BS3, 其中BS1和BS3分离于肌肉中, BS2分离自肠, 在绵羊血琼脂培养基上均呈β-溶血。对其进行革兰氏染色鉴定(图2), 图2a、图2b和图2c分别为BS1、BS2和BS3的革兰氏染色图, 发现BS1、BS2和BS33种菌均为革兰氏阳性, 细胞呈杆状, 末端方, 以链状形式排列。
生化鉴定根据细菌手册[11]对BS1、BS2和BS3生理生化测定, 发现3种菌均不发酵甘露醇; 能液化明胶; 触酶阳性; 亚硝酸盐还原为阳性 (表 1)。
分子鉴定用细菌16S rDNA通用引物扩增BS1、BS2和BS3的16S rDNA基因, 将其与Gen-Bank数据库中已报道的16S rDNA基因序列进行BLAST比对, BS1、BS2和BS3与已知蜡样芽孢杆菌同源性分别为97%、93%、100%。
2.3 回归感染实验
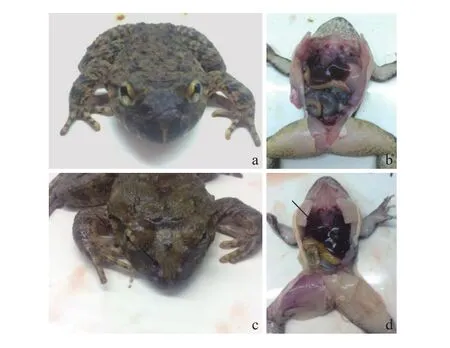
图1 患病棘胸蛙病变特征Fig. 1 Clinical signs of illness of Q. spinosa
人工感染试验分别以菌液浓度为7.1×104、7.1×105、7.1×106、7.1×107和7.1×108CFU/mL感染健康棘胸蛙, 试验发现细菌感染24h后, 发现部分染病棘胸蛙活动能力降低, 反应力变弱, 于水箱内静伏不动, 食欲减退, 吻部周围出现大小不规则的表皮溃疡斑, 病症与图1一致, 对照组显示健康。用SPSS 13.0软件进行统计分析后, 计算得到BS1、BS2和BS3三株菌株的LD50分别为4.09×107、2.50×106和 2.51×107CFU/mL (表 2)。
2.4 主要器官组织病理观察
观察人工感染蜡样芽孢杆菌棘胸蛙和健康棘胸蛙的病理组织切片(图3), 图3a、3b、3c和3d为健康肝部、舌部、肌肉和肺部组织切片图, 图3e、3f、3g和3h为患病组织切片图。染病棘胸蛙肝组织大面积细胞破裂, 核溶解(图3e); 舌组织肌肉溶解, 出现空泡, 早期能清楚看到横纹肌, 晚期横纹肌蜕变, 溶解(图3f); 肌肉糜烂, 组织渗出坏死, 出现炎症细胞, 有破裂核碎片出现(图3g); 肺部出现大量包涵体和炎症反应: ①肺泡腔增生, 肺泡腔胶原化(均质、粉碎), 出现波量变性; ②淋巴、浆细胞增多, 坏死不明显; ③出现渗出组织以及炎症反应(图3h)。

图2 致病菌的革兰氏染色Fig. 2 Gram staining of pathogenic bacteria
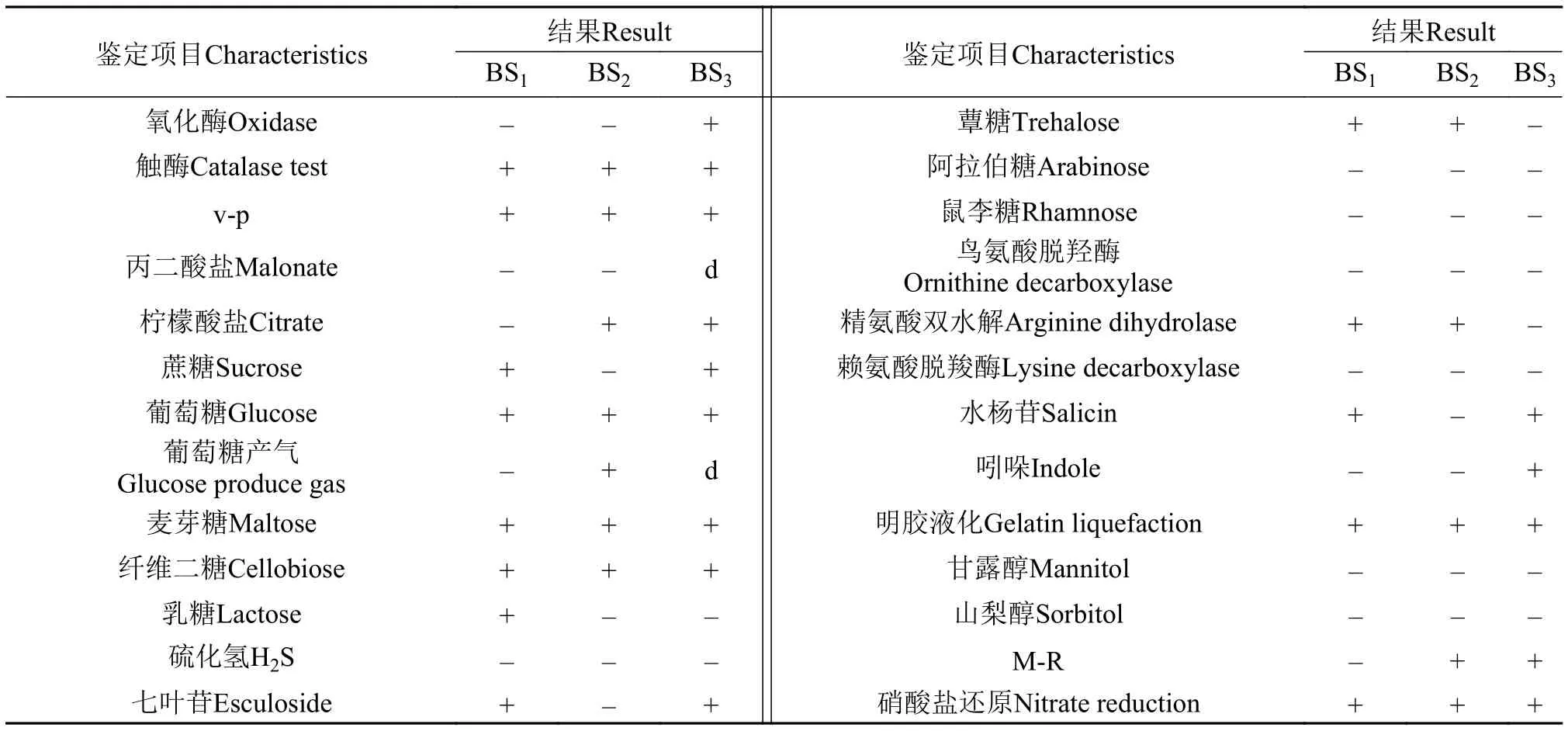
表 1 菌株的生理生化指标Tab. 1 Physiological and biochemical characteristics of the bacterial strains
2.5 抗生素敏感性试验
3株菌培养24h后对其进行抗生素敏感性试验,其抑菌圈大小如表 3所示, 根据卢静等[10]方法, 直径小于10 mm为不敏感或低度敏感, 10—15 mm为中度敏感, 大于15 mm为高度敏感, 可见3株菌均对氨苄西林和头孢他啶均不敏感, 对妥布霉素、四环素和卡那霉素表现出中度敏感, 此外BS1表现出对链霉素高度敏感, BS2和BS3对庆大霉素高度敏感。
3 讨论
烂皮病作为棘胸蛙养殖过程中的常见病之一,具有极强的感染性, 因此了解该病发病机理, 使之得到有效防治以此提高养殖经济效益具有重要意义。本试验从患烂皮病棘胸蛙中筛选出BS1、BS2和BS3三种致病菌, 对其进行革兰氏染色、形态观察、生理生化鉴定和16S rDNA序列分析, 鉴定这3株菌均为蜡样芽孢杆菌。同时, 观察人工感染蜡样芽孢杆菌棘胸蛙的病理组织切片, 发现经病原菌感染的棘胸蛙肝、肺、舌和肌肉的损伤较严重, 表现出明显变性、坏死和炎症细胞浸润, 且在肺部组织内发现嗜碱性包涵体。药敏试验表明, 在所试的7种抗生素中, 致病性蜡样芽孢杆菌对庆大霉素和链霉素高度敏感, 对妥布霉素、卡那霉素和四环素中度敏感, 对氨苄西林和头孢他啶产生抗药性。

表 2 分离菌株对棘胸蛙的致病性(死亡数/试验数)Tab. 2 The effect of artificial bacterial infection on the survival
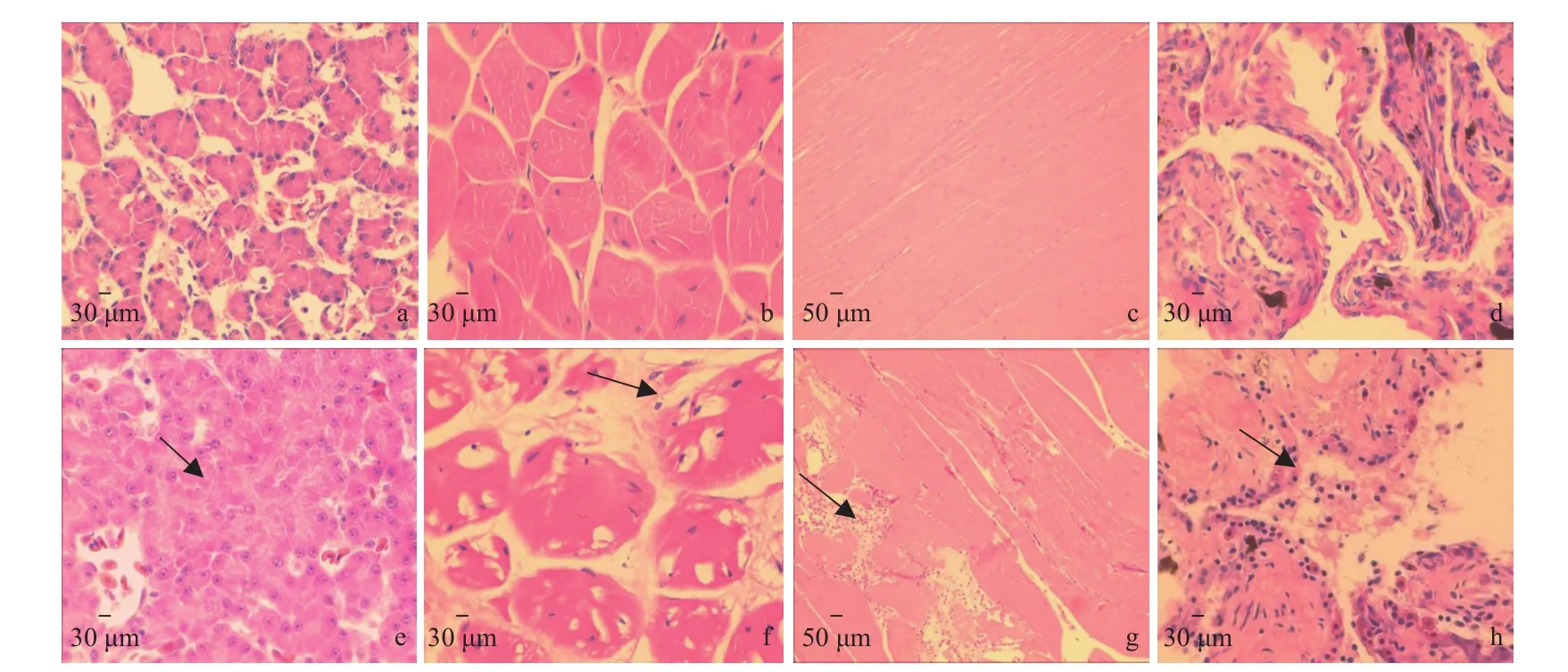
图3 患病棘胸蛙病理组织学特征(HE染色)Fig. 3 Histopathological features of diseased Q. spinosa

表 3 抗生素对菌株的抑制作用Tab. 3 Inhibition of antibiotics to bacterial strains
3.1 病原菌的分离与鉴定
引起烂皮病的原因有非感染性和感染性因素。非感染性因素包括在养殖过程中缺乏营养(如维生素A), 高温, 养殖密度较高引起过度拥挤导致受伤或接触到有毒物质[12—14]。但更多研究发现, 感染性因素如一些寄生虫[15]、真菌[16]、病毒[17]以及细菌才是造成烂皮病的主要原因。目前, 已被研究报道的细菌有嗜水气单胞菌[18]、奇异变形杆菌(Proteus vulgaris)[19]、克氏耶尔森氏菌(Yersinia Kiristensenii)[20]、荧光假单胞菌(Pseudomonas fluorescens)[21]等。实验在排除寄生虫感染的可能性下, 从病蛙病灶部位中分离筛选得到3种病菌BS1、BS2和BS3, 经革兰氏染色鉴定均为革兰氏阳性, 细胞呈杆状, 末端方, 以链状形式排列。生理生化特性鉴定, 发现3株菌均能分解葡萄糖、麦芽糖等, 不发酵阿拉伯糖、鼠李糖和甘露醇等; 不产H2S; 能液化明胶; 触酶阳性、亚硝酸盐还原、VP等试验呈阳性, 呈现蜡样芽孢杆菌的特性。本试验为进一步鉴定BS1、BS2和BS3, PCR扩增了3株菌16S rDNA基因序列, BLAST分析结果看, 菌株BS1、BS2和BS3与蜡样芽孢杆菌16S rDNA具有较高的同源性。综合细菌革兰氏染色、形态观察、生理生化特性和16S rDNA基因序列测定分析结果,菌株BS1、BS2和BS3为蜡样芽孢杆菌。
已知蜡样芽孢杆菌, 属于芽孢杆菌属(Bacillussp.), 革兰氏阳性好氧杆菌, 广泛存在于各种环境中,其无毒菌株已被作为益生菌应用于饲料、农业、水产养殖等各领域, 但其中部分菌株具有致病性[22]。谭爱萍等[23]从患病鳖中分离筛选得到的JY02、JY05、JY07和JY09均为蜡样芽孢杆菌, 经感染性试验证明对健康中华鳖具有较强的致病性。但目前关于棘胸蛙烂皮病的研究较少, 对蜡样芽孢杆菌引起棘胸蛙烂皮的研究更未见报道, 因此了解蜡样芽孢杆菌造成棘胸蛙烂皮的致病机理具有重要意义。
3.2 病原菌的致病性与致病机理
用蜡样芽孢杆菌进行人工回归感染试验后, 棘胸蛙在48h内相继出现了烂皮现象, 其病症表现与患烂皮病病蛙一致, 且不同的菌液浓度对棘胸蛙产生的致病程度存在差异。同时这3株蜡样芽孢杆菌对棘胸蛙产生不同的致病性, 根据SPSS 13.0软件得到的结果显示, BS1、BS2和BS3三株菌株对棘胸蛙的LD50分别为4.09×107、2.50×106和 2.51×107CFU/mL, 可见BS2的致病性最强。
为进一步了解蜡样芽孢杆菌造成棘胸蛙烂皮的致病机理, 实验对经蜡样芽孢杆菌感染的患病棘胸蛙和健康棘胸蛙进行病理观察, 对比结果显示病蛙肝部细胞大面积破裂, 核溶解; 舌部肌肉溶解, 出现空泡, 早期能清楚看到横纹肌, 晚期横纹肌蜕变,溶解; 烂皮部分肌肉糜烂, 组织渗出坏死, 出现炎症细胞, 有破裂核碎片出现; 肺部出现大量嗜碱性包涵体、嗜酸性包涵体和炎症反应。舒新华等[20]对牛蛙腐皮病的组织病理观察发现, 患部皮肤发生溃疡、腐烂, 肝、肾、脾、胃、肠等内部脏器发炎、坏死。另外, 由于微血管血液淤滞, 阻闭了局部的微循环, 导致了正常代谢发生障碍, 使受损脏器丧失其应有的机能, 引起主要脏器坏死, 从而加速病蛙死亡。钟蕾等[24]发现牛蛙腐皮病引起牛蛙死亡的重要原因是主要脏器的受损, 如肝、胃、肠和肾等, 导致正常代谢发生障碍; 同时病蛙的白细胞中出现嗜中性粒细胞和淋巴细胞, 这表明病蛙体内具有程度较重的炎症。研究发现肝、脾、肾的坏死和炎症, 细胞胞浆内出现嗜酸性或嗜碱性包涵体等都是确认蛙病菌感染的特异性病变[25,26]。由此对比可知, 实验中该致病性蜡样芽孢杆菌对棘胸蛙的肝部、肺部造成了极大的破坏, 导致了蛙自身代谢功能障碍, 解毒能力降低, 最终引起多器官坏死、衰竭引起死亡, 同时免疫系统的损伤, 具有防御作用的皮肤结构的破坏[27], 也会使得一些条件致病菌[28—30]的继发感染, 加速棘胸蛙的死亡。
3.3 病原菌对抗生素的敏感性差异
抗生素药物用于水生生物的病害防治一直取得了较好的效果, 但近几年, 由于抗生素药物的滥用, 细菌抗药性现象屡见不鲜。且不同菌种之间的抗药现象之间存在差异[31,32], 因此在养殖过程中谨慎使用抗生素, 有选择性地合理用药, 防止抗生素滥用及误用, 尽量防止细菌耐药性的产生与加重。关秀芝等[33]筛选得到的温和气单胞菌GXZ01菌株对丙氟哌酸、氨苄青霉素、新霉素和复方新诺明4种药物中度敏感; 对青霉素和乙酰螺旋霉素不敏感。本实验研究发现蜡样芽孢杆菌BS1、BS2和BS3均对氨苄西林和头孢他啶产生了抗药性, 而对庆大霉素表现了高度敏感性, 但缺乏长期效用,48h后庆大霉素的抑菌圈急剧缩小。因此在防治棘胸蛙烂皮病时可先庆大霉素, 24h后再配合施用链霉素, 应避免一药重复利用。
[1]Zhang D, Wang X C. Characteristics of protein from Chinese soft-shelled turtle meat (Trionyx sinensis) [J].Science and Technology of Food Industry, 2014, 35(15):356—359 [张丹, 王锡昌. 中华鳖肉蛋白质营养特征分析及评价. 食品工业科技, 2014, 35(15): 356—359]
[2]Song T T, Zhen R Q, Zhang J M,et al. A new type ofQuasipaa spinosadisease pathogen analysis [J].Journal of Fujian Fisheries, 2014, 36(5): 344—350 [宋婷婷, 郑荣泉, 张俊美, 等. 一种棘胸蛙新类型疾病病原分析. 福建水产, 2014, 36(5): 344—350]
[3]Deng D F, Liu Z Q. Countermeasures analysis ofRana spinosarotten-skin [J].Science Fish Farming, 2009(5):60 [邓德芳, 刘竹泉. 棘胸蛙烂皮病防治对策浅析. 科学养鱼, 2009(5): 60]
[4]Campbell C R, Voyles J, Cook D I ,et al. Dinudom. Frog skin epithelium: electrolyte transport and chytridiomycosis [J].Cell Biology, 2012, 44(3): 431—434
[5]Rollinssmith L A, Ramsey J P, Pask J D,et al. Amphibian immune defenses against chytridiomycosis: impacts of changing environments [J].Integrative Comparative Biology, 2011, 51(1): 552—562
[6]He Z Y, Hu G X, Wang C F. Animal Immunology Experiment Course [M]. Jilin Science and Technology Press.2003, 4 [何昭阳, 胡桂学, 王春凤. 动物免疫学实验技术.吉林科技出版社. 2003, 4]
[7]Li S W, Wang D, Lian H M,et al. Isolation, Identification and pathogenicity ofAeromonas salmonicidasubps.Achromogenesfrom atlantic salmon (Salmo salar) [J].Acta Hydrobiologica Sinica, 2015, 39(1): 23—39 [李绍戊, 王荻, 连浩淼, 等. 大西洋鲑杀鲑气单胞菌无色亚种的分离鉴定和致病性研究. 水生生物学报, 2015, 39(1):23—39]
[8]Hang X Y, Zhou D R, Ye X P,et al. Isolation and identification on the pathogen of bullfrogstreptoccusdisease[J].Acta Hydrobiologica Sinica, 2012, 36(2): 361—364[杭小英, 周冬仁, 叶雪平, 等. 牛蛙无乳链球菌病病原的分离鉴定. 水生生物学报, 2012, 36(2): 361—364]
[9]Fan W, Duan Y J, Huang X L,et al. Pathological changes and etiological diagnosis in farmed adult rainbow trout(Oncorhynchus mykiss) associated with a low mortalty[J].Acta Hydrobiologica Sinica, 2016, 40(2): 287—293
[10]Lu J, Wang Z N, Chen R,et al.In vitroantibacterial activity of several Chinese medicine monomers and antibiotics onAeromonas hydrophilaandAeromonas sobria[J].Acta Hydrobiologica Sinica, 2013, 37(6):1128—1132 [卢静, 王振宁, 陈锐, 等. 几种中药单体和抗生素对嗜水气单胞菌及温和气单胞菌的体外抑菌活性研究. 水生生物学报, 2013, 37(6): 1128—1132]
[11]Buchanan R E, Gibbons N E. Bergey’s Manual of Determinative Bacteriology (version 8) [M]. Beijing: Science Press. 1984, 729—733
[12]Cai S J.Rana catesbeianarotted-skin disease etiology and prevention measures [J].New Countryside, 2013(10):34 [蔡思杰. 牛蛙烂皮病的发病原因及防治措施. 新农村, 2013(10): 34]
[13]Chen S L, Zhang Y X, Liu H G. Investigation and analysis ofRana spinosadisease factor [J].Chinese Journal of Zoology, 1995, 30(3): 9—12 [陈世濂, 张艳璇, 刘浩官.棘胸蛙病害因子的调查与分析. 动物学杂志, 1995,30(3): 9—12]
[14]Kahraman BB, Sığırcı BD, Metiner K,et al. Isolation ofChrysosporium guarroiin a Green Iguana (Iguana iguana), in Turkey [J].Journal of Exotic Pet Medicine,2015, 24(4): 427—429
[15]Christin M S, Gendron A D, Brousseau P. Effects of agricultural pesticides on the immune system ofRana pipiensand on its resistance to parasitic infection [J].Environmental Toxicology & Chemistry, 2003, 22(5): 1127—1133
[16]Myers J M, Ramsey J P, Blackman A L,et al. Synergistic inhibition of the lethal fungal pathogenBatrachochytrium dendrobatidis: the combined effect of symbiotic bacterial metabolites and antimicrobial peptides of the frogRana muscosa[J].Journal of Chemical Ecology,2012, 38(8): 958—965
[17]Sthr A C, Blahak S, Heckers K O,et al. Ranavirus infections associated with skin lesions in lizards [J].Veterinary Research, 2013, 44(1): 1—10
[18]Ma Y Z, He L, Xu H S. Isolation, identification and drug susceptibility test of pathogenicAeromonas hydrophilafromQuasipaa spinosa[J].Heilongjiang Animal Science and Veterinary Medicine, 2013(11): 116—117 [马有智,何琳, 徐海圣. 石蛙致病性嗜水气单胞菌的分离、鉴定及药敏试验. 黑龙江畜牧兽医, 2013(11): 116—117]
[19]Wang R J, Xiong X J. Isolation, identification and drug sensitivity tests ofProteus mirabilisfrom rotten-skin disease ofRana spinosa[J].Freshwater Fisheries, 2012,42(4): 31—34 [王瑞君, 熊筱娟. 棘胸蛙烂皮病奇异变形杆菌的分离、鉴定及对药物敏感性研究. 淡水渔业,2012, 42(4): 31—34]
[20]Shu X H, Xiao K Y, Jin X L,et al. Studies of the pathogenic bacteria of the rotten-skin disease of bullfrog [J].Journal of Fisheries of China, 1997, 21: 71—76 [舒新华,肖克宇, 金燮理, 等. 牛蛙腐皮病致病细菌的初步研究.水产学报, 1997, 21: 71—76]
[21]Shu X H, Jin X L, Xiao K Y,et al. Studies on the pathogenic bacterial of the rotten-Skin and red-leg disease of the bullfrog [J].Life Science Research, 1997, 1(1):54—59 [舒新华, 金燮理, 萧克宇, 等. 牛蛙腐皮-红腿病并发症致病菌研究Ⅱ荧光假单胞菌的分离和鉴定. 生命科学研究, 1997, 1(1): 54—59]
[22]Banerjee M, Nair G B, Ramamurthy T. Phenotypic & genetic characterization of Bacillus cereus isolated from the acute diarrheal patients [J].Indian Journal of Medical Research, 2011, 133(1): 88—95
[23]Tan A P, Zhao F, Jiang L,et al. Isolation and identification ofBacillus cereusfromTrionyx sinensis[J].Guangdong Agricultural Sciences, 2011, 38(20): 115—119 [谭爱萍, 赵飞, 姜兰. 中华鳖致病性蜡样芽孢杆菌的分离鉴定与特性分析. 广东农业科学, 2011, 38(20):115—119]
[24]Zhong L, Liu X Y, Chen K J,et al. Pathology of blood and tissue bullfrog skin fester disease [J].Reservoir Fisheries, 2006, 26(4): 90—91 [钟蕾, 刘晓燕, 陈开健, 等. 牛蛙腐皮病的血液与组织病理学研究. 水利渔业, 2006,26(4): 90—91]
[25]Robert J, Gregory Chinchar V. “Ranaviruses: an emerging threat to ectothermic vertebrates” report of the first international symposium on ranaviruses, Minneapolis MN July 8, 2011 [J].Developmental & Comparative Immunology, 2012, 36(2): 259—261
[26]Miller D, Gray M, Storfer A. Ecopathology of ranaviruses infecting amphibians [J].Viruses, 2011, 3(11):2351—2373
[27]Geng Y, Wang K Y, Li C W. Pathological changes of cultured Chinese giant salamanders (Andrias davidianus)naturally infected with ranavirus [J].Chinese Journal of Veterinary Science, 2011, 31(11): 1640—1644 [耿毅, 汪开毓, 李成伟. 养殖大鲵蛙病毒自然感染的病理形态学观察. 中国兽医学报, 2011, 31(11): 1640—1644]
[28]Whitfield S M, Geerdes E, Chacon I,et al. Infection and co-infection by the amphibian chytrid fungus and ranavirus inwild Costa Rican frogs [J].Diseases of Aquatic Organisms, 2013, 104(2): 173—178
[29]Miller D, Gray M, Storfer A. Ecopathology of ranaviruses infecting amphibians [J].Viruses, 2011, 3(11):2351—2373
[30]Chen H W, Lin T Y. Tumor abscess formation caused byMorganella morganiicomplicated with bacteremia in a patient with gastrointestinal stromal tumor [J].Clinics and Research in Hepatology and Gastroenterology, 2012,36(2): 29—31
[31]He S Y, Ye H, You L. Isolation and identification of pathogenic bacteria of gill rot disease fromAndrias davidianusand drug sensitivity test [J].Guizhou Agricultural Sciences, 2014, 42(6): 109—112 [贺胜英, 叶华, 游玲. 大鲵烂鳃病病原菌的分离鉴定及药敏试验. 贵州农业科学, 2014, 42(6): 109—112]
[32]Lan Y, Hu X C, Lü A J. Isolation, identification and antibiotic sensitivity test ofMorganella morganiifromMauremys mutica[J].Acta Hydrobiologica Sinica, 2014,38(6): 1173—1178 [兰云, 胡秀彩, 吕爱军. 黄喉拟水龟摩氏摩根菌的分离鉴定及药敏试验. 水生生物学报,2014, 38(6): 1173—1178]
[33]Guan X Z, Li S Z, Zhang F P. Isolation, identification and drug sensitive test ofAeromonas sobriaon pathogens of skin ulcer fromTinca tinca[J].Chinese Agricultural Science Bulletin, 2012, 28(26): 115—118 [关秀芝, 李胜忠,张凤萍, 等. 丁鱼岁“腐皮病”病原菌的分离鉴定与药敏试验. 中国农学通报, 2012, 28(26): 115—118]
