斑点叉尾鲖源海豚链球菌Srr蛋白海藻酸钠-壳聚糖口服疫苗的制备及其免疫效果研究
2018-01-24王兴丽汪开毓王二龙陈德芳
王兴丽 汪开毓 王二龙 王 涛 杨 倩 陈德芳 耿 毅
(1. 四川农业大学动物医学院, 成都 611130; 2. 四川农业大学动物科技学院, 成都 611130)
海豚链球菌(Streptococcus iniae, 曾用名Streptococcus shiloi), 隶属于链球菌科(Streptococcaceae),链球菌属(Streptococcus)。自1976年Pier和Madin[1]从亚马逊河河豚皮肤中初次分离出海豚链球菌后,该菌便在北美洲、中东、亚太地区以及欧洲蔓延开来, 主要感染淡水和海水鱼[2—5]。曾经的海豚链球菌被认为对斑点叉尾鲙不敏感, 但是最近几年,海豚链球菌从斑点叉尾鲙上频频被分离出来, 且在中国多地出现暴发性流行, 对斑点叉尾鲙的健康养殖存在一定的威胁[6]。研究表明, 海豚链球菌可引起斑点叉尾鲙异常游动, 体色变深, 鳍条出血, 腹部膨大; 剖解可见内脏肿大、充血, 积满腹水, 肠炎等[7]。
海豚链球菌丝氨酸富集蛋白(Srr)是链球菌中一种重要的蛋白(GenBank登录号: CP005941.1, 对应蛋白登录号AGM97982.1), 具有一个3618 bp的开放阅读框, 预计编码蛋白125 kD, 且在C-端的第251—405个氨基酸残基之间含有一个碳端细菌纤维蛋白原结合黏附素超家族(SdeG_C_C_supperfamily)的保守结构域[8]。研究表明, Srr可能通过调控一些重要因子来影响细菌致病过程中的黏附、定殖以及在宿主体内存活等活动, 从而使细菌达到在宿主体内生存、繁殖和致病的目的[9,10]。由此可见Srr相关蛋白在链球菌对宿主的感染中起着相当重要的作用, 但目前关于海豚链球菌Srr蛋白疫苗的研究相对较少, 其作用机制有待进一步研究。
目前世界多数渔用疫苗是通过注射进行免疫,该方式不仅存在工作量大, 且易对鱼体造成应激等缺点; 相对于注射免疫, 口服免疫不仅操作方便, 且对鱼体应激反应小, 成为鱼类免疫最有前景的免疫方式之一, 而口服疫苗预防海豚链球菌病的研究还鲜有报道。本实验采用海藻酸钠和壳聚糖2种天然高分子聚合物作为海豚链球菌Srr蛋白的包被载体, 对微球制备后的包封率、载药率以及包被蛋白的抗原性进行了检测, 并通过微球拌饲投喂方式免疫斑点叉尾鲙, 利用免疫后的血清对其免疫指标进行测定, 最后通过相对保护率的测定综合判断该疫苗有望成为斑点叉尾鲙预防海豚链球菌病的候选疫苗, 且为海豚链球菌口服疫苗的研制及应用提供基础。
1 材料与方法
1.1 实验材料
斑点叉尾鲙源海豚链球菌(DGX07, 登录号:FJ951434)由四川农业大学鱼病研究中心分离保存。海豚链球菌Srr蛋白由四川农业大学鱼病研究中心进行生物信息学分析、克隆表达、纯化并保存(70 kD左右)。海藻酸钠、壳聚糖购自上海生物工程有限公司, 食品级液体石蜡、Span-80、氯化钙和乙酸钠等均购自成都科龙试剂厂。健康斑点叉尾鲙购自四川成都某斑点叉尾鲙养殖基地, 体重(50±5) g。HRP goat anti-rabbit IgG购自百奇生物科技有限公司; 兔抗斑点叉尾鲙IgM血清由本实验室提供; 可溶型单组分TMB底物溶液购自北京天根生化科技有限公司; 总蛋白检测试剂盒、溶菌酶检测试剂盒、总超氧化物歧化酶检测试剂盒均购自南京建成科技有限公司。
1.2 海藻酸钠-壳聚糖-海豚链球菌Srr蛋白微球疫苗以及空微球的制备
1.5 %浓度海藻酸钠溶液与2 mg/mL的Srr蛋白(空微球的制备是将Srr蛋白替换为PBS)充分混合,将混合溶液按4鲶6缓慢滴加到食品级液体石蜡(含乳化剂Span-80和硬脂酸镁)中, 1800 r/min搅拌, 待充分乳化后, 将8%浓度(M/V)CaCl2溶液加入乳化好的海藻酸钠蛋白中钙化形成微球, 8000 r/min离心5min收集沉淀, 用0.01 mol/L的乙酸钠(pH=4.0)洗涤液清洗3次, 再与0.8%浓度的壳聚糖(pH=5的乙酸钠配制)1800 r/min混匀10min, 8000 r/min离心5min收集沉淀, 同上洗涤3次后相同缓冲液重悬, 加入等体积的2%的甘露醇搅拌均匀, 冻干保存。
1.3 微球粒径、包封率、载药率以及抗原性检测
微球粒径参考阳磊等[11]的实验方法计算微球粒径。
包封率及载药率将收集到的一定量的微球重悬, 取3 mL微球悬液离心, 将得到的微球加入到适量PBS溶液中超声破碎, 充分溶解。再将溶液10000 r/min离心10min, 将所收集的上清液用Bradford法检测蛋白浓度, 按照公式计算包封效率和载药率:
包封效率(%)=(实际微球中的蛋白质量/理论微球中蛋白质量)×100%
载药率(%)=(实际微球中的蛋白质量/最后测得总质量)×100%
抗原性取一部分上清液利用兔抗组氨酸标签抗体(1鲶200稀释)和兔抗海豚链球菌抗体进行Western-Blot, 室验操作参考Jiang等[12]的方法。
1.4 分组及免疫
实验前随机剖检5尾斑点叉尾鲙检查其健康情况, 随后将健康斑点叉尾鲙240尾随机分为4组, 具体分组见表 1, 以下各组简称为Srr组、Srr微球组、空微球组以及对照组。各组实验前均驯养14d, 驯养后的鱼能每日进料情况良好。14d后, 将制备的微球疫苗定量与粉碎后的饲料粉末混合后再成型、干燥, 按照鱼体重的2%进行投喂, 各组均连续投喂14d。
1.5 样品采集与处理
免疫后第1—8周每周定时在每组随机选取5尾通过静脉采血0.2 mL, 血液室温静置2h后移入4℃冰箱过夜, 次日4000 r/min离心10min, 收集上清,-20℃保存。于免疫后第4周每组随机选取15尾斑点叉尾鲙进行S. iniae攻毒, 攻毒后24h和48h每组随机选取6尾鱼分别取其头肾和脾脏, 液氮研磨提取总RNA反转录cDNA后于-80℃保存备用。
1.6 间接ELISA检测血清抗体效价
方法参照任燕等[13]的方法通过间接ELISA法检测血清抗体效价。

表 1 免疫程序Tab. 1 Immunization program
1.7 非特异性指标的检测与分析
血清总蛋白、T-SOD以及溶菌酶的测定参照南京建成生物有限公司的试剂盒说明书进行, 并按说明书公式进行计算, 所得结果利用SPSS18.0 软件包进行统计分析, 比较各实验组与对照组的显著性差异, 其中P>0.05 为差异不显著, 0.01<P<0.05为差异显著,P<0.0l为差异极显著。
1.8 实时荧光定量PCR分析
参照Yang等[14]的引物设计合成斑点叉尾鲙EF-1α、IFN-γ、TNF-α、CD4L-2、MHC-IIβ的引物, 以EF-1α因子为内参基因, 采用荧光定量PCR测定斑点叉尾鲙IFN-γ、TNF-α、CD4L-2、MHCIIβ的表达影响。参照ABI公司SYBR@Green PCR Supermix染料说明书配置PCR反应体系进行反应,反应后进行PCR产物溶解曲线分析, 鉴定扩增产物。
实验中的每个样品有3个重复(n=3), 结果取其循环阈值(Ct)的平均值, 利用公式RQ=2-ΔΔCt计算斑点叉尾鲙头肾和脾脏中IFN-γ、TNF-α、CD4L和MHC-Ⅱ基因的相对表达量。其中ΔCt=目的基因平均Ct值-内参基因平均Ct值, ΔΔCt=实验组ΔCt-对照组ΔCt。所得结果利用SPSS18.0 软件包进行统计分析, 所有实验数据用Mean±SD表示, 各不同组织ΔCt值釆用独立样本t检验。P>0.05为差异不显著, 0.01<P<0.05 为差异显著,P<0.0l为差异极显著。
1.9 攻毒实验及相对保护率的测定
在免疫后第4周, 利用S.iniae(6×107cfu/mL)[7]对各组斑点叉尾鲙进行攻毒, 每组随机选取20尾,腹腔注射0.2 mL/尾, 记录攻毒后14d内各组鱼的发病及死亡情况, 另取濒死鱼的肝、肾进行接菌培养,确定病原菌种类。并计算相对保护率(Relative Percent Survival, RPS), 按下列公式计算:
RPS(%)=[(对照组死亡率-免疫组死亡率)/对照组死亡率]×100%
2 结果
2.1 微球疫苗包封率、载药率以及抗原性检测
利用显微镜对制备微球进行观察, 制得的微球形态呈圆形或椭圆形(图1), 粒径较为均-[(4.26±1.13) μm]。通过超声破碎后测得Srr蛋白微球疫苗的包封率为92.38%, 载药率为19.41%。Westernblot结果表明Srr蛋白微球与兔抗海豚链球菌抗体/兔抗组氨酸标签抗体均能结合, 在70 kD大小处有明显的条带, 表明微球中的蛋白具有较好的抗原性。
2.2 血清抗体水平
本实验采用了间接ELISA方法测定了Srr组、Srr微球组、空微球组以及对照组免疫后第1—8周的抗体消长规律(图2)。实验结果可见, 实验组可在第2周检测到抗体效价, 但是检测值较低, 随后开始增加, Srr组和Srr微球组均在第4周时实验组均达到峰值, 分别为0.85和0.99。从第5周开始实验组出现下降峰, 而对照组始终无特异性检出。虽然空微球组也有抗体效价的检出, 但是其持续时间较短。

图1 微球的形态以及Western-blot结果Fig. 1 The shape of alginate microparticles and result of Western-blotting analysis
2.3 血清总蛋白检测结果
如图3所示, 在免疫后的前3周, Srr组和Srr微球组血清总蛋白含量均极显著升高(P<0.01), 而空微球组和对照组均无明显差异。在实验的第4周, 所有实验组血清总蛋白含量极显著(P<0.01)或显著(P<0.05)高于对照组, 其中Srr微球组血清总蛋白含量最高。第5周后出现所有实验组均有所下降, 且均在第6周以后达到稳定状态。在整个实验期间,Srr微球组血清蛋白含量一直高于其他组。

图2 斑点叉尾鲙血清中的抗体水平Fig. 2 The antibody level in the serum of Ictalurus punctatus

图3 斑点叉尾鲙血清总蛋白含量变化Fig. 3 Changes of total protein content in serum of Ictalurus punctatus
2.4 血清T-SOD活力检测结果
如图4所示, 免疫后各实验组T-SOD活力均呈上升趋势, 在第3、4周时Srr组和Srr微球组的酶活力均极显著高于对照组(P<0.01), 且Srr微球组在第3周出现峰值, Srr组在第4周出现峰值。峰值后各实验组均出现下降峰, 但在第5周后便基本维持稳定。空微球组仅在第5周与对照组差异显著(P<0.05)。
2.5 血清溶菌酶活力检测结果
如图5所示, Srr微球组血清溶菌酶活力从免疫后第1—8周均极显著(P<0.01)高于对照组, 且在第2周达到峰值。Srr组在第4周达到峰值, 除了第2周,其余实验期间均显著或极显著高于对照组。空微球包被组在第6、7、8周显著(P<0.05)或极显著(P<0.01)高于对照组, 但在整个实验期间皆低于Srr组和Srr微球组。在整个实验期间, 对照组血清溶菌酶活力相对稳定在105—120 U/mL。
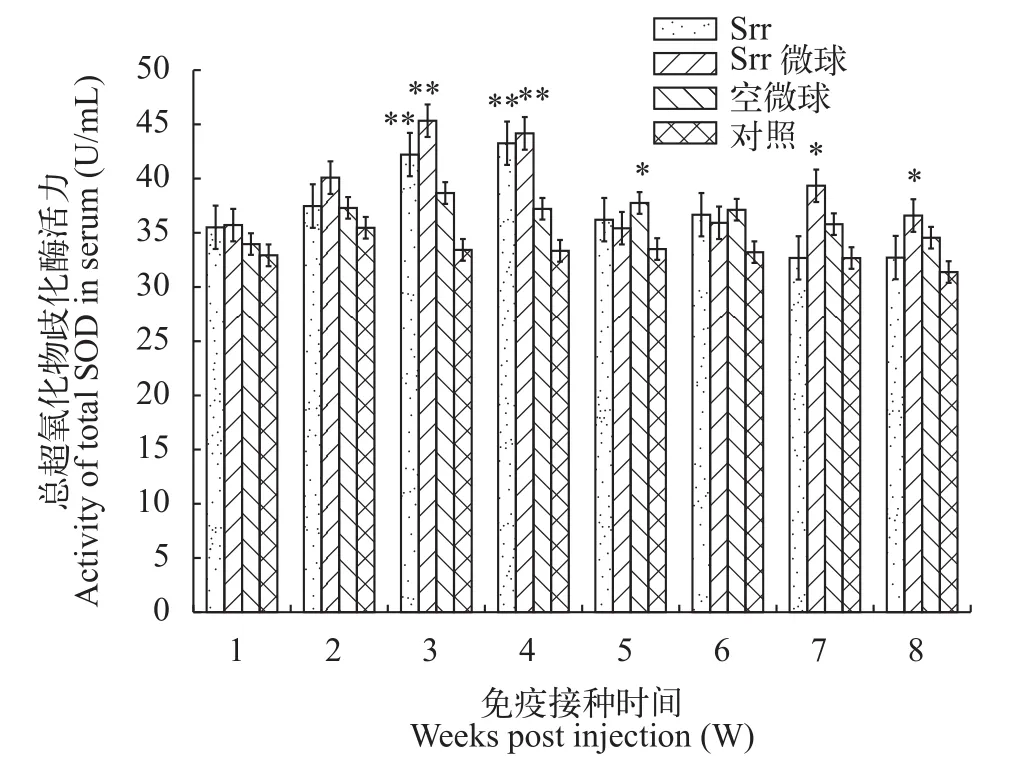
图4 斑点叉尾鲙血清总超氧化物歧化酶活力变化Fig. 4 Changes of T-SOD activity in serum of Ictalurus punctatus

图5 斑点叉尾鲙血清溶菌酶活力变化Fig. 5 Changes of lysozyme activity in serum of Ictalurus punctatus
2.6 微球疫苗对斑点叉尾鲖头肾和脾脏免疫相关基因表达的影响
海豚链球菌攻毒后24h(图6A), Srr微球组的的IFN-γ基因表现出极大的上调, 显著(P<0.05)高于对照组, 而Srr组和空微球组虽也有上调, 但与对照组不存在显著性关系(P>0.05); Srr微球组的TNF-α基因的表达量显著(P<0.05)或者极显著(P<0.01)的高于其他实验组; 所有实验组的CD4L-2基因和MHC-Ⅱβ基因的表达量不存在显著性关系(P>0.05), 但是均略高于对照组有上调趋势。攻毒后48h的脾脏(图6B), Srr组和Srr微球组IFN-γ基因的表达量均显著(P<0.05)高于空微球组和对照组;TNF-α的表达均较低, 但是Srr组和Srr微球组均显著(P<0.05)或极显著(P<0.01)高于空微球组和对照组; Srr微球组CD4L-2基因的表达显著(P<0.05)高于空微球组和对照组; Srr微球组MHC-Ⅱβ基因极显著(P<0.01)高于Srr组、空微球组以及对照组, Srr组与空微球组和对照组之间存在显著差异(P<0.05)。
海豚链球菌攻毒后24h的头肾(图6C), Srr微球组的IFN-γ、CD4L-2和MHC-Ⅱβ基因表达量皆显著(P<0.05)高于对照组,TNF-α基因表达量极显著(P<0.05)高于其他实验组,CD4L-2基因的表达量显著(P<0.05)高于空微球和对照组,MHC-Ⅱβ的表达量显著(P<0.05)高于空微球组。攻毒后48h的头肾(图6D), 斑点叉尾鲙头肾中IFN-γ、TNF-α和MHC-Ⅱβ基因的表达在Srr微球组极显著(P<0.01)高于空微球组和对照组,CD4L-2的表达显著高于空微球组和对照组,IFN-γ的表达与Srr组存在显著(P<0.05)差异,TNF-α的表达与Srr组存在极显著(P<0.01)差异,MHC-Ⅱβ基因的表达显著(P<0.05)高于Srr组。

图6 海豚链球菌攻毒后24h/48h斑点叉尾鲙脾脏/头肾中免疫相关基因相对表达量Fig. 6 Relative expression level of immune genes in spleen /kidney of vaccinated I. punctatus at 24h/48h post-challenge by S. iniae
2.7 微球疫苗对斑点叉尾鲖的保护效果
斑点叉尾鲙实验前随机剖解检测, 均为正常健康斑点叉尾鲙。免疫后第4周进行攻毒, 对濒死的斑点叉尾鲙接菌检测, 确定致病菌为海豚链球菌;海豚链球菌攻毒14d后, Srr组和Srr微球组分别获得抗海豚链球菌相对免疫保护率为35%和60%, 而空微球组和对照组在攻毒后14d内全部死亡(图7)。
3 讨论
海藻酸钠是一种聚阴离子多聚物, 壳聚糖是一种聚阳离子聚合物, 两者接触后发生静电反应, 可在海藻酸钠表面形成一层聚电解质膜, 从而紧密包裹蛋白, 使微球的稳定性和载药量都得到显著提高[15]。本实验以海藻酸钠和壳聚糖两种天然高分子聚合物为载体包被海豚链球菌Srr蛋白, 利用乳化法制备海藻酸钠-壳聚糖-海豚链球Srr蛋白微球口服疫苗, 获得了较高的包封率和载药率; 通过Western-blot对微球释放蛋白的抗原性进行检测, 结果表现出较好的抗原性, 由此可见该制备方法较为温和, 可以保证包裹抗原的完整性。

图7 攻毒后的存活率Fig. 7 Survival rate after chanllenge
酶联免疫吸附实验(ELISA)自1971年被Engvall和Perlmann创建以来, 该方法以操作简单, 检测样本量大, 敏感度较高以及特异性较强等优点逐步成为血清抗体效价检测的重要方法[16]。本实验通过间接ELISA检测了斑点叉尾鲙在免疫后的血清抗体水平。Srr组和Srr微球组在实验中均能检测到特异性抗体, 且峰值均出现在了第4周, 分别为0.85和0.99, 由此说明微球疫苗Srr组和Srr微球组均能刺激机体产生免疫应答; 空微球虽然也能检测到特异性抗体, 但是抗体效价相对较低, 推测可能是壳聚糖和海藻酸钠本身可作为免疫增强剂的原因[17,18]; 而对照组始终没有检测出特异性抗体。最后通过攻毒实验测定了各实验组的相对保护率,Srr组和Srr微球组分别为35%和60%, 由此可见Srr蛋白对机体具有一定的保护效果, 且Srr微球组的保护效率远远高于Srr直接拌饲投喂组, 推测是海藻酸钠-壳聚糖的包裹作用通过酸碱反应控制药物的释放速度, 减少了Srr蛋白在机体胃肠酸碱环境中的损失, 使蛋白更有效地被肠道吸收发挥作用。
非特异性免疫在作为低等脊椎动物的鱼类疫系统中起着重要的作用。血清总蛋白的成分和含量与鱼体的健康状况紧密相连[19]。本实验对斑点叉尾鲙免疫包被的口服微球疫苗后, 实验组血清总蛋白含量均显著升高, 且Srr组和Srr微球组在第4周达到最高值, 说明Srr蛋白对机体增强免疫能力具有一定的积极意义。超氧化物歧化酶(SOD)是一种广泛存在于机体内的重要抗氧化酶, 对平衡机体氧化作用和抗氧化作用中必不可少, 且在清除O2-自由基, 增强机体防御能力中起到了重要的作用[20]。实验结果表明, SOD的活力与机体免疫水平具有紧密的关系, Srr微球组免疫后SOD活力逐步增强, 并在第3周和第4周极显著高于对照组, 随后出现下降,鱼体免疫力相应有所下降。由此推测疫苗免疫斑点叉尾鲙后能够刺激鱼体识别抗原, 促使SOD分泌, 维持机体氧化物和抗氧化物的平衡, 达到保护鱼体的目的。溶菌酶(LSZ)是鱼类抵御外来病原感染的重要非特异性免疫防御因子之一, 主要存在鱼类的黏液、血清以及巨噬细胞中, 能够病原微生物,保护鱼体[21]。在本实验中, 免疫后各实验组的溶菌酶活性均有提高, 且在整个实验期间, Srr微球组的溶菌酶活性一直显著(P<0.05)或者极显著(P<0.01)的高于对照组。由此可推测溶菌酶的高活性能够提高鱼体抵御病原微生物的能力。
本实验利用Real-time RCP方法探究了Srr蛋白疫苗对斑点叉尾鲙免疫相关基因表达的影响。TNF-α、IFN-γ、MHC-Ⅱβ和CD4L-2基因在机体脾脏和头肾的表达情况是疫苗效果评价中的重要指标。本实验中Srr微球组免疫攻毒后的脾脏和头肾中TNF-α、IFN-γ、CD4L-2和MHC-Ⅱβ因子的表达均明显高于Srr组、空微球组以及对照组, 由此可推测Srr蛋白刺激了TNF-α因子调节趋化因子的产生,对中性粒细胞和巨噬细胞进行诱导, 并迁移到病原菌入侵部位发挥免疫功能[22,23], 同时,IFN-γ因子的上调可能刺激了机体巨噬细胞对病原微生物的杀伤能力, 从而起到增强机体免疫应答的作用[24], 推测Srr包被疫苗在增强鱼体抵抗病原能力以及增强机体免疫力起到了一定的作用。研究表明, 不仅海藻酸钠和壳聚糖能发生静电反应, 其微球进入体内后外膜壳聚糖上游离的氨基能与黏膜上皮细胞上带负电的糖蛋白或细胞间紧密结合部分固有的负电荷也能发生静电作用, 从而打开了上皮细胞之间紧密连接, 促进了药物的吸收[25—27], 且释放的药物可通过跨细胞途径或者细胞旁路途径穿过上皮细胞, 提高免疫效果[28]。本实验结果表明Srr蛋白对斑点叉尾鲙海豚链球菌病具有一定的防御作用, 同时Srr组和Srr微球组的免疫效果差异不仅体现了海藻酸钠-壳聚糖对蛋白药物的保护作用, 也体现了这两种高分子载体对蛋白药物的促进吸收作用。
[1]Pier G B, Madin S H.Streptococcus iniaesp. nov., a beta-hemolyticStreptococcusisolated from an Amazon Freshwater Dolphin,Inia geoffrensis[J].International Journal of Systematic Bacteriology, 1976, 26(4): 545—553
[2]Agnew W, Barnes A C.Streptococcus iniae: An aquatic pathogen of global veterinary significance and a challenging candidate for reliable vaccination [J].Veterinary Microbiology, 2007, 122(1-2): 1—15
[3]Cheng S, Hu Y H, Jiao X D,et al. Identification and immunoprotective analysis of aStreptococcus iniaesubunit vaccine candidate [J].Vaccine, 2010, 28(14): 2636—2641
[4]Elaamri F. First report ofStreptococcus iniaein red porgy(Pagrus pagrus,L.) [J].Journal of Fish Diseases, 2010,33(11): 901—905
[5]Prettogiordano L G, Scarpassa J A, Barbosa A R,et al.Streptococcus iniae: an unusual important pathogen fish in Brazil [J].Journal of Aquaculture Research & Development, 2015, 6(9): 363
[6]Yu X L, Chen M, Li C,et al. Channel catfishIctalurus punctatusoutbreak infected by bacteriumStreptococcus iniae[J].Journal of Dalian Fisheries University, 2008,23(3): 185—191 [余晓丽, 陈明, 李超, 等. 斑点叉尾鲙暴发性海豚链球菌病的研究. 大连海洋大学学报, 2008,23(3): 185—191]
[7]Chen D F, Wang K Y, Geng Y,et al.Streptococcus iniaeisolated from channel catfish (Ictalurus punctatus) in China [J].The Israeli Journal of Aquaculture. Bamidgeh,2011, 63(1): 63—70
[8]Fischetti V A, Pancholi V, Schneewind O. Conservation of a hexapeptide sequence in the anchor region of surface proteins from Gram-positive cocci [J].Molecular Microbiology, 1990, 4(9): 1603—1605
[9]Seifert K N, Adderson E E, Whiting A A,et al. A unique serine-rich repeat protein (Srr-2) and novel surface antigen (epsilon) associated with a virulent lineage of serotype IIIStreptococcus agalactiae[J].Microbiology, 2006,152(4): 1029—1040
[10]Zhou M, Zhang H, Zhu F,et al. Canonical SecA associates with an accessory secretory protein complex involved in biogenesis of a streptococcal serine-rich repeat glycoprotein [J].Journal of Bacteriology, 2011, 193(23):6560—6566
[11]Yang L, Wang K Y, Zhou Y,et al. The characteristics and immune efficacy of an oral microspheres vaccine ofYersinia ruckeri[J].Acta Hydrobiologica Sinica, 2015,39(6): 1142—1149 [阳磊, 汪开毓, 周燕, 等. 鲁氏耶尔森氏菌口服微球疫苗特性分析及免疫效果研究. 水生生物学报, 2015, 39(6): 1142—1149]
[12]Jiang J, Zheng Z, Wang K,et al. Adjuvant immune enhancement of subunit vaccine encoding pSCPI ofStreptococcus iniaein channel catfish (Ictalurus punctatus) [J].International Journal of Molecular Sciences, 2015,16(12): 28001
[13]Ren Y, Zhang X J, Tao J F,et al. Preparation and immune effect of chitosan-alginate microcapsules containingVibrio harveyiantigen OmpK in orange-spotted groupers [J].Chinese Journal of Biologicals, 2015, 28(2):110—114 [任燕, 张小江, 陶家发, 等. 壳聚糖-海藻酸盐复合微囊疫苗的制备及其对斜带石斑鱼的口服免疫效果. 中国生物制品学杂志, 2015, 28(2): 110—114]
[14]Yang Q, Pan Y L, Wang K Y,et al. OmpN, outer membrane proteins ofEdwardsiella ictaluriare potential vaccine candidates for channel catfish (Ictalurus punctatus)[J].Molecular Immunology, 2016, 78: 1—8
[15]Morteza H, Kafshgari M, Khorram,et al. Reinforcement of chitosan nanoparticles obtained by an ionic cross-linking process [J].Iranian Polymer Journal, 2011, 20(5):445—456
[16]Li W M. Development and application of enzyme linked immuno sorbent assay technology [J].Journal of Hubei Vocational-Technical College, 2003, 6(4): 65—69 [李文敏. 酶联免疫吸附反应的技术进展及应用. 湖北职业技术学院学报, 2003, 6(4): 65—69]
[17]Tan X D, Li Y, Zhang H Y,et al. Effects of sodium alginate on the immune response and the disease resistance ability of Chinese mitten crabEriocheir sinensis[J].Feed Industry, 2008, 29(6): 24—27 [谭夕东, 李义, 张红英,等. 海藻酸钠对中华绒螯蟹免疫功能及抗病力的影响.饲料工业, 2008, 29(6): 24—27]
[18]Xiao Y Y, Xia Y T, Liu T F,et al. Effects of chitosan on growth performance and immunity of juvenile Russian sturgeon (Acipenser gueldenstardti) [J].Acta Hydrobiologica Sinica, 2017, 41(1): 114—120 [肖艳翼, 夏永涛, 刘腾飞, 等. 壳聚糖对俄罗斯鲟幼鱼生长性能及免疫功能的影响. 水生生物学报, 2017, 41(1): 114—120]
[19]Wu X J, Wang K Y, Yang L,et al. The immune effect of an oral microspheres vaccine againstEdwardsiella ictalurion channel catfish (Ictalurus punctatus) [J].Journal of Fisheries of China, 2016, 40(3): 404—413 [吴学婧, 汪开毓, 阳磊, 等. 鲙爱德华菌口服疫苗对斑点鲙的免疫效果. 水产学报, 2016, 40(3): 404—413]
[20]Chun-Xiang A I, Chen L Q, Gao L J,et al. Effect of vitamin C on SOD, ALP and ACP activities of Chinese mitten-handed crab,Eriocheir sinensis[J].Journal of Oceanography in Taiwan Strait, 2002, 21(4): 431—438
[21]Yang X L. Advance on fish immunology research [J].Journal of Fisheries of China, 1989, 13(3): 271—284 [杨先乐. 鱼类免疫学研究的进展. 水产学报, 1989, 13(3):271—284]
[22]Park K C, Osborne J A, Tsoi S C,et al. Expressed sequence tags analysis of Atlantic halibut (Hippoglossus hippoglossus) liver, kidney and spleen tissues following vaccination againstVibrio anguillarumandAeromonas salmonicida[J].Fish & Shellfish Immunology, 2005,18(5): 393—415
[23]Wei Y C, Pan T S, Chang M X,et al. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish, the orange-spotted grouperEpinephelus coioides[J].Veterinary Immunology & Immunopathology, 2011, 141(3—4):173
[24]Milevmilovanovic I, Long S, Wilson M,et al. Identification and expression analysis of interferon gamma genes in channel catfish [J].Immunogenetics, 2006, 58(1): 70—80
[25]Sonia T A, Rekha M R, Sharma C P. Bioadhesive hydrophobic chitosan microparticles for oral delivery of insulin:In vitro characterization and in vivo uptake studies [J].Journal of Applied Polymer Science, 2011, 119(5): 2902—2910
[26]Sonaje K, Lin K J, Wang J J,et al. Self-assembled phsensitive nanoparticles: a platform for oral delivery of protein drugs [J].Advanced Functional Materials, 2010,20(21): 3695—3700
[27]Sarmento B, Ribeiro A, Veiga F,et al. Alginate/chitosan nanoparticles are effective for oral insulin delivery [J].Pharmaceutical Research, 2007, 24(12): 2198—2206
[28]Wang C, Wang L W, Shi X Y,et al. Advances in applications of chitosan-sodium alginate microsphere to drug carriers for microparticulated systems [J].Progress in Modern Biomedicine, 2014, 14(16): 3174—3176 [汪程,汪令伟, 史晓宇, 等. 海藻酸钠壳聚糖微球作为药物载体的研究进展. 现代生物医学进展, 2014, 14(16): 3174—3176]
