尼罗罗非鱼Ikaros基因的克隆及表达分析
2018-01-24陈昆平刘志刚卢迈新高风英张德锋可小丽曹建萌朱华平衣萌萌
陈昆平 刘志刚 卢迈新 高风英 张德锋 可小丽曹建萌 朱华平 王 淼 衣萌萌
(1. 中国水产科学研究院珠江水产研究所, 农业部热带亚热带水产资源利用与养殖重点实验室, 广州 510380;2. 上海海洋大学水产与生命学院, 上海 201306)
DNA结合蛋白Ikaros家族是具有C2H2锌指结构的转录因子, 它包括Ikaros、Aiolos、Helios、Ecos和Pegasus等5个成员, 它们对淋巴细胞及其他造血细胞的早期发生和发育具有重要的调控作用[1]。其中, 由Ikaros基因编码的Ikaros是preBCR、Notch、MAPK等多个信号通路中的关键转录因子,通过FOXO1、HuD、ETS1等调控因子的相互作用来调控大量与淋巴细胞发育相关的下游基因的表达, 对于淋巴细胞的正确发育及其免疫功能的发挥具有重要作用[2]。研究表明, 当小鼠(Mus musculus)的Ikaros基因发生突变时, 多能造血干细胞不能分化为淋巴样祖细胞, 其体内将缺失B细胞、NK细胞、外周淋巴结和早期的T细胞[3,4]。Winandy和Payne等[5,6]认为Ikaros基因是一个肿瘤抑制基因,Ikaros活力的丧失会导致前B细胞转化为恶性状态,肿瘤发生的概率大大增加。在人类(Homo sapiens)中,Ikaros基因的缺失及功能性突变在急性淋巴细胞白血病的发生发展中发挥重要作用, 而且与恶性肿瘤、系统性红斑狼疮等疾病的发生密切相关[7—9]。
罗非鱼(Tilapia)是联合国粮农组织(FAO)重点推广养殖的对象, 被誉为未来动物性蛋白质主要来源之一, 因具有适应性强、生长快、繁殖力高和食性广等优点, 已被世界各地广泛引种与养殖[10]。但近年来由于罗非鱼链球菌病的频繁发生与流行, 给罗非鱼养殖产业造成了巨大的经济损失[10,11]。开展罗非鱼免疫相关基因的研究可为探索罗非鱼免疫防御机制及抗病品种培育奠定基础, 对罗非鱼病害防治具有重要意义。目前有关罗非鱼免疫相关基因转录调控因子的研究还比较薄弱, 罗非鱼Ikaros基因的研究尚未见报道。开展罗非鱼Ikaros基因结构、功能及免疫应答特性的研究, 有助于全面了解罗非鱼免疫系统防御特点以及进一步揭示免疫转录因子在抵御病原感染中发挥的调控作用。本研究利用RT-PCR和RACE等技术, 对尼罗罗非鱼(Oreochromis niloticus, GIFT strain)Ikaros基因进行了克隆, 并对其进行生物信息学分析, 同时采用实时荧光定量PCR技术检测了Ikaros基因在尼罗罗非鱼各个组织中的表达情况及其在人工感染无乳链球菌(Streptococcus agalactiae)后免疫相关组织中的表达变化。
1 材料与方法
1.1 实验材料
实验用鱼: 尼罗罗非鱼来自广东罗非鱼良种场, 体质量为30—50 g, 在珠江水产研究所的池塘网箱中暂养一周后用于试验。
菌株: 无乳链球菌菌株WC1535由本实验室分离保存, 为Ⅰa型强毒株。
实验试剂:Escherichia coliDH5α感受态细胞、pMD19-T载体和反转录试剂盒购自TAKARA宝生物工程(大连)有限公司; RNA提取试剂盒购自广州美基生物科技有限公司; DNA提取试剂盒和琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;PowerUpTMSYBR®Green Master Mix试剂盒购自英潍捷基(上海)贸易有限公司; SMARTTMRACR cDNA Amplification kit和Genome WalkerTMUniversal Kit购自美国Clontech公司; 常规PCR所用的TaqDNA polymerase、dNTP mixture和Buffer for Tap DNA Polymerase购自上海申能博彩生物科技有限公司。
1.2 实验方法
尼罗罗非鱼Ikaros基因组DNA序列及其cDNA序列的克隆在无菌条件下, 解剖尼罗罗非鱼取胸腺组织, 采用Magen High Pure Universal RNA Kit(Magen)试剂盒提取总RNA, 步骤参照试剂盒说明书进行, 琼脂糖凝胶电泳检测其完整性, 并用超微量分光光度计检测其浓度和纯度。取1 μg胸腺RNA, 采用Prime ScriptTM1st Strand cDNA Synthesis Kit (TaKaRa)将其反转录为cDNA。采用TIAN-amp Marine Animals DNA Kit (TIANGEN)试剂盒提取尼罗罗非鱼的尾鳍基因组DNA。
参照尼罗罗非鱼IkaroscDNA的预测序列(登录号为: XM_005473805)设计PCR扩增和RACE所需要的引物(表 1), 本实验所有的引物均由生工生物工程(上海)股份有限公司合成。以胸腺组织cDNA为模板, PCR扩增Ikarosc DNA序列片段。Ikaros基因cDNA 5′末端和3′末端的扩增按照SMARTTMRACR cDNA Amplification kit (TaKaRa)的操作手册进行。参照尼罗罗非鱼Ikaros基因的预测序列(登录号为: NC_022211)和已获得的cDNA序列设计4对特异性引物(表 1), 以尾鳍组织基因组DNA为模板, PCR扩增Ikaros基因组DNA序列片段。Ikaros基因5′侧翼序列采用Genome WalkerTMUniversal Kit(Clontech)试剂盒进行扩增。PCR产物胶回收纯化后与载体pMD19-T连接, 转化E.coliDH5α感受态细胞中, 阳性单克隆送至Invitrogen公司测序, 通过序列拼接获得IkaroscDNA序列和基因组DNA序列全长。
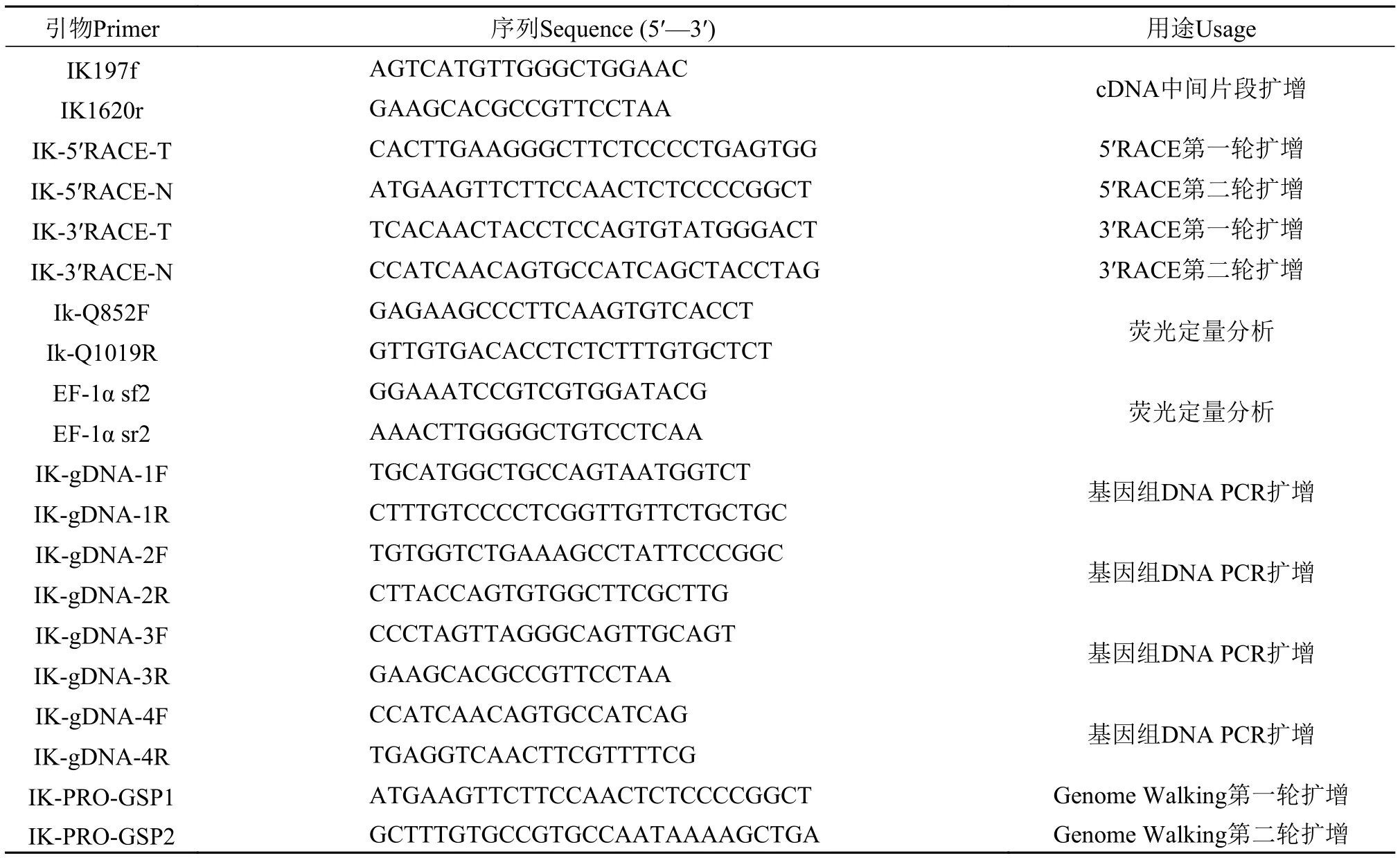
表 1 用于尼罗罗非鱼Ikaros基因克隆和表达的主要引物及其序列Tab. 1 Primers used for charactering the Ikaros gene in O. niloticus
尼罗罗非鱼Ikaros基因的表达分析在无菌条件下, 解剖3尾健康尼罗罗非鱼取血液、胸腺、脾脏、头肾、鳃、心脏、脑、肠、肌肉、皮肤和肝脏等11个组织, 按照1.1中方法提取各组织的总RNA, 并取1 μg RNA, 反转录为cDNA。以EF-1α基因作为荧光定量PCR的内参基因, 用于扩增的引物为EF-1α sf2和EF-1α sr2; 在Ikaros6种mRNA剪接异构体的共有序列中设计荧光定量引物(Ik-Q852F和Ik-Q1019R), 引物序列详见表 1, 按照1.1中方法进行目的片段的克隆, 将重组质粒按10倍梯度稀释为8个浓度梯度, 并将其作为制作标准曲线的模板。每个cDNA样品设置3个重复, 反应体系按照SYBR Green Mix (ABI)试剂盒的说明书进行配制,使用ABI Step One Plus荧光定量仪检测Ikaros基因在各组织中的表达水平。qRT-PCR检测的结果使用Excel软件进行数据处理, 采用2-ΔΔCt法计算单个样品中Ikaros基因的相对表达量, 并利用SPPS17.0软件中单因素方差分析进行Ikaros基因表达水平的差异性分析,P<0.05为差异显著,P<0.01为差异极显著。
尼罗罗非鱼感染无乳链球菌后Ikaros基因在各组织中的表达变化将无乳链球菌种接种于血平板, 30℃培养16h后用PBS缓冲液稀释菌体配置成浓度分别为5×105、1×106、5×106、1×107和5×107CFU/mL的菌液。将不同浓度的菌液分别注射于尼罗罗非鱼腹腔中, 每组30尾, 每尾100 μL, 对照组注射等量PBS缓冲液, 获得半致死浓度为5×106CFU/mL。将个体大小相近的150尾尼罗罗非鱼分别置于5个体积为0.3 m3的鱼缸中, 每缸30尾鱼,水温控制为(31±0.5)℃, 每天正常投喂2次, 驯养1周后以半致死浓度的无乳链球菌菌液进行人工感染实验。其中, 3个鱼缸中的尼罗罗非鱼设置为无乳链球菌感染组, 每尾腹腔注射100 μL无乳链球菌菌液, 另外2个鱼缸中的尼罗罗非鱼腹腔注射100 μL PBS缓冲液, 作为对照组。在0、8h、24h、48h、72h、120h、192h和288h共8个时间点, 分别收集无乳链球菌感染组和PBS对照组不同时间点3尾鱼的血液、胸腺、头肾和脾脏4种组织, 按1.3中建立的荧光定量PCR方法检测Ikaros基因在各组织中的表达变化。
生物信息学分析基因测序结果利用DNAMAN和NCBI数据库中Blast等软件进行比对分析,蛋白理化性质利用ProtParam (http://web.expasy.org/protparam/)进行分析, 信号肽预测使用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/),跨膜区分析使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/), 疏水性分析使用Ex-PASy ProtScale (http://web.expasy.org/protscale/), 糖基化位点预测使用NetNGlyc 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/), 磷酸化位点预测使用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/), 蛋白结构域分析采用Smart (http://smart.embl-heidelberg.de/), 蛋白质三级结构的构建与分析采用SWISS-MODEL (http://swissmodel.expasy.org/workspace/)和Insight II软件, 利用DNAstar和BioEdit软件进行氨基酸序列的多重比对, 利用MEGA5.05软件中的邻位相接法(Neighborjoining)构建系统进化树。
2 结果
2.1 尼罗罗非鱼Ikaros的cDNA序列及其特征
本实验利用RT-PCR和RACE技术对尼罗罗非鱼IkaroscDNA进行了克隆, 发现该基因具有6种不同的mRNA剪接异构体, 分别为Ikaros-1、Ikaros-2、Ikaros-3、Ikaros-4、Ikaros-5和Ikaros-6, 其cDNA序列已经提交到GenBank, 登录号分别为KY825170、KY825171、KY825172、KY825173、KY825174和KY825175, 序列组分及其蛋白质的理化性质包括cDNA全长(Full length cDNA, FLC)、5′非翻译区(Untranslated region, UTR)、3′UTR、开放阅读框(Open reading frame, ORF)、氨基酸(Amino acid, AA)、蛋白质分子量(Protein molecular weight, Mr)和等电点(Isoelectric point, pI)的分析如表 2所示。使用TMHMM、Expasy和SignalP生物软件对Ikaros基因编码的氨基酸序列进行分析,结果发现它们均无疏水区域、无跨膜区域和无信号肽。利用NetPhos 3.0 Server和NetNGlyc 1.0 Server生物软件对Ikaros-1编码的氨基酸序列进行预测, 结果发现该序列有46个丝氨酸磷酸化位点、18个苏氨酸磷酸化位点、4个酪氨酸磷酸化位点以及2个糖基化位点, 分别为39NASA和195NGSQ。
2.2 尼罗罗非鱼Ikaros的基因组DNA序列及其mRNA剪接异构体
通过PCR和Genome walking技术克隆获得Ikaros的基因组DNA (GenBank登录号: KY825169),结果显示该序列全长为20454 bp, 包括3721 bp的5′侧翼序列、8个外显子和7个内含子, 且连接处均符合GT-AG规律。对Ikaros6种不同的mRNA剪接异构体进行比对分析, 发现Ikaros-1和Ikaros-2包含8个外显子,Ikaros-3缺失第7外显子,Ikaros-4和Ikaros-5缺失第4外显子,Ikaros-6缺失了第4和第7外显子, 而Ikaros-2和Ikaros-5则分别在第7外显子的5′末端比Ikaros-1和Ikaros-4少3个碱基(TAG), 从该结果可看出Ikaros基因的第4和第7外显子为可变剪接外显子, 且第7外显子的剪接位置可发生在其头3个碱基之后(图1)。
2.3 尼罗罗非鱼Ikaros蛋白的结构分析
Smart预测尼罗罗非鱼Ikaros蛋白的结构域, 结果显示Ikaros-1、Ikaros-2和Ikaros-3编码的蛋白质异形体(Ik1、Ik2和Ik3)均具有6个保守的锌指结构域(Zinc finger domains, ZnFs), 其中4个ZnFs位于N端, 由Ikaros基因的4—6外显子编码, 另外2个Zn-Fs位于C端, 由Ikaros基因的第8外显子编码, 而Ikaros-4、Ikaros-5和Ikaros-6编码的蛋白质异形体(Ik4、Ik5和Ik6)由于第4外显子的缺失而只获得了5个保守的ZnFs, 其中N端有3个, C端有2个(图2)。使用SWISS-MODEL工具对Ikaros蛋白序列进行同源建模, 同源性分析发现在含有ZnFs的序列中有相似的同源蛋白, 其中含有N端4个ZnFs的序列(位于Ikaros氨基酸序列的第205—340位置)与小鼠Zfp29基因编码的Aart[PDB code: 2i13A]同源性较高, 为41.38%, 而含有C端2个ZnFs的序列(位于Ikaros氨基酸序列的第554—619位置)与人ZBTB43基因编码的Zinc finger protein 297B [PDB code:2cshA]同源性较高, 为33.33%。通过Alignment mode进行人工联配, 构建Ikaros的三维空间结构, 结果如图3所示。Ikaros蛋白N端的4个ZnFs由4个α螺旋和8个β折叠片组成, C端ZnFs由2个α螺旋和4个β折叠片组成, 其中在每个α螺旋和2股反向平行的β折叠片之间均含有1个锌离子, 在锌离子的结合下, 这三个肽段可紧密折叠形成一种具有“手指”形状的ββα结构, 即锌指结构。
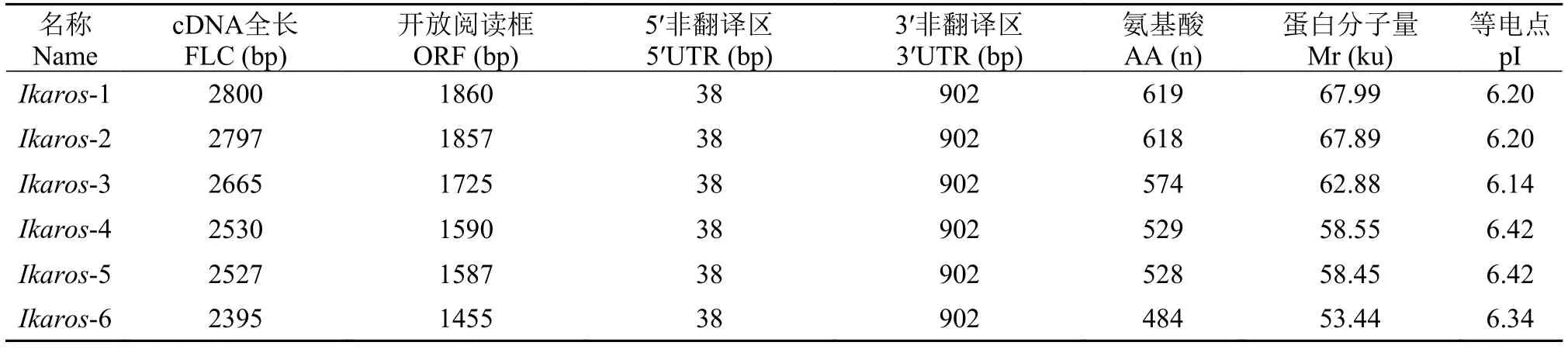
表 2 尼罗罗非鱼Ikaros基因的序列组分及其蛋白质的理化性质Tab. 2 The sequence component and protein physicochemical properties of Ikaros gene from O. niloticus
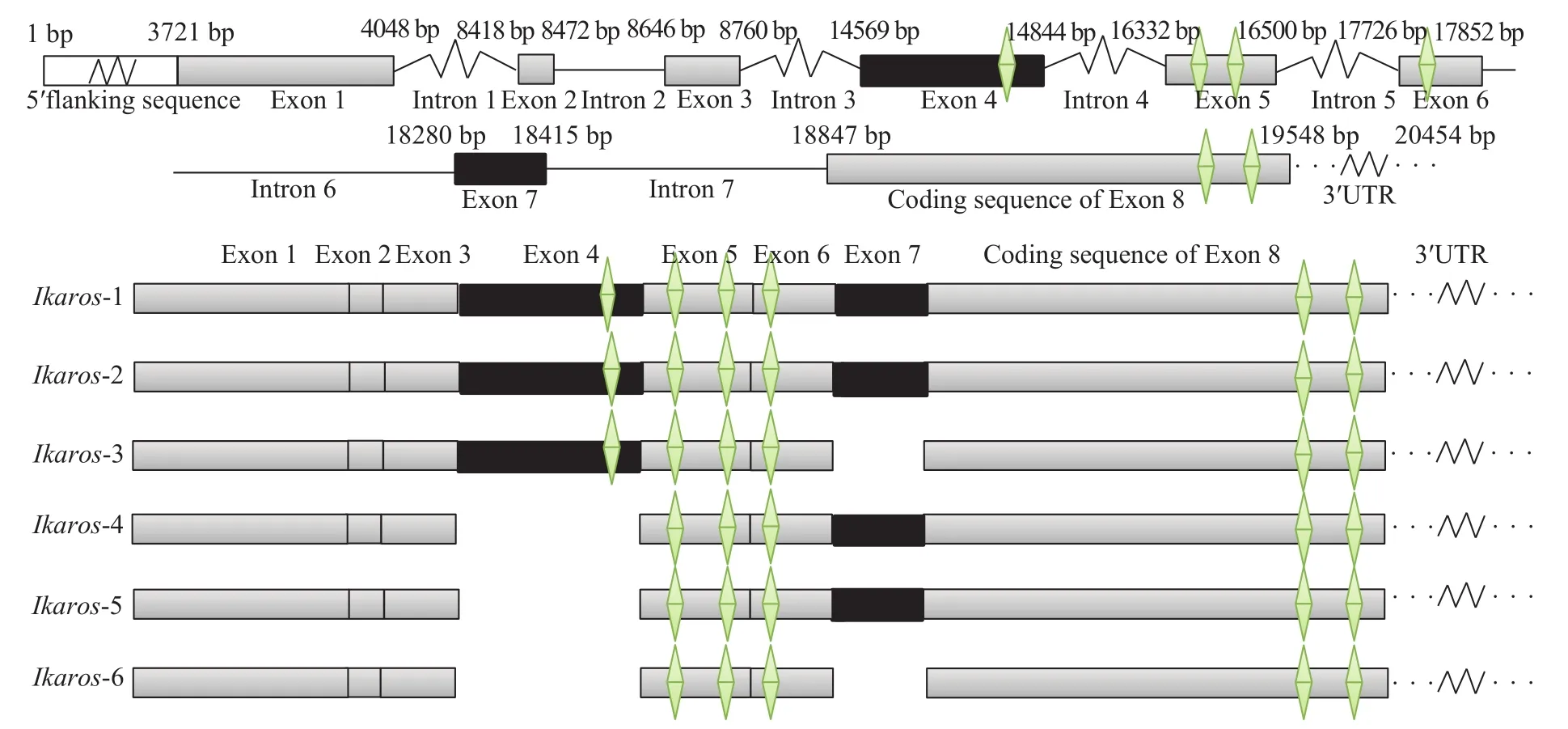
图1 尼罗罗非鱼Ikaros基因结构模式图Fig. 1 The Ikaros gene structures of O. niloticus
2.4 尼罗罗非鱼Ikaros的系统进化分析
将尼罗罗非鱼Ikaros-1编码的氨基酸序列与大黄鱼(Larimichthys crocea)、日本青鳉(Oryzias latipes)、红鳍东方鲀(Takifugu rubripes)、半滑舌鳎(Cynoglossus semilaevis)、大西洋鲑(Salmo salar)、鲤(Cyprinus carpio)、斑点叉尾鲙(Ictalurus punctatus)、热带爪蟾(Xenopus tropicalis)、鸡(Gallus gallus)、小鼠、牛(Bos taurus)和人的Ikaros氨基酸序列进行同源比对, 其同源性分别为93.7%、93.2%、89.6%、87.0%、79.0%、74.0%、70.6%、63.4%、67.0%、64.3%、60.7%和64.0%。对上述物种的Ikaros蛋白结构域分析发现, 尼罗罗非鱼与其他鱼类、哺乳类和两栖类一样, 均具有6个典型的ZnFs, 且不同物种的ZnFs高度保守, 仅有个别氨基酸存在差异。利用MEGA5.05软件对尼罗罗非鱼Ikaros6种mRNA剪接异构体编码的氨基酸序列与其他23个不同物种的Ikaros氨基酸序列按邻接法(Neighbor-joining)构建系统发育树(图4)。从图中可以看出, 硬骨鱼类的Ikaros聚为一簇, 其中尼罗罗非鱼与其他慈鲷科鱼类亲缘关系最近, 其次是鲈形目、鲀形目、鳉形目鱼类。两栖类、鸟类、哺乳类动物Ikaros聚为另一簇。软骨鱼类鳐(Raja eglanteria)和无颌类七鳃鳗(Lampetra japonicum)的Ikaros与上述物种的亲缘关系较远, 分别单独聚为一支。

图2 尼罗罗非鱼Ikaros蛋白保守结构域预测Fig. 2 Prediction of conserved domain in Ikaros protein of O. niloticus
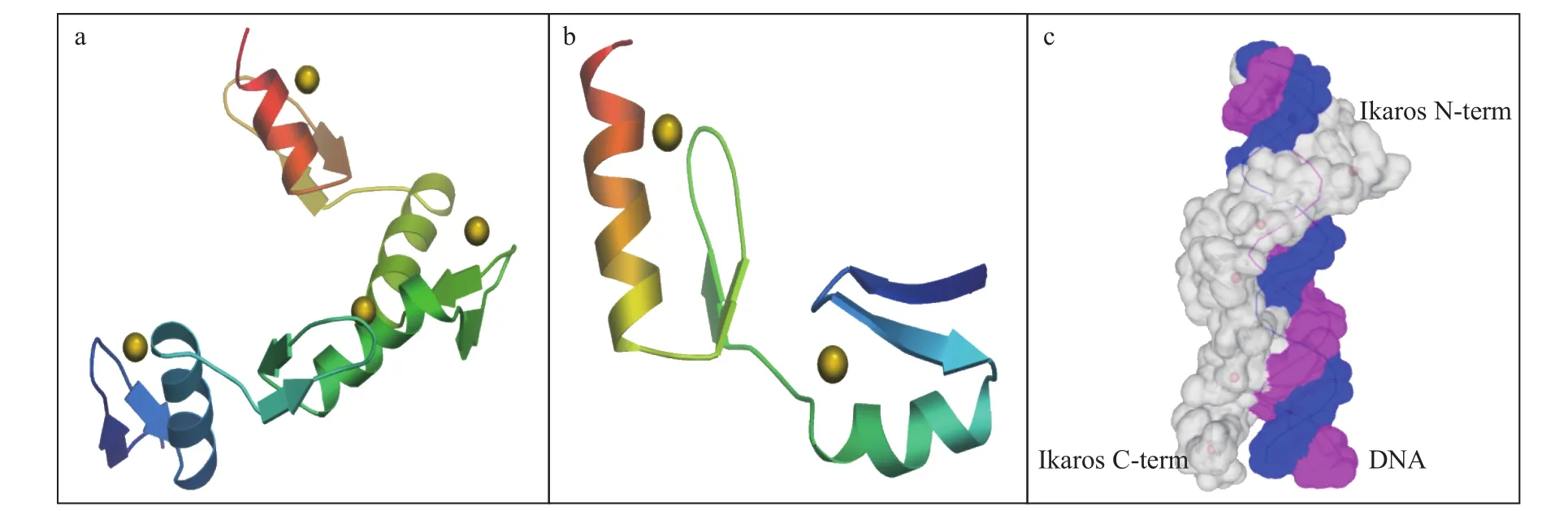
图3 尼罗罗非鱼Ikaros锌指结构域空间结构模拟Fig. 3 The predicted three-dimensional space structure of Ikaros ZnFs from O. niloticus
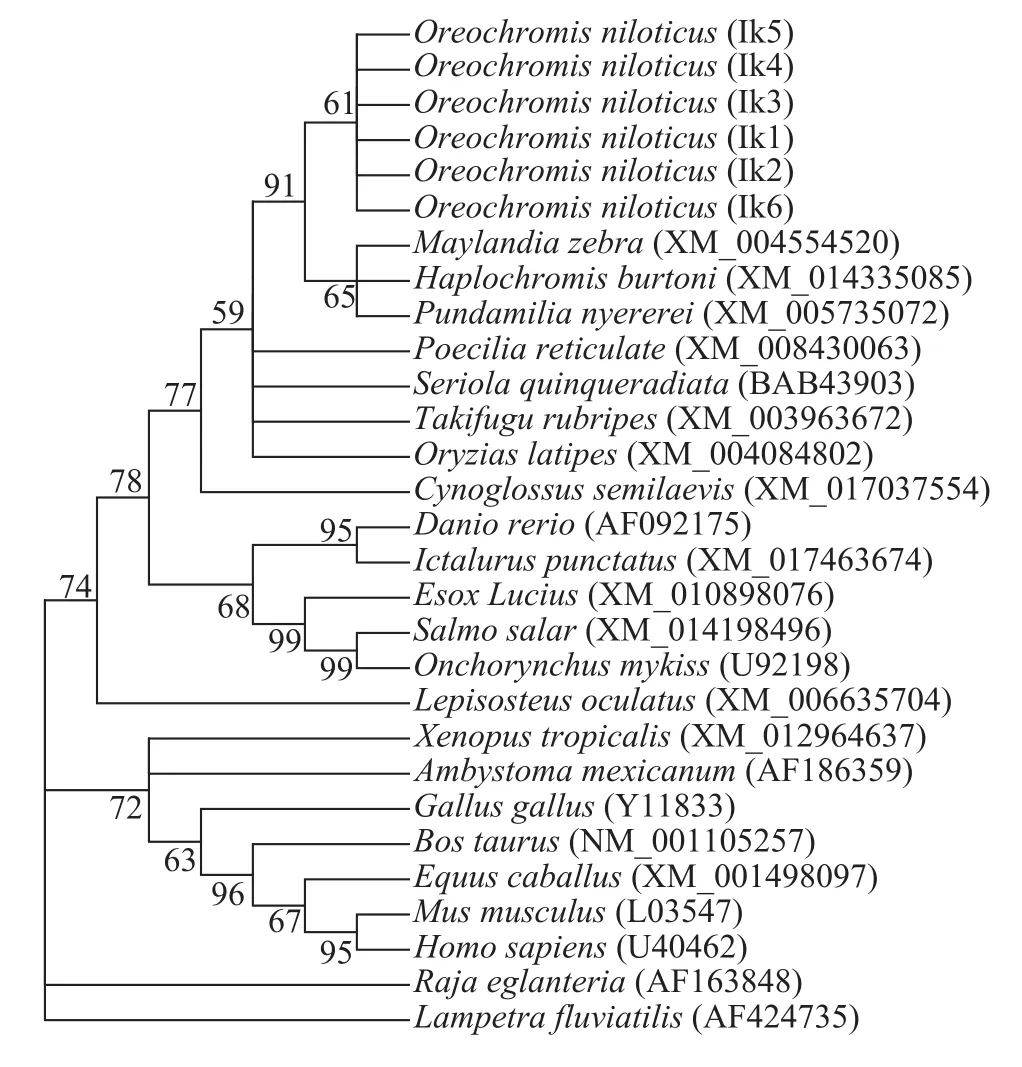
图4 基于不同物种Ikaros氨基酸序列构建的系统进化树(NJ法)Fig. 4 Phylogenetic tree of Ikaros in different species based on NJ method
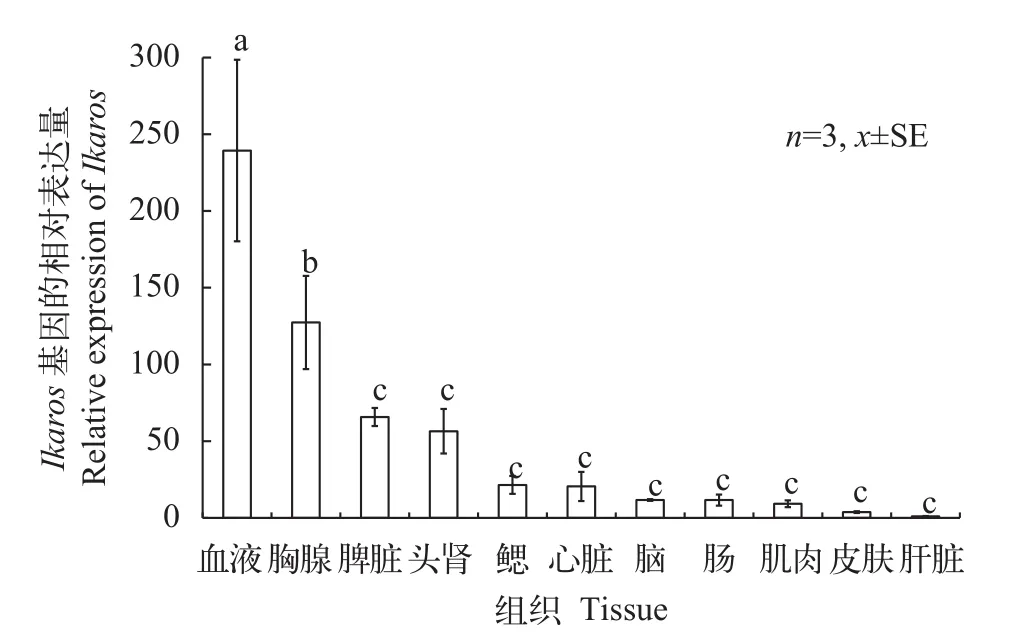
图5 Ikaros基因在尼罗罗非鱼不同组织中的表达Fig. 5 Relative expression of Ikaros gene in different tissues of O. niloticus
2.5 Ikaros基因在健康尼罗罗非鱼不同组织中的表达特征
采用实时荧光定量PCR对Ikaros基因在健康尼罗罗非鱼不同组织中的表达进行分析。结果显示,Ikaros基因在被检测的血液、胸腺和脾脏等11个组织中均有表达(图5)。其中血液和胸腺的表达量最高, 均显著高于其他组织器官, 脾脏和头肾也有较高的表达水平, 而在鳃、心脏、脑、肠、肌肉、皮肤和肝脏的表达水平较低。
2.6 感染无乳链球菌后Ikaros基因在尼罗罗非鱼组织中的表达变化情况
应用实时荧光定量PCR检测实验组和对照组的尼罗罗非鱼血液、胸腺、头肾、脾脏组织中Ikaros基因的表达。与对照组相比, 感染无乳链球菌后血液、胸腺、头肾、脾脏组织中Ikaros基因均上调表达, 且其表达特征相似, 均在48h达到峰值并显著高于对照组(P<0.01)(图6)。
3 讨论
3.1 尼罗罗非鱼Ikaros基因序列特征及分析
本实验获得了尼罗罗非鱼IkaroscDNA及基因组DNA的全长序列, 发现该基因有8个外显子和7个内含子, 且连接处均符合GT-AG规律, 其中第4外显子和第7外显子存在跳跃现象, 即在mRNA剪接过程中这2个外显子可能会被剪接或者被保留, 而第6内含子在3′末端存在2个相邻的剪切信号(AGTAG),这可能会造成第7外显子在剪接过程发生剪切位点偏移的现象(图1)。Hoskins等[12]研究表明, 外显子内部的剪接增强子(Exon splicing enhancer, ESE)与在RNA剪接中起调控作用的SR蛋白的作用模式可能是出现外显子跳跃现象的主要原因, 当ESE序列发生突变时, ESE将不能与SR蛋白结合, 导致该外显子在剪接过程中被跳过。而关于剪切位点偏移现象的发生是随机的还是受相关分子的调控以及它在调节基因表达过程中是否具有特别的生理意义目前还不清楚。
Ikaros基因的可变剪接现象普遍存在于脊椎动物中, 而且它们的可变剪接方式基本相同[13—20], 但不同物种IkarosmRNA剪接异构体的数量却不尽相同, 目前已发现在人类[8]中有13种, 斑马鱼[19](Danio rerio)有6种, 虹鳟[16](Oncorhynchus mykiss)有4种, 本研究在尼罗罗非鱼中发现了6种。可变剪接极大地增加了真核生物基因表达的复杂程度和蛋白质功能的多样性, 其普遍存在于脊椎动物中, 在多外显子人类基因中的比例更是高达92%—94%[21]。因此,Ikaros基因的多种mRNA剪接异构体也暗示着该基因在功能上的多样性。在人类中, Ik1和Ik2参与造血干细胞的早期发生和发育, 并能有效抑制癌细胞和肿瘤的发生; Ik4、Ik6、Ik7和Ik8是一种显性负亚型, 其异常表达与急性淋巴细胞白血病的发生和发展密切相关; 而关于其他蛋白质异形体的功能目前还不清楚, 有待进一步研究[8,22,23]。
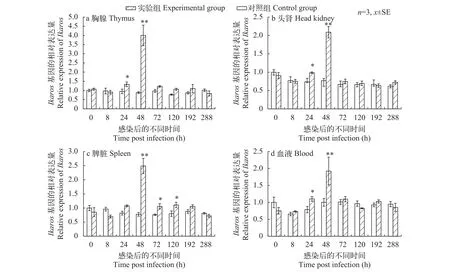
图6 无乳链球菌感染后Ikaros基因在尼罗罗非鱼胸腺、头肾、脾脏及血液中的表达情况Fig. 6 Expression profile of Ikaros gene in the thymus, head kidney, spleen and blood of O. niloticus after infection with Streptococcus agalactiae
3.2 尼罗罗非鱼Ikaros同源比较及结构域分析
Ikaros广泛存在于各类脊椎动物中, 它们均具有4个N端ZnFs和2个C端ZnFs, 而且不同物种之间的ZnFs在氨基酸序列上仅有几个氨基酸残基不同,表明Ikaros的ZnFs在结构和功能上具有高度的保守性。但由于编码N端ZnFs的外显子在可变剪接过程中不同程度缺失, 因此不同Ikaros蛋白质异形体的N端ZnFs数量不尽相同, 该现象普遍存在于各物种中[13—20]。研究表明, N端ZnFs数量在3个及以上的Ikaros蛋白质异形体可与目标基因的核心启动子区域以高亲和力结合, 发挥转录调节作用; N端Zn-Fs数量少于3个的Ikaros蛋白质异形体则不能与DNA结合, 而是通过显性负调控的方法抑制Ikaros的功能[24,25]。然而, 尼罗罗非鱼6个Ikaros蛋白质异形体的N端ZnFs数量均在3个以上, 表明它们均是具有DNA结合能力和转录活性的转录因子。C端的ZnFs相对保守, 存在于所有Ikaros蛋白质异形体和家族其他成员中。研究表明, Ikaros同源蛋白之间可通过C端ZnFs的相互作用形成同源或异源二聚体, 而这些不同组合的二聚体实质上代表的是一个复杂的转录因子调控网络, 对Ikaros家族蛋白的DNA结合活性及转录调控方面均具有重要的作用[26,27]。Ikaros作为许多信号通路的关键转录因子,其N端ZnFs和C端ZnFs在信号通路的调控中发挥了重要作用。研究表明, 当小鼠敲除Ikaros基因编码C端两个ZnFs的序列时, 淋巴系统的发育表现异常,造血干细胞的活性严重抑制, T、B淋巴细胞也没有产生[28]; 当敲除小鼠Ikaros基因编码N端两个Zn-Fs的序列时, 发现成熟T细胞和NK细胞的发育被抑制, 导致肿瘤的产生[3,29]。
3.3 尼罗罗非鱼Ikaros基因的表达特征
为了揭示Ikaros基因在尼罗罗非鱼各组织中的表达情况, 本研究利用实时荧光定量PCR对Ikaros6种mRNA剪接异构体的总表达量进行了检测, 结果表明Ikaros基因在尼罗罗非鱼11个被检测的组织中均有表达(图5), 其中在血液中的表达量最高, 其次为胸腺、脾脏和头肾, 在其他组织中的表达量较低。Ikaros基因在其他鱼类和无颌类中均具有广泛的组织表达模式, 但在不同组织的表达水平却表现出一定的差异, 如斑马鱼[19]Ikaros基因在胸腺和前肾组织中具有较高的表达水平, 在中肾、脾、心脏、肠、大脑以及精巢中均检测到了不同程度的表达; 半滑舌鳎[20]Ikaros基因在胸腺、脾以及肝脏中表达量较高, 在肾脏、精巢和心脏中也有一定量的表达, 而在肠、皮肤以及鳃中表达量很低; 七鳃鳗[18](Lampetra japonicum)Ikaros基因在精巢和卵巢中表达量最高, 其次是肾脏、肠、肝脏、鳃和血液。在哺乳动物人类和小鼠中,Ikaros基因主要表达于造血干细胞、所有的淋巴细胞及部分髓系细胞中, 因此在含有大量造血干细胞和淋巴细胞的血液、胸腺等免疫组织或器官中具有较高的Ikaros表达量[2]。上述研究显示,Ikaros基因在不同物种中的表达模式虽不尽相同, 但其在胸腺、头肾、脾脏等主要免疫器官中高表达, 反映了该基因具有重要的免疫功能。
目前, 有关鱼类Ikaros在免疫应答中作用的研究较少, 仅在半滑舌鳎[20]中开展了免疫LPS和LTA后的Ikaros应答研究, 结果显示在经过LPS或LTA处理的头肾巨噬细胞中,Ikaros基因的表达量显著上调。这表明Ikaros在巨噬细胞中具有特异性表达, 为重要的免疫相关因子, 受病原相关分子模式调控。本研究发现, 尼罗罗非鱼在人工感染无乳链球菌后, 血液、胸腺、头肾和脾脏中Ikaros基因的相对表达量均显著上调, 并在48h达到峰值。因此, 推测尼罗罗非鱼Ikaros参与了调控鱼体抵御外界病原微生物的免疫应答反应, 是一种重要的免疫转录调控因子。
有研究表明, 不同Ikaros蛋白质异形体在表达模式上可能存在一定差异, Molnár等[30]发现小鼠的Ik1和Ik2在淋巴细胞的发育过程中表达量最高,Ik4仅在淋巴样祖细胞中表达, 而其他的蛋白质异形体在淋巴细胞分化的不同阶段的表达量均不高。但是Willett等[19]在斑马鱼中却发现4种主要的Ikaros蛋白质异形体在各组织中的相对表达量相似,Hansen等[16]在虹鳟中也发现了4种Ikaros蛋白质异形体, 而且它们在胸腺、前肾和脾脏组织中均有相似的表达。关于鱼类的不同Ikaros蛋白质异形体在表达模式上是否表现为一致目前尚无足够证据证明, 应在多种鱼类中对该研究内容进行深入研究。因此作者欲揭示尼罗罗非鱼各种Ikaros蛋白质异形体的功能以及表达模式, 可从原位杂交、免疫组化和细胞培养等研究中入手, 这也将是下一步Ikaros研究中的重点内容。
[1]John L B, Ward A C. TheIkarosgene family: Transcriptional regulators of hematopoiesis and immunity [J].Molecular Immunology, 2011, 48(9-10): 1272—1278
[2]Fan Y Z, Lu D. The Ikaros family of zinc-finger protein[J].Acta Pharmaceutica Ainica B, 2016, 6(6): 513—521
[3]Georgopoulos K. Haematopoietic cell-fate decisions,chromatin regulation and Ikaros [J].Nature Reviews Immunology, 2002, 2(3): 162—174
[4]Wang J H, Nichogiannopoulou A, Wu L,et al. Selective defects in the development of the fetal and adult lymphoid system in mice with anIkarosnull mutation [J].Immunity, 1996, 5(6): 537—549
[5]Winandy S, Wu P, Georgopoulos K. A dominant mutation in thelkarosgene leads to rapid development of leukemia and lymphoma [J].Cell, 1995, 83: 289—299
[6]Payne K J, Dovat S. Ikaros and tumor suppression in acute lymphoblastic leukemia [J].Critical Reviews in Oncogenesis, 2011, 16(1-2): 3—12
[7]Marçaisa A, Jeanneta R, Hernandez L,et al. Genetic inactivation ofIkarosis a rare event in human T-ALL [J].Leukemia Research, 2010, 34(4): 426—429
[8]Gupta S K, Bakhshi S, Kumar L,et al.IKZF1(IKAROS)deletions in B-ALL and its clinical correlation: A prospective study from a tertiary care centre in Northern India [J].Leukemia Research, 2016, 41: 7—11
[9]Wen Q, Wu M R, He Y Z,et al. Correlation ofIKZF1 gene with malignant tumors and systemicLupus erythematosus[J].Journal of Experimental Hematology, 2015,23(2): 591—595 [温琦, 吴美荣, 何颖芝, 等.IKZF1基因与恶性肿瘤及系统性红斑狼疮的相关性研究进展. 中国实验血液学杂志, 2015, 23(2): 591—595]
[10]Lu M X. Review of research onStreptococcosisin tilapia[J].South China Fisheries Science, 2010, 6(1): 75—79[卢迈新. 罗非鱼链球菌病研究进展. 南方水产, 2010,6(1): 75—79]
[11]Ye X, Li J, Lu M,et al. Identification and molecular typing ofStreptococcus agalactiaeisolated from pond-cultured tilapia in China [J].Fisheries Science, 2011, 77(4):623—632
[12]Hoskins A A, Friedman L J, Gallagher S S,et al. Ordered and dynamic assembly of single spliceosomes [J].Science, 2011, 331(6022): 1289—1295
[13]Georgopoulos K, Moore D D, Derfler B. Ikaros: an early lymphoid-specific transcription factor and a putative mediator for T-cell commitment [J].Science, 1992,258(5083): 808—812
[14]Nietfeld W, Meyerhans A. Cloning and sequencing ofhIk-1, a cDNA encoding a human homologue of mouse Ikaros/LyF-1 [J].Immunology Letters, 1996, 48(1—2):139—141
[15]Llippo J, Lampisuo M, Lassila O. AvianIkarosgene is expressed in early embryogenesis [J].Immunology Letters, 1997, 56: 81
[16]John D H. Characterization of Ikaros in rainbow trout [J].Developmental and Comparative Immunology, 1997,21(2): 199
[17]Durand C, Charlemagne J, Fellah J S. Structure and developmental expression ofIkarosin the Mexican axolotl[J].Immunogenetics, 1999, 50(5-6): 336—343
[18]Mayer W E, Tichy H, Terzic J,et al. Identification of two Ikaros-like transcription factors in lamprey [J].Scandinavian Journal of Immunology, 2002, 55(2): 162—170
[19]Willett C E, Kawasaki H, Amemiya C T,et al.Ikarosexpression as a marker for lymphoid progenitors during zebrafish development [J].Developmental Dynamics,2001, 22(4): 694—698
[20]Li F L. An early manifestation of the adaptive immune system and cloning and expression ofIkarosgene in fish[D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2009 [李风铃. 鱼类适应性免疫系统的早期发生以及Ikaros基因的克隆和表达, 博士学位论文,中国海洋大学, 青岛. 2009]
[21]Wang G S, Cooper T A. Splicing in disease: disruption of the splicing code and the decoding machinery [J].Nature Reviews Genetics, 2007, 8(10): 749—761
[22]Mullighan C G, Miller C B, Radtke I. BCR-ABL1 lymphoblastic leukaemia is characterized by the deletion of Ikaros [J].Nature, 2008, 453(7191): 110—114
[23]He L C, Chen S, Zhu Z F,et al. Effect of 3 isoforms of Ikaros on proliferation of human ovarian cancer SKOV3 cells [J].Chinese Journal of Pathophysiology, 2015,31(8): 1407—1411 [贺立彩, 陈尚, 朱真锋, 等. Ikaros的3种亚型对人卵巢癌SKOV3细胞增殖的影响. 中国病理生理杂志, 2015, 31(8): 1407—1411]
[24]Gowda C, Song C, Kapadia M,et al. Regulation of cellular proliferation in acute lymphoblastic leukemia by Casein Kinase II (CK2) and Ikaros [J].Advances in Biological Regulation, 2016: 1—10
[25]Thompson E C, Cobb B S, Sabbattini P,et al. Ikaros DNA-Binding proteins as integral components of B cell developmental-stage-specific regulatory circuits [J].Immunity, 2007, 26(3): 335—344
[26]Belinda J W, Joel P M, David G. Ikaros: a key regulator of Haematopoiesis [J].Biochemistry & Cell Biology,2002, 34(10): 1304—1307
[27]Marvin A P. Zinc finger structure-function in Ikaros [J].World Journal of Biological Chemistry, 2011, 2(6): 161—166
[28]Alinikula J, Lassila O, Nera K P. DT40 mutants: a model to study transcriptional regulation of B cell development and function [J].Sub-cellular Biochemistry, 2006, 40:189—205
[29]Georgopoulos K, Winandy S, Avitahl N. The role of theIkarosgene in lymphocyte development and homeostasis[J].Annual Review of Immunology, 1997, 15: 155—176
[30]Molnár A, Wu P, Largespada D A,et al. The Ikaros gene encodes a family of lymphocyte-restricted zinc finger DNA binding proteins, highly conserved in human and mouse [J].Journal of Immunology, 1996, 156(2): 585—592
