紫茎泽兰对蓝桉种子萌发及苗生长的化感作用
2018-01-24,,,,
, , , ,
(1.西南林业大学, 云南 昆明 650224; 2.云南玉溪森林生态系统国家定位观测研究站, 云南 新平 653400;3.北京林业大学, 北京 100083; 4.海南省海口市秀英区秀英街道“双创”工作指挥部, 海口 570311)
紫茎泽兰(Eupatoriumadenophorum)起源于中美洲墨西哥至哥斯达黎加一带[1],为菊科多年生草本或半灌木植物。借助于人为引种及风力传播,紫茎泽兰已在世界热带、亚热带地区广泛分布,已成为一种世界性入侵杂草[2-3]。大约于20世纪40年代,紫茎泽兰从中缅边境传入我国云南省临沧地区的耿马、沧源等县,约30年后,在云南、四川、贵州、广西等省(区)广泛分布[4]。统计表明,紫茎泽兰发生总面积超过3 800万hm2,其中云南省3 000万hm2,占全省土地面积的76.1%,已遍及全省16个州(市)129个县(市、区),危害程度最高[5-6]。紫茎泽兰具有很强的繁殖能力,常形成庞大的群体,排斥其他植物的生长,剥夺其他物种的生存空间[7-8]。因此,紫茎泽兰的入侵破坏了生态平衡,降低了生物多样性,并对当地农、林、牧业生产造成严重危害,是我国面临的重大生态灾害物种之一[9-13]。
蓝桉(EucalyptusGlobulus)是桃金娘科桉属植物,原产澳大利亚,广泛栽植于我国广东、广西、云南和四川等地,其生长迅速,经济价值较高,是良好的速生用材树种[14-15]。据调查,在桉树林的林下、林缘及林窗均有成片的紫茎泽兰分布,且为草本层中的优势植物[16-17]。据研究,紫茎泽兰有很强的化感作用[18-19],而且其植株不同部位水提液及地上部分不同处理方法水提液对蓝桉种子发芽会产生较大的影响[20-21]。然而,这些研究采用的是培养皿滤纸法,与蓝桉天然更新发生在土壤中有较大区别。化感作用是指释放到土壤中的植物各种次生物质所引起的植物个体间的相生相克现象[22]。为此,本研究拟以蓝桉林下土壤作为栽培基质,将蓝桉种子浅埋在土壤中,用紫茎泽兰叶水提液进行处理,研究不同浓度水提液对蓝桉种子萌发的影响,不同处理时间对蓝桉苗生长化感作用的变化,为揭示紫茎泽兰对蓝桉天然更新过程的影响提供理论依据。
1 材料与方法
1.1 材 料
在云南省绿化种子有限责任公司购买蓝桉种子,产地为昆明。紫茎泽兰叶片采集于西南林业大学后山蓝桉林下,所采植株高度0.5~1.0 m,且无病虫害。实验所需的栽培基质为桉树林下的土壤,采集晾干后用3 mm孔径筛网筛选土样,去除土样中的石块、根系等杂物。
1.2 方 法
1.2.1 紫茎泽兰水提液的制备
植物叶片中含有较多的化感物质[23-24],因此选用紫茎泽兰叶片水提液进行化感作用研究。将采回的新鲜紫茎泽兰叶片清洗、晾干后,再放入85 ℃恒温箱杀酶0.5 h,后转入65 ℃恒温箱烘干至恒重[25],称取100 g分别装于密封塑料中,浸提时取1袋样品置于塑料收纳箱内,按1∶25比例用清水在常温下浸泡24 h后,用2层纱布过滤得到紫茎泽兰提取液的原液(1∶25),再用清水将其分别稀释成3个浓度(1∶50、1∶100、1∶200)的提取液,加上原液1∶25,共4个浓度梯度的紫茎泽兰水提液,以清水作为对照。
1.2.2 紫茎泽兰水提液对蓝桉种子萌发及苗生长的试验
2015年9月13日,将土样放入规格统一的花盆中,平整,将浸泡过的蓝桉种子往每盆均匀地播50粒在土壤表层,再覆盖2~3 mm的表层土。播种后每天定时分别浇1∶25、1∶50、1∶100、1∶200紫茎泽兰水提液50 mL,以清水为对照,每个处理4次重复。每天定时观察并记录每盆的种子萌发数,直至连续几天种子不再萌发为止。根据每天发芽数记录结果,计算发芽速率、发芽率、发芽势[26]。连续浇水提液30 d后,测量苗高度、地径;60 d后,测量苗地径、高度,将苗挖出,分成根、茎、叶3部分,在85 ℃烘箱中烘至恒重后分别称重,除以每盆的株数即得单株根、茎、叶重,3部分之和即为单株总重。
1.2.3 数据统计分析
采用SPSS 13.0处理软件对不同浓度处理后的蓝桉种子发芽速率、发芽率、发芽势、地径、高度、根重、茎重、叶重、总重进行方差分析和多重比较[27]。采用化感效应指数(RI)进行评价,当T
2 结果与分析
2.1 紫茎泽兰水提液对蓝桉种子萌发的影响
由表1可见,在浓度为1∶200、1∶100、1∶50、1∶25水提液处理下,种子发芽率随处理浓度加大而下降,分别为:54.5%、50.5%、43.0%、36.0%,相比对照的58.5%分别减少了6.8%、13.7%、26.5%、38.5%,RI值分别为-0.074、-0.137、-0.265、-0.385。在浓度为1∶200、1∶100、1∶50、1∶25水提液处理下,种子发芽势随处理浓度增大而呈现下降趋势,分别为11.5%、11.0%、9.0%、8.0%,相比对照的12.5%分别减少了8.0%、12.0%、28.0%、36.0%,发芽势RI值分别为-0.083、-0.135、-0.280、-0.360。在紫茎泽兰水提液浓度为1∶200、1∶100、1∶50、1∶25处理下,种子发芽速率随处理浓度升高而下降,分别为2.75、2.45、2.11、1.87,相比对照的2.93分别减少了6.1%、16.4%、28.0%、36.2%,RI值分别为-0.076、-0.166、-0.280、-0.364。由此可见,不同浓度紫茎泽兰水提液处理下,蓝桉种子的发芽率、发芽势、发芽速率均小于对照,且随着水提液浓度的增加,抑制作用加强。经回归分析表明,发芽率、发芽势、发芽速率与水提液浓度呈极显著负相关(p<0.01;图1~图3)。
表1 紫茎泽兰水提液对蓝桉种子萌发的影响

处理(g/mL)发芽率发芽势发芽速率实测值(%)RI值实测值(%)RI值实测值RI值1∶2536.0±1.8*-0.385*8.0±0.8*-0.360*1.87±0.11*-0.364*1∶5043.0±4.2*-0.265*9.0±1.3*-0.280*2.11±0.19*-0.280*1∶10050.5±5.0*-0.137*11.0±1.7*-0.135*2.45±0.26*-0.166*1∶20054.5±4.6-0.07411.5±1.0-0.0832.75±0.32-0.076空白58.5±5.612.5±1.02.93±0.21
注:表中数据为平均值±标准误。“*”表示经t检验不同处理与对照间在5%水平上差异显著。下同。

图1 蓝桉种子发芽率与水提液浓度的回归分析

图2 蓝桉种子发芽势与水提液浓度的回归分析
2.2 紫茎泽兰水提液处理30 d对蓝桉幼苗生长的影响
由表2分析可得,用浓度为1∶200、1∶100、1∶50、1∶25的水提液处理30 d后,蓝桉高度随处理浓度升高而下降,分别为:7.68,7.48,7.23,6.45 cm,与对照的8.08 cm相比,分别减少了5.0%、7.4%、10.5%、20.1%,RI值分别为-0.048、-0.073、-0.104、-0.200。不同浓度水提液处理30 d后,蓝桉地径也随处理浓度增大而下降,分别为:0.51,0.47,0.45,0.41 mm,与对照的0.53 mm相比,分别减少了3.8%、11.3%、15.1%、22.6%,RI值分别为-0.042、-0.118、-0.156、-0.231。由此可见,不同浓度紫茎泽兰水提液处理下的蓝桉高度、地径均小于对照,且随着处理液浓度升高,抑制作用增强。回归分析表明:蓝桉高度、地径与水提液浓度呈极显著负相关(p<0.01;图4、图5)。
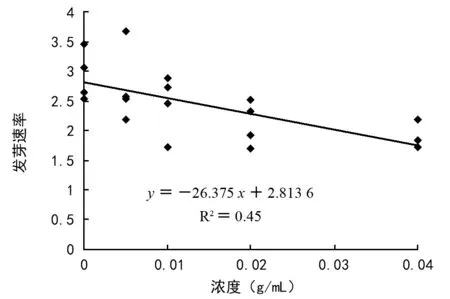
图3 蓝桉种子发芽速率与水提液浓度的回归分析

图4 处理30 d后地径与水提液浓度的回归分析
2.3 紫茎泽兰水提液处理60 d对蓝桉幼苗生长的影响
由表2分析可得,浓度为1∶200、1∶100、1∶50、1∶25处理60 d后,蓝桉的高度随处理浓度升高而下降,分别为:14.26,13.43,11.93,10.36 cm,与对照的16.47 cm相比,分别减少了13.4%、18.5%、27.6%、37.1%,RI值分别为-0.132、-0.182、-0.273、-0.369。不同浓度梯度处理下,蓝桉的地径随处理浓度增大而下降,分别为:1.05,0.94,0.93,0.84 mm,分别比对照减少了4.6%、14.6%、15.5%、23.6%,RI值分别为-0.045、-0.145、-0.157、-0.234。由此可见,不同浓度紫茎泽兰水提液处理下的蓝桉株高、地径均小于对照,且随着处理液浓度升高,抑制作用增强。经回归分析表明:蓝桉高度、地径与水提液浓度均呈极显著负相关,而且决定系数更大(p<0.01;图6、图7)。与处理30 d的比较,化感抑制作用增强,尤其是对高度的抑制作用。
表2 水提液分别处理30,60 d后对蓝桉幼苗生长的影响

处理(g/mL) 处理30d 处理60d 高 度 地 径 高 度 地 径 实测值(cm)RI值实测值(mm)RI值实测值(cm)RI值实测值(mm)RI值1∶256.45±0.38*-0.200*0.41±0.01*-0.226*10.36±0.07*-0.369*0.84±0.00*-0.234*1∶507.23±0.09*-0.104*0.45±0.02*-0.156*11.93±0.09*-0.273*0.93±0.00*-0.157*1∶1007.48±0.10*-0.073*0.47±0.02*-0.118*13.43±0.01*-0.182*0.94±0.01*-0.145*1∶2007.68±0.13-0.0480.51±0.01-0.04214.26±0.01*-0.132*1.05±0.01*-0.045*空白8.08±0.210.53±0.0216.47±0.321.10±0.01
表3 水提液分别处理60 d后对蓝桉幼苗生长的影响

处理(g/mL) 根重 茎重 叶重 总重 实测值(g)RI值实测值(g)RI值实测值(g)RI值实测值(g)RI值1∶250.085±0.009*-0.450*0.099±0.011*-0.387*0.180±0.033*-0.495*0.364±0.043*-0.459*1∶500.130±0.011*-0.163*0.121±0.080*-0.247*0.304±0.033*-0.150*0.555±0.044*-0.175*1∶1000.134±0.006*-0.136*0.134±0.010*-0.169*0.332±0.021-0.0720.599±0.031-0.1101∶2000.153±0.004-0.0140.142±0.008-0.1200.340±0.020-0.0500.634±0.030-0.059空白0.155±0.0030.161±0.0030.357±0.0150.673±0.015
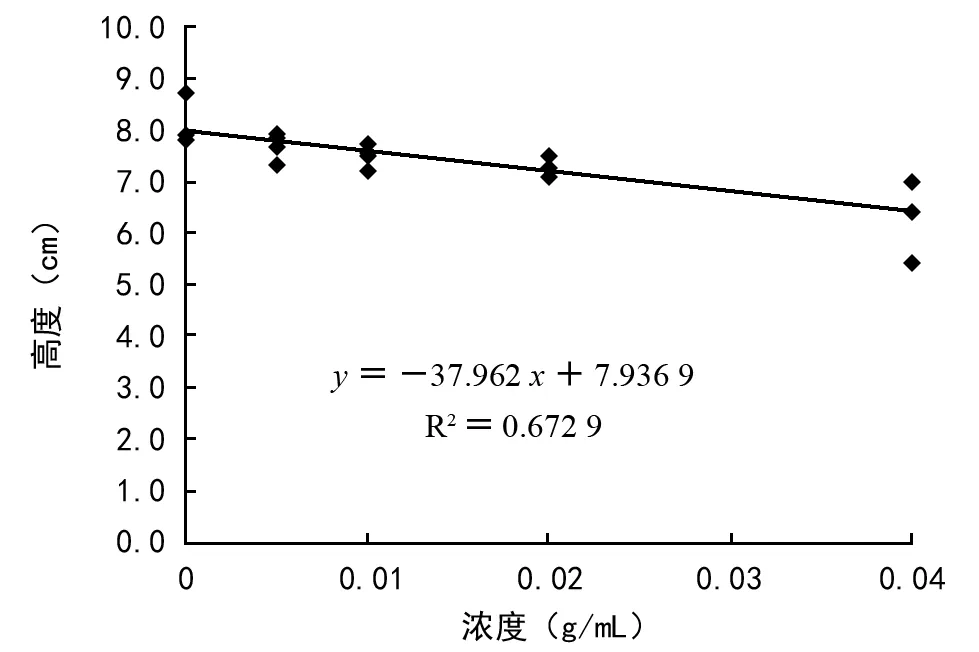
图5 处理30 d后高度与水提液浓度的回归分析
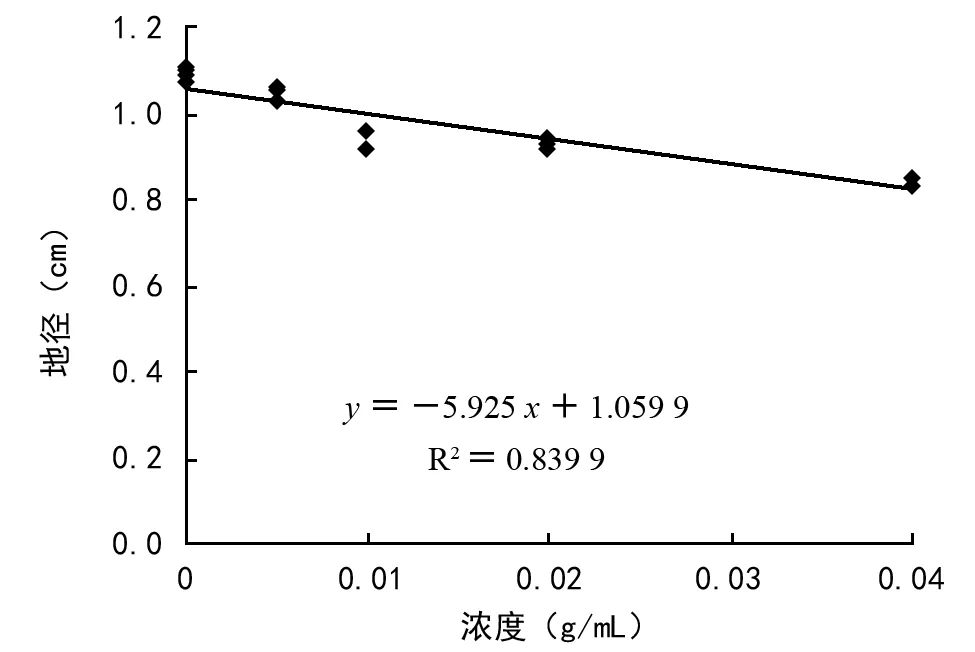
图6 处理60 d后地径与水提液浓度的回归分析

图7 处理60 d后高度与水提液浓度的回归分析
2.4 紫茎泽兰水提液处理60 d后对蓝桉生物量的影响
由表3分析可得,浓度为1∶200、1∶100、1∶50、1∶25的水提液处理60 d后,蓝桉幼苗的根重分别为0.153,0.134,0.130,0.085 g,比对照的0.155 g分别减少了1.4%、13.7%、16.4%、45.0%,RI值分别为-0.014、-0.136、-0.163、-0.450。不同浓度梯度处理下,茎重分别为0.142,0.134,0.121,0.099 g,比对照的0.161 g分别减少了11.6%、16.9%、24.6%、38.5%,RI值分别为-0.120、-0.169、-0.247、-0.387。随着处理液浓度的增加,叶重分别为0.340,0.332,0.304,0.180 g,比对照的0.357 g分别减少了4.7%、7.0%、14.7%、49.5%,RI值分别为-0.050、-0.072、-0.150、-0.495。随着水提液浓度的升高,总重分别为:0.634,0.599,0.555,0.364 g,相比对照的0.673 g分别减少了5.7%、10.9%、17.4%、45.9%,RI值分别为-0.059、-0.110、-0.175、-0.459。由此可见,不同浓度水提液处理60 d后,蓝桉幼苗的根重、茎重、叶重、总重均小于对照,且随着水提液浓度升高,抑制作用增强。经回归分析表明:蓝桉根重、茎重、叶重及总重与水提液浓度均呈极显著负相关(p<0.01;表4)。
表4 蓝桉生物量与水提液浓度的回归分析

生物量指标 回归方程相关系数(r)显著水准(P)根重(g)y=-1.7473x+0.15770.8800.000茎重(g)y=-1.417x+0.15240.7550.000叶重(g)y=-4.3835x+0.36820.8030.000总重(g)y=-7.5485x+0.67830.8690.000
3 结论与讨论
在植物中普遍存在化感作用现象,许多外来入侵植物也可以向环境中释放化感物质。据国外报道,紫茎泽兰叶精油中含有78个挥发性成分,其中44.3%属于倍半萜及其衍生化合物,32.1%为单萜及其衍生化合物,11.6%为对-聚伞花素,12%为其它化合物[29]。紫茎泽兰可以通过雨水和雾滴等淋溶途径产生的酚类、萜类等水溶性的化感物质进入土壤而实现其化感作用[30-36]。本实验采用杀酶烘干方式处理样品,这可能会使其中挥发性成分释放出来,因此,通过水浸提所获得的可能主要是酚类物质,而这些物质也具有化感作用[37-38]。
本研究表明:不同浓度紫茎泽兰水提液处理对蓝桉种子萌发均表现为化感抑制效应,且随处理浓度升高,抑制作用增强。这可能是高浓度水提液含有较多的酚类等化感物质,抑制种子萌发所需的关键酶类[39],影响了种子发芽时ATP的产生和呼吸作用[40],抑制种子内贮藏淀粉和蛋白质的分解,从而影响种子萌发所需要的物质和能量,致使种子萌发受抑制[41],进而显示了较强的化感抑制作用,随浓度降低这种作用在减弱。另外,酚类等化感物质会抑制植物胚根、胚轴的生长[37],因此导致根生长量减少及高生长受抑制。而且,由于发芽速率较慢,萌发的幼苗光合持续的时间较短,将影响其光合产物的积累,影响幼苗根、茎、叶生物量的积累。由于具有浓度效应,故种子萌发、苗生长及生物量指标随着处理浓度的增加而下降。此外,60 d处理比30 d处理对苗生长的化感抑制作用增强,说明这种累积的化感影响会随着时间的延长而加重。
在某些生态系统中,外来植物占据优势,其中化感作用扮演着重要的角色。外来植物常常可以通过释放某些化感物质抑制临近的植物生长,以获取更多的水分、营养等资源,以最大限度增长自身种群[42]。在植物生活史中,种子萌发对物种天然更新十分重要[18,43]。在天然更新过程中,蓝桉种子落到林地表面及林外土壤表面,林下及林外紫茎泽兰往往形成优势种群[16-17]。在紫茎泽兰化感作用影响下,蓝桉发芽率降低会使植物在群落中的多度下降,发芽速率下降、发芽时间变长及出苗延后,将影响蓝桉对地上、地下资源空间的利用和竞争[44-46]。蓝桉苗根生物量减少,则吸收水肥空间范围变小,而高生长受抑制导致植株矮小,叶量减少会影响其光合面积,影响其对光的利用和竞争,这些均会直接影响蓝桉的生长发育及其在群落中的地位和作用[18]。而且,随处理时间延长这种抑制作用变化大。因此,化感作用是阻碍蓝桉天然更新及抑制生长的重要因素。
[1]Paxton J.A pocket botanical dictionary(2nd ed)[M].London:Bradbury and Evans.1849.
[2]Auld B A,Martin P M.The autoecology of Eupatorium adenophorum Spreng.in Australia[J].Weed Research,1975,15:27-31.
[3]强胜.世界恶性杂草:紫茎泽兰研究的历史及现状[J].武汉植物学研究,1998,16(4):366-372.
[4]蒋智林,刘万学,万方浩,等.非洲狗尾草与紫茎泽兰的竞争效应[J].中国农业科学,2008,41(5):1 347-1 354.
[5]Sang W G,Zhu L,Axmacher J C.Invasion pattern of Eupatorium adenophorum Spreng in southern China[J].Biological Invasion,2010,12(6):1 721-1 730.
[6]Qu Y,Xiao Z Q,Zhou G Q,et al.Mapping the distribution of Crofton weed(Eupatorium adenophorum Spreng)in southwest of China using time series remote sensing data[D].Geoscience Remote Sensing IEEE International Symposium,2011:660-663.
[7]刘伦辉,刘文耀,郑征,等.紫茎泽兰个体生物及生态学特性研究[J].生态学报,1989,9(1):66-70.
[8]冯玉元.变害为宝的紫茎泽兰[J].中国林业,2004(9):37.
[9]丁晖,徐海根,刘志磊.外来入侵植物紫茎泽兰对植物多样性的影响[J].生态与农村环境学报,2007,23(2):29-32.
[10]李振宇,谢焱.中国外来入侵种[M].北京:中国林业出版社,2002:163.
[11]吴志红.恶性杂草:紫茎泽兰的危害及控制对策[J].中国植保导刊,2004,24(7):8-10.
[12]宋红霞.紫茎泽兰入侵对生物多样性及土壤养分的影响[J].广东农业科学,2014(1):51-56.
[13]牛红榜,刘万学,万方浩.紫茎泽兰(Ageratinaadenophora)入侵对土壤微生物群落和理化性质的影响[J].生态学报,2007,27(7):3 051-3 060.
[14]陈少雄.中国桉树栽培区的分类研究[J].桉树科技,1996(2):1-7.
[15]祁承经,汤庚国.树木学[M].北京:中国林业出版社,2005.
[16]吴天马,丁晖,刘志磊,等.外来入侵植物紫茎泽兰对土壤养分的影响[J].生态与农村环境学报,2007,23(2):94-96.
[17]涂璟,李宁,王克勤,等.昆明呼马山公园人工桉树林林下植被的多样性和生物量研究[J].林业资源管理,2010(1):64-67.
[18]郑丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2 782-2 787.
[19]曹子林,王晓丽,涂璟.紫茎泽兰不同处理方法水提液对云南松种子萌发的化感作用[J].种子,2011,30(8):46-49,54.
[20]王晓丽,曹子林,朱霞.紫茎泽兰不同处理方法水提液对蓝桉种子发芽的化感效应[J].云南大学学报(自然科学版),2010,32(3):346-351.
[21]曹子林,王晓丽,郭盘江,等.紫茎泽兰植株不同部位及浓度的水提液对蓝桉种子萌发和幼苗生长的化感效应[J].西部林业科学,2009,38(1):91-95.
[22]Weston L A,Duke S O.Weed and crop allelopathy[J].Critical reviews in plant sciences,2003,22(3/4):367-389.
[23]Turk M A,Tawaha A M.Inhibitory effects of aqueous extracts of black mustard on germination and growth of lentil.Journal of agronomy,2002(1):28-30.
[24]Turk M A,Tawaha A M.Allelopathic effect of black mustard (BrassicanigraL.) on germination and growth of wildoat (AvenafatuaL.)[J].Crop Protection,2003,22:673-677.
[25]韩丽梅,沈其容,鞠会艳,等.大豆地上部水浸液的化感作用及化感物质鉴定[J].生态学报,2002,22(9):1 425-1 432.
[26]孙时轩.林木种苗手册[M].北京:中国林业出版社,1985:140-142.
[27]Linder F,Laura H,Edward N,et al.SPSS for Windows version 13.0:A basic tutorial[M].California:McGraw-Hill custom publishing house,2007:46-55.
[28]Willianmson GB.Bioassay for allelopathy:measuring treatment response with independent controls[J].Journal of chemical ecology,1998,14(1):181-187.
[29]Pala-Paul J,Perez-Alonso M J.Analysis by Gas Chromatography-mass Spectrometry of the Volatile Components of Agertina Adenophora Spreng[J].Journal of chromatography A,2002,947(2):327-331.
[30]Baruah N C,Sarma J C,Sarma S,et al.Seed germination and gr ow th inhibitory cadinenes from Eupatorium adenophorum Spreng[J].Journal of chemical ecology,1994,20:1 885-1 892.
[31]Bohlmann F,Rajindex K G.Six cadinene derivative s from Ageratina adenophora[J].Phytochemistry,1981,20:1 432-1 433.
[32]Bordoloi M J,Shakla V D,Sharma R P.Absolute stereo chemistry of the insect antifeedant cadinene from Eupatorium adenophorum[J].Tetrahedron letter,1985,26:509-510.
[33]李蓉涛,丁智慧,丁靖垲.紫茎泽兰的化学成分[J].云南植物研究,1997,19(2):196-200.
[34]许云龙,单欣宙,王宗玉,等.紫茎泽兰的化学成分初报[J].云南植物研究,1988,10(2):238-240.
[35]Yang G Q,Wan F H,Liu W X,et al.Physiological effects of allelochemicals from leachates ofAgeratinaadenophora(Spreng.) on rice seedlings[J].Allelopathy Journal,2006,18:237-246.
[36]Tukey H B J.Leaching of metabolites from above ground plant parts and its implicatio ns[J].Bulletin o f the torrey botanical club,1966,93:385.
[37]赵福庚,何龙飞,罗庆云.植物逆境生理生态学[M].北京:化学工业出版社,2004:13-14.
[38]柴强,黄高宝,黄鹏,等.鹰咀豆根系分泌物的分离鉴定及典型分泌物苯甲醛的化感效应[J].草业学报,2005,14(1):106-111.
[39]Eiuhellig F A.Mechanism of action of allelochemicals in allelpothy[J].Allelopathy,1995(1):97-115.
[40]朱宇林,谭萍,陆绍锋,等.桉树化感效应下si对植物种子萌发的影响[J].种子,2010,29(8):19-22.
[41]熊勇,马卜功,杨青松,等.紫茎泽兰不同组织水提取液对水稻·玉米化感作用机制[J].安徽农业科学,2011,39(14):8 222-8 225,8 249.
[42]Callaway R M,Aschehoud E T.Invasive plants versus the irnew and old neighbors: amechanism for exotic invasion[J].Science,2000,290:521-523.
[43]蒋高明.植物生理生态学[M].北京:高等教育出版社,2004:136.
[44]Ross MA,Harper JL.Occupation of biological space during seedling establishment[J].Journal of Ecology,1972,60:77-88.
[45]Fowler N.The role of competition in plant communities in arid and semi-arid regions[J].Annual review of ecological systematics,1986,17:89-110.
[46]Weiner J,Wright DB,Castro S.Symmetry of below-ground competition between Kochia scoparia individuals[J].Oikos,1997,79:85-91.
