老年晚期胃癌二线化疗疗效与安全性的临床观察
2018-01-24周科汛张维汉吴秋吉王新源李秋
周科汛, 张维汉, 吴秋吉, 王新源, 李秋
610041 成都,四川大学华西医院 腹部肿瘤科(周科汛、吴秋吉、王新源、李秋),胃肠外科(张维汉)
胃癌是最常见的恶性肿瘤之一,尽管其发病率和致死率在全球范围内有所下降[1],但我国胃癌的发病率在所有癌症中,已上升至第二位,仅次于肺癌;与癌症相关的死亡中,胃癌位居第三[2]。有流行病学资料显示,胃癌在40岁之前发病率偏低,但在50~70岁间呈快速增长趋势[3]。尽管现在尚无标准的晚期胃癌治疗方案,在临床实践中,出于对老年晚期胃癌患者一般情况、生存获益与生存质量的考虑,多倾向于采用单药、靶向治疗或者最佳支持治疗,而且经一线治疗失败后,仅有少部分患者接受二线治疗[4]。然而值得思考的是,对于一般情况良好、预计生存期较长的老年患者,放弃二线治疗是否会影响治疗积极性,从而降低疗效,使患者不能达到最佳生存获益。为此,我们回顾性分析了2008年12月~2015年12月在我院接受二线化疗的老年晚期胃癌患者的临床资料,并总结其疗效与安全性,结果如下。
1 资料与方法
1.1 一般资料
选择2008年12月~2015年12月在我院接受二线化疗的老年晚期胃癌患者。
1.2 入组标准
(1)病理组织学确证为胃癌或胃食管结合部的腺癌;(2)一般情况良好,ECOG PS(Eastern Cooperative Oncology Group Performance Status)评分≤2;(3)一线治疗后经影像学评估为疾病进展、接受二线化疗的患者;(4)年龄≥65岁;(5)病例资料完整。
1.3 排除标准
(1)患有双重癌的患者;(2)治疗后未接受疗效评价的患者;(3)未进行安全性评价的患者;(4)二线治疗使用了靶向药物的患者;(5)随访过程中失访的患者。
1.4 疗效分析
具有可评估病灶的患者,其疗效评价参照RECIST 1.0评分:完全缓解(complete response, CR):所有目标病灶消失;部分缓解(partial response, PR):基线病灶长径总和缩小30%;疾病进展(Progression disease, PD)基线病灶长径总和增加20%或出现新病灶;疾病稳定(stable disease, SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。不良反应事件的评价标准参考CTCAE 4.0评分。总生存时间(OS, overall survival)即患者接受二线治疗开始到死亡时间或末次随诊时间。无进展生存时间(PFS, progression-free survival)指患者接受二线治疗开始到疾病进展或死亡时间。
1.5 数据处理
采用prism 5软件进行数据处理,生存分析用 Log-rank 检验及 Kaplan-Meier 法。
2 结 果
2.1 病人情况
我们收集了2008年12月~2015年12月100例在我院接受二线化疗的老年晚期胃癌患者的临床资料。患者年龄跨度为65~81岁;中位年龄为69岁。其中,65~69岁有51人;≥70岁有49人。患者ECOG PS评分均≤2,其中81% ECOG PS评分≤1.71%的患者合并有肺部、心血管、内分泌方面的基础疾病。治疗前,患者血常规、肝肾功能、心电图基本正常。病人基本资料见表1。
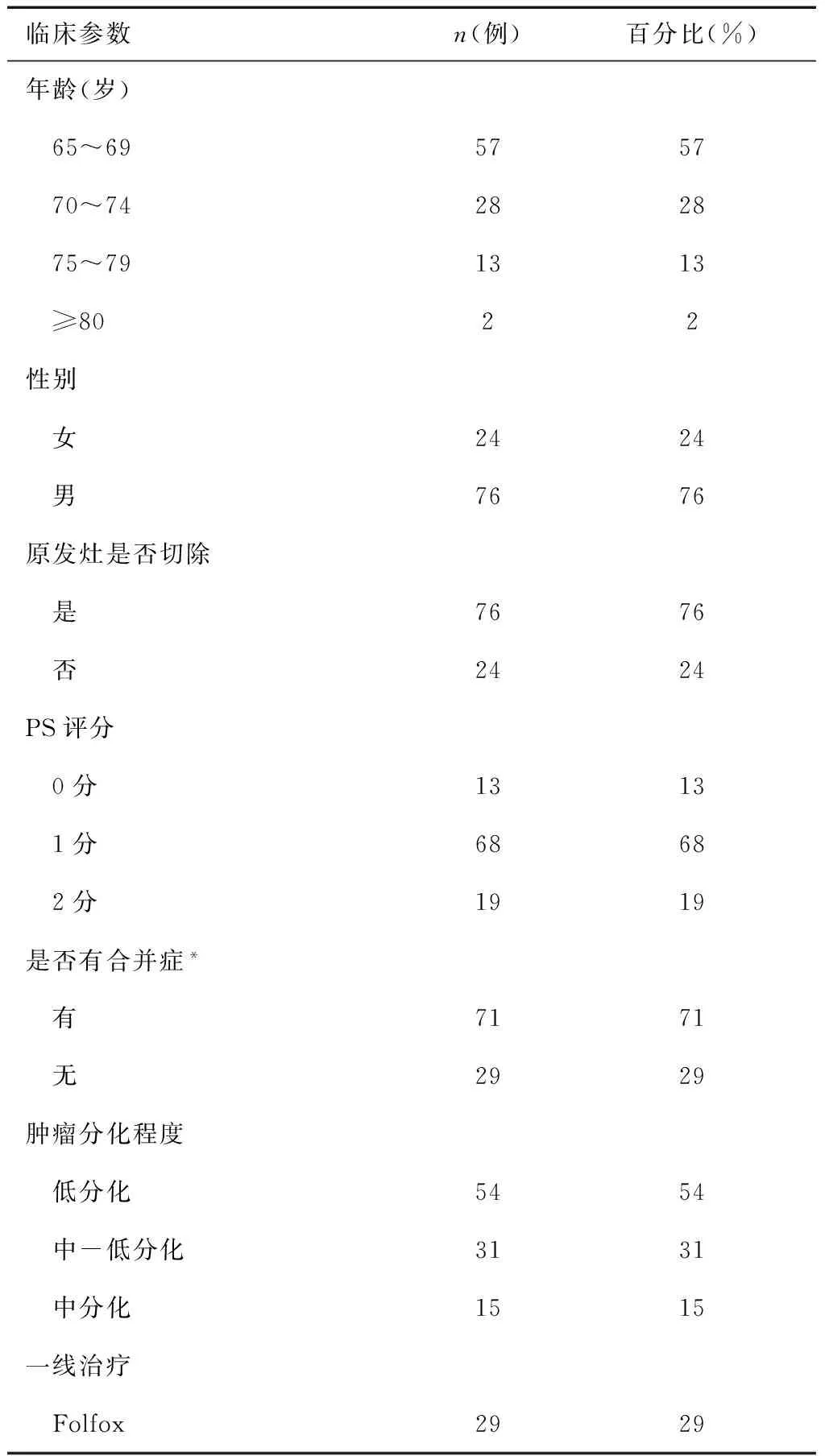
表1 患者基本临床资料(n=100)
(接下表)
(续上表)
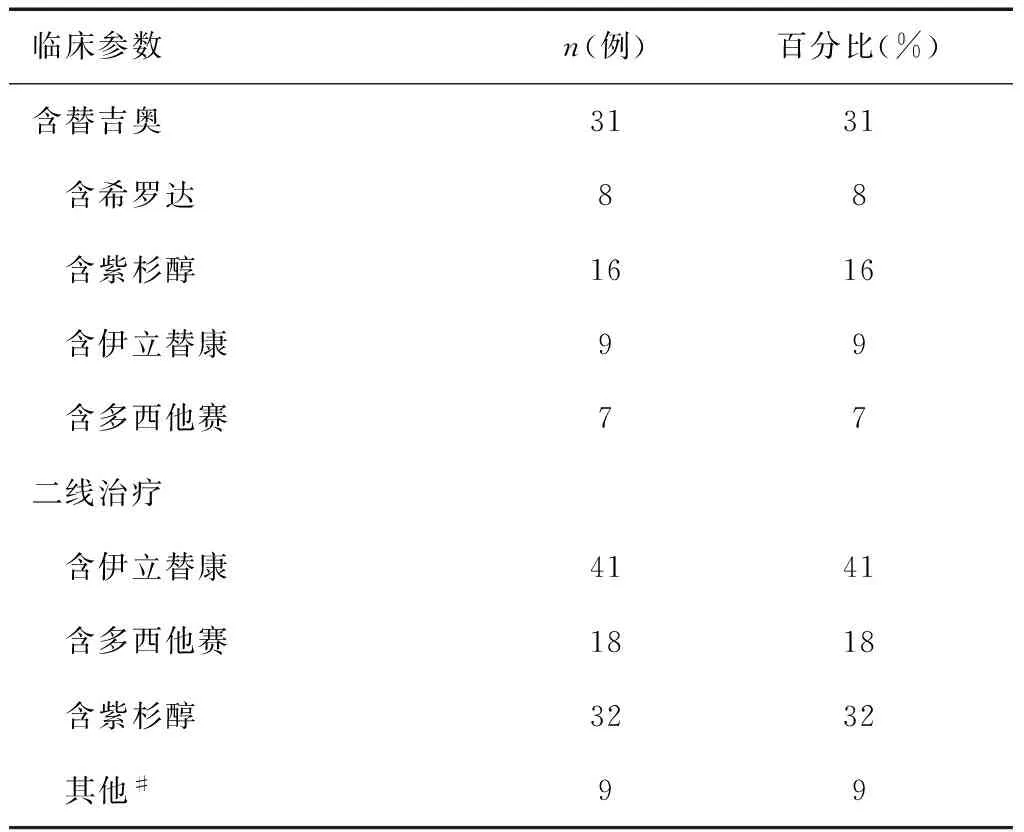
临床参数n(例)百分比(%)含替吉奥3131 含希罗达88 含紫杉醇1616 含伊立替康99 含多西他赛77二线治疗 含伊立替康4141 含多西他赛1818 含紫杉醇3232 其他#99
注:*主要是指合并肺部基础疾病、心血管疾病及内分泌疾病,如慢性支气管炎,肺气肿;高血压,冠心病,糖尿病等。#包括含表柔比星、替吉奥的二线化疗方案。
2.2 治疗方案
9%的患者二线治疗采用单药化疗:5例使用单药伊立替康(120~200mg/m2, d1, q3w),3例为多西他赛(40~75mg/m2, d1, q3w),1例为紫杉醇(135mg/m2, d1, q3w)。82%的患者使用双药化疗方案:含伊立替康:36例(伊立替康:125~180mg/m2, d1,q2w);含多西他赛:15例(多西他赛:60~75mg/m2, d1, q3w);含紫杉醇:31例(紫杉醇:110~175mg/m2, d1, q3w)。另有9例患者采用的是含表柔比星或替吉奥的二线化疗。36%的患者因疾病进展或无法耐受不良反应,给与三线化疗或最佳支持治疗。
2.3 疗效评价
按照RECIST评分标准,有59例可进行疗效评估,其中,SD:18例;PD:41例,无 CR或PR,中位生存期(mOS):6.0月(95%CI:4.92~7.37m);无进展生存时间(PFS):3.9月(95%CI:3.19~4.61m)。我们观察到二线化疗主要以三种药物为主:伊立替康、多西他赛、紫杉醇,所以,我们针对这三种药物,做了亚组分析,结果如下:含伊立替康组OS为4.5月,含多西他赛组OS为6.5月,含紫杉醇组OS为9.0月。各亚组间OS比较:伊立替康VS多西他赛(4.5月vs. 6.0月;P=0.17),伊立替康VS紫杉醇(4.5月vs. 9.0月;P=0.0125),多西他赛VS紫杉醇(6.0月vs. 9.0月;P=0.15)。无疾病进展生存期:含伊立替康组为3.0个月,含多西他赛和紫杉醇组均为3.9月,两两之间比较,均无统计学差异(见图1)。
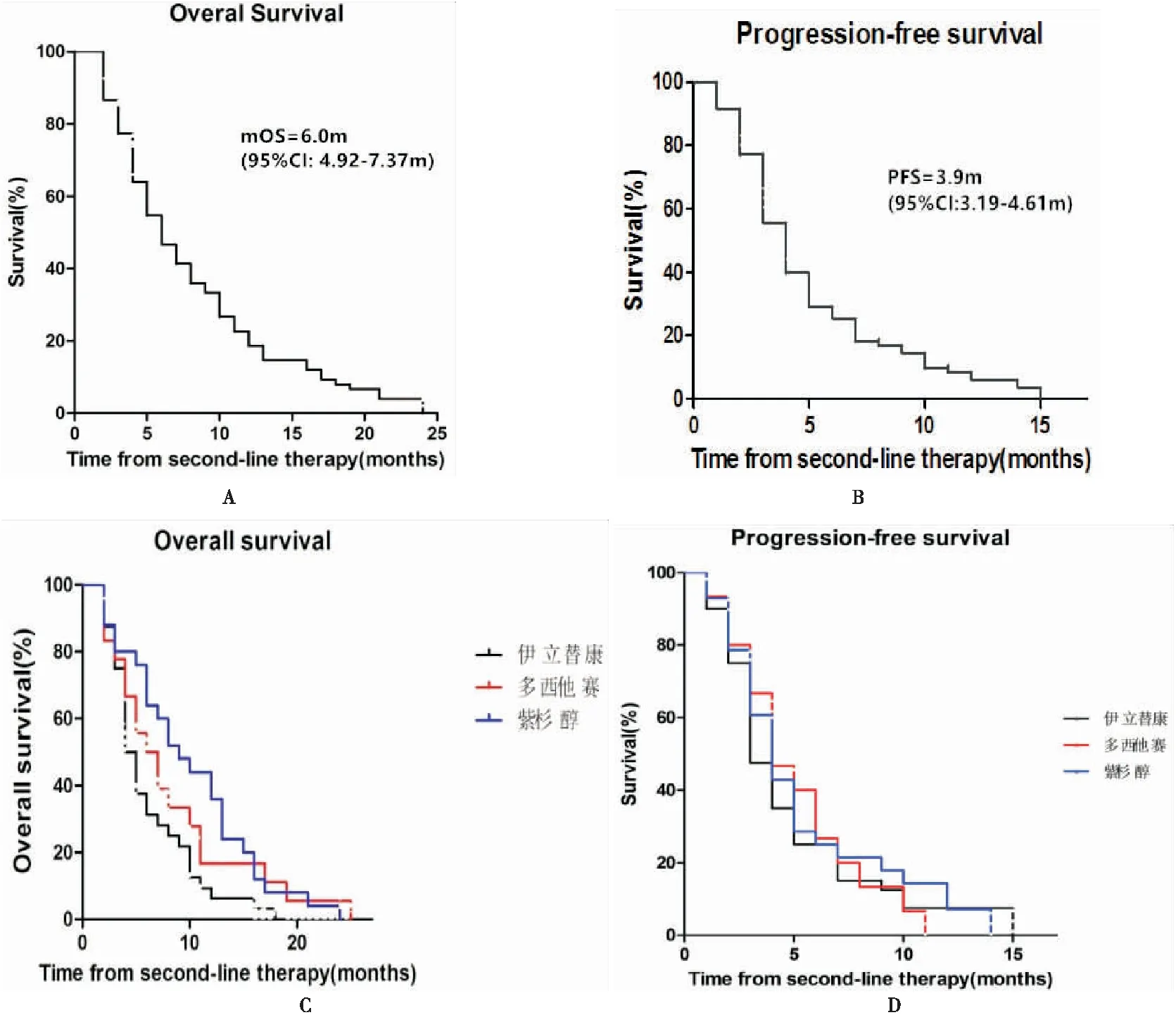
图1 Kaplan-Meier生存分析A.从二线治疗开始至患者死亡或失访的时间(OS) B.从二线治疗开始至疾病进展的时间(PFS) C.不同化疗药物的OS曲线 D.不同化疗药物的PFS曲线
2.4 安全评估
毒副作用主要表现为骨髓抑制、消化道反应。总的不良反应率为75%,其中III~IV级不良反应率为20%,包括18例III~IV级骨髓抑制、1例III级腹泻、1例III级呕吐反应。没有发生致死性V级不良反应(见表2)。

表2 I~IV级不良反应(CTCAE 4.0)
*含替吉奥方案
3 讨 论
胃癌是最常见的胃肿瘤,系源于上皮的恶性肿瘤。其在世界范围内的发病率仅次于肺癌,位居第二位。据2014年数据统计,全球每年新发胃癌病例近100万, 41%发生在中国,全球每年因胃癌死亡约80万,中国占35%[5]。
一线化疗的有效率大约为30%,相比于一线化疗,二线化疗有效率低,副作用也有所增加。但至少有以下几项研究证实了二线化疗的有效性:(1)韩国的一项大型III期临床试验证明,相比于最佳支持治疗,二线治疗采用单药多西他赛或伊立替康,化疗组中位生存时间明显延长(5.3月vs. 3.8月)[6];(2)德国AIO试验证明,相比于最佳支持治疗,单药伊立替康作为二线治疗,能显著延长患者生存期(4.0月vs. 2.4月)[7];(3)Cougar-02 试验证实在患者能耐受不良反应的情况下,多西他赛作为二线治疗能明显延长患者生存期(5.2月vs. 3.6月),并且明显减轻疼痛,改善生活质量[8]。这些前瞻性随机临床研究的结果,为晚期胃癌二线化疗提供了高级别循证依据。
但老年患者因各器官功能下降,且大多合并基础疾病,对化疗的耐受性较年轻人差,容易出现骨髓抑制、肝肾功能异常、消化道等不良反应[9],即使化疗能延长部分患者的生存期,但也很可能降低其生存质量,这些因素都增加了老年胃癌患者治疗的难度。这部分人群在经一线治疗失败后,是采用二线化疗还是最佳支持治疗,仍然存在很大争议。仅有少数的文献报道,对于老年晚期胃癌患者,若一般情况较好,接受二线治疗的疗效是可观的[4,10-11]。日本曾做过一项临床研究,对于经S-1一线治疗失败后的晚期胃癌患者,紫杉醇联合去氧氟尿苷用于二线治疗,结果发现大于70岁及小于70岁的患者具有相似的临床获益率和中位生存期,且在血液学毒性方面两组无差异[12]。我国有文献报道,改良FOLFIRI方案应用于老年晚期胃癌的二线治疗,疗效获得了肯定,且不良反应耐受较好[10]。另外也有文献表明,二线采用5-Fu静脉泵持续点滴或口服氟尿嘧啶类药物卡培他滨对于老年胃癌患者来说,是安全有效的治疗方法[11,13]。
我国在老年晚期胃癌二线治疗方面尚无相关临床试验,文献报道中的案例也较少,不具有广泛性。所以我们采用现有资料,回顾性分析老年晚期胃癌二线化疗的疗效与安全性。我们的研究中主要包含了三种药物:伊立替康,多西他赛,紫杉醇。经临床试验证明,这三种药物应用于晚期胃癌的二线治疗,均能使患者获益[6,7,8,14],2015 年美国NCCN 胃癌指南中,已推荐这三种药物用于胃癌的二线治疗。但它们在老年胃癌二线治疗中,能否获得同样可观的疗效,尚无文献报道。从我们的回顾性分析中发现,经过二线化疗,老年晚期胃癌患者的中位生存期为6.0月,无疾病进展期为3.9月。亚组分析中,含伊立替康组的OS为4.5月;含多西他赛组的OS为6.5月,含紫杉醇组的OS为9月。对于无进展生存期(PFS),伊立替康组为3.0月,多西他赛和紫杉醇组均为3.9月。有两点值得注意:1、伊立替康组与紫杉醇组相比,OS具有统计学差异(4.5月vs. 9.0月;P=0.0125),提示含紫杉醇的化疗方案在延长患者生存期方面,可能优于含伊立替康的化疗方案。日本学者在2013年进行了一项III期临床研究(WJOG 4007G),比较紫杉类药物和伊立替康在晚期胃癌二线治疗中的疗效,虽然最后两者无统计学差异,但单周紫杉醇方案在延长总生存期上显示出一定的优势:两组的中位生存期分别为9.5和8.4月(P=0.38);中位无进展生存期分别为 3.6 和 2.3月(P=0.33)[15]。由于我们的资料中只有一个患者二线治疗采用单药紫杉醇,所以无法比较紫杉醇单药和紫杉醇联合化疗,哪种方案更能延长患者生存。相较于既往报道的文献[7,15],我们所观察到的PFS更长,可能有以下几个原因:(1)我们针对老年患者的一般情况、基础疾病及治疗耐受性,个体化调整药物剂量。根据资料显示,有74%的患者在化疗第一周期即进行了药物减量,其中20例出现III~IV级不良反应的患者,其化疗剂量在随后的周期中再次做了调整。与此同时,我们积极给予患者对症支持治疗,这样使得我们的患者较少出现因耐受性差而中止化疗的情况。(2)若病人一般情况良好,能够耐受不良反应,大多数使用的是双药方案,或许比单药、最佳支持治疗更积极,但这一点还需要前瞻性随机对照的临床试验来证明。(3)临床试验中,一般要求患者6~8周进行复查及疗效评价,而在实践中,我们安排患者2个月左右进行复查,所以我们观察到的中位PFS时间3.9月。(4)1965年Lauren根据胃癌的组织结构和生物学行为,将胃癌分为肠型和弥漫型。肠型胃癌起源于肠化生黏膜,常伴有萎缩性胃炎和肠化生。弥漫型胃癌起源于胃固有黏膜,癌细胞分化较差,呈弥漫性生长。混合型则综合了以上二者特征。本研究中,79%的患者Lauren分型为肠型。据文献报道,肠型侵袭性低,多见于老年人、男性,预后较好[16-18]。这些因素的综合作用,可能使我们的患者获得了较长的无疾病进展生存期。
不良反应方面,III~IV级骨髓抑制的发生率为18%,III~IV级消化道不良反应为2%,在予以对症处理后,患者均能耐受治疗,且治疗前后PS评分无明显变化。在我们所观察到的病例中,没有出现治疗相关性死亡。
综上所述,本研究针对100例≥65岁老年胃癌晚期患者的二线化疗进行了回顾性分析。研究发现,若患者一般情况较好,能够耐受治疗及不良反应,经一线治疗病情进展后,仍能从二线化疗中获益,并且我们建议二线化疗采用含紫杉醇的方案,但此结论还需要大型的临床试验来验证。此外,本篇文章属回顾性分析,样本量较小,数据统计方面可能存在偏倚,因此,我们期待更多关于老年晚期胃癌二线治疗的研究。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Parkin DM, Pisani P, Ferlay J. Estimates of the worldwide incidence of eighteen major cancers in 1985 [J]. Int J Cancer, 1993, 54(4): 594-606.
[2] Lin Y, Ueda J, Kikuchi S, et al. Comparative epidemiology of gastric between Japan and China [J]. World J Gastroentero, 2011, 17(39):4421-4428.
[3] Katherine, Alfred, Neugut. Epidemiology of gastric cancer [J]. World J Gastroentero, 2006, 12(3):354-362.
[4] 曲颜丽,周宁,唐勇.老年进展期胃癌预后的影响因素分析 [J].临床肿瘤学杂志, 2014, 19(3):244-248.
[5] 中华医学会消化内镜学分会.中国早期胃癌筛查及内镜诊治共识意见[J].中国消化杂志, 2014, 34(7):433-448.
[6] Kang JH, Lee SI, Lim DH, et al. Salvage chemotherapy for pretreated gastric cancer: a randomized phase III trial comparing chemotherapy plus best supportive care with best supportive care alone [J]. J Clin Oncol, 2012, 30(13): 1513-1518.
[7] Thuss-Patience PC, Kretzschmar A, Bichev D, et al. Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer—a randomized phase III study of the Arbeitsgemeinschft Internistiche Onkologie (AIO) [J]. Eur J Cancer, 2011, 47(15): 2306-2314.
[8] Ford HER, Marshall A, Bridgewater JA, et al. Docetaxel versus active symptom control for refractory oesophagogastric adenocarcimona (COUGAR-02): an openlabel,phase 3 randomised controlled trial [J]. Lancet Oncol, 2014, 15(1): 78-86.
[9] 殷海涛,张皓,李晓林.老年肿瘤患者的特点与药物治疗新趋势 [J].实用老年医学,2013, 27(1):8-11.
[10] 乐薇,项晓军,张凌,等.改良FOLFIRI方案二线治疗老年晚期胃癌患者的临床观察 [J]. 实用肿瘤志,2013,28(2):200-203.
[11] 孙哲.5-Fu静脉泵持续点滴二线治疗老年晚期胃癌的临床研究[A].江西省肿瘤学术会议[C].2009.
[12] Yakabe T, Noshiro H, Ikeda O, et al. Second-line chemotherapy with paclitaxel and doxifluridine after failure of S-1 in elderly patients with unresectable advanced or recurrent gastric cancer [J]. J Cancer Res Clin Oncol, 2011, 137(10):1499-504.
[13] 武晓楠, 赵赟博, 伍建宇,等.卡培他滨单药治疗老年晚期胃癌临床疗效与不良反应分析[A].中国瘤内科大会教育集暨[C].2009.
[14] Hironaka S, Ueda S, Yasui H, et al. Randomized, openlabel, phase III study comparing irinotecan with paclitaxel in patients with advanced gastric cancer severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus platinum: WJOG 4007 trial [J]. J Clin Oncol, 2013,31(35):4438-4444.
[15] Ueda S, Yasui HS,Nishina H, et al. Randomized phase Ⅲ study ofirinotecan(CPT-11) versus weekly paclitaxel(wPTX)for advanced gastric cancer(AGC)refractory to combination chemotherapy(CT)of fluoropyrimidine plus platinum(FP): WJOG 4007 trial [J]. J Clin Oncol, 2012, 30 suppl;Abstract 4002.
[16] 邓程伟,申竑. 胃癌Lauren分型与其临床病理特点及预后的关系 [J].实用癌症杂志,2014, 29(4):394-396.
[17] Chen YC, Fang WL, Wang RF, et al. Clinicopathological Variation of Lauren Classification in Gastric Cancer [J]. Pathology & Oncology Research, 2015, 22(1):197-202.
[18] 高欣欣, 王新. 影响胃癌患者预后的独立危险因素研究进展 [J]. 肿瘤预防与治疗, 2016, 29(2):123-127.
