由照料者实施的认知刺激治疗对阿尔茨海默病病人及照料者的影响
2018-01-23
阿尔茨海默病(Alzheimer’s disease, AD)是一种以记忆障碍为主的多种认知功能进行性减退的神经变性疾病,为老年痴呆的主要病因。随着人口老龄化不断加剧,痴呆病人人数迅速增加,给国家及人民带来了巨大的经济负担[1]。在我国痴呆病人多为居家的家庭照料模式,家庭照料者是痴呆病人的主要护理来源,且承担着较大的心理压力和负担[2]。认知刺激训练(cognitive stimulation therapy,CST)指在专业治疗师指导下进行的针对特定受损认知功能(如记忆力、执行功能等)的一系列标准任务训练[3]。研究显示,CST可以稳定和改善早中期AD病人的认知功能,提高其日常生活能力[4],在痴呆的治疗中具有较高的性价比[5]。以家庭为单位,由家庭照料者实施个体化CST,将减少对医疗养老机构的大量消耗,且可能更具有实际操作性和便利性。
本研究采用单盲(评定者)随机对照临床研究,评价以家庭为单位,由居家照料者实施的个体化CST对早中期AD病人认知功能和日常生活能力及照料者压力的影响。
1 资料与方法
1.1 研究对象 选择2010年12月至2011年12月某部队驻京干休所50例AD病人及照料者。(1)AD病人纳入标准:① 均符合美国国立神经病学、语言障碍和卒中研究所- 阿尔茨海默病及相关疾病协会(NINCDS- ADRDA)可能或很可能AD诊断标准。② 简易智能状态检查量表(mini- mental state examination, MMSE)评分10~24分。③ 无抑郁症病史。④ 曾予抗精神病药物的病人,至少需经过该药物或其活性代谢产物5个半衰期的时间间隔。(2)家庭照料者纳入标准:① 目前承担AD病人主要照顾任务的家庭成员。② 照顾时间≥3个月。③ 无认知功能障碍,经评定能够配合完成认知训练任务。本研究经解放军总医院道德伦理委员会审核同意,病人和家庭照料者自愿参加本研究并签署知情同意书。排除标准:(1)合并重度视觉和听觉障碍(经校正后仍无法配合训练)或合并使日常生活活动能力降低的器质性疾病。(2)出现痴呆症状前曾有精神病史或药物成瘾史。(3)合并严重糖尿病(未完全控制)或其他疾病而无法配合认知训练。采用随机数字表法分为CST组和对照组(CG组),每组25例。
1.2 方法 专业治疗师以一对一的方式参与并辅导家庭照料者的治疗操作,每次40 min,每周2次,共2周;2周后由照料者单独实施,共24周;此后每8周进行一次,由治疗师参与并对治疗计划和内容进行调整。训练期间,治疗师随时给予照料者电话沟通支持。由同一位对治疗计划完全不知情的临床医师分别于治疗前和治疗24周后对AD病人和家庭照料者进行评定。
1.3 干预内容 治疗师提供的干预内容包括三部分:(1)通过授课方式向照料者讲解认知训练相关技巧(遵循无错学习原则[6]:是一种消除学习过程中不正确反应的康复技术,目的在于避免错误学习的发生,促进认知功能的改善):识别病人认知状况,当病人在学习过程中出现犹豫时,照料者应及时给予认知和心理支持,以减轻病人压力,避免其出现沮丧情绪和挫败感。CST任务由简单到复杂,制定个体化训练内容;训练任务主要包括真实定向练习、流畅性任务练习、重叠图形辨认练习和图片- 故事学习练习四部分[7]。(2)照料者的社会沟通:通过建立照料者互助小组,鼓励其相互沟通、分享成功经验,并通过社会劝说的方式加强照料者的自我效能感[8]。(3)痴呆照料相关知识的讲授:包括一般护理知识和常见精神行为症状的处理方式。CST组干预:第1~3项内容;CG组干预:第3项内容。
1.4 评价工具
1.4.1 AD病人:采用MMSE量表评价病人总体认知功能;采用神经精神症状问卷(neuropsychiatric inventory, NPI)[9]评价12个常见痴呆的精神行为症状;采用日常生活能力量表(activities of daily living,ADL)评定受试者的日常生活能力。
1.4.2 照料者:采用知觉压力量表(Chinese perceived stress scale,CPSS)[10]评价家庭照料者主观知觉压力水平,共包含14项条目,每项评分0~4分,反向条目反向评分,各条目评分之和为总得分,评分越高、压力越大。采用抑郁自评量表(self- rating depression scale, SDS)评价家庭照料者焦虑抑郁程度。照料者积极感受量表(positive aspects of caregiving, PAC)[11]:由自我肯定和生活展望 2 个维度组成, 共9个条目,总分45分,得分越高表示照料者体验到的积极感受越高。
1.5 统计学方法 采用SPSS 19.0统计软件进行数据处理与分析。按照Intent- To- Treat (ITT)原则进行分析,如果研究对象中途退出试验,将按照最后一次测量数据来进行分析。组内比较采用配对t检验;2组间计量资料比较采用LSD-t检验方法,计数资料比较采用卡方检验。以会影响结局的各组基线变量评分为协变量,用协方差分析(ANCOVA)来估计比较干预24周后2组评定结果间的差异。以P<0.05为差异有统计学意义。
2 结果
由于我们的研究入选病人均来自驻京干休所,照料者人群与病人照料关系相对固定,除外CST组1位病人因病退出外,其余均完成全部治疗。研究对象在退出前被要求进行了评测,这些评测结果被纳入ITT分析。
2.1 2组AD病人一般资料比较 CST组年龄(76.96±6.09)岁,男3例,女22例,受教育年限(7.04±2.72)年,CG组年龄(76.12±6.36)岁,男4例,女21例,受教育年限(5.72±2.61)年;2组年龄、性别、受教育年限、基线MMSE、NPI、ADL评分差异均无统计学意义,具有可比性。
2.2 2组干预结果比较 经24周干预治疗后,采用基线值做为协变量对2组数据进行协方差分析,与治疗前比较,CST治疗增加了病人的NPI症状(t=-2.257,P=0.033),但2组间病人的神经精神症状变化差异无统计学意义(F=0.002,P=0.960);2组病人间MMSE(F=0.469,P=0.497)、ADL(F=1.432,P=0.237)评分差异均无统计学意义,见表1。其中有5位CST组照料者及家属认为,经治疗后病人部分日常生活能力有所改善(如通过反复学习,习惯先查阅记事本后根据提示完成日常生活中重要事情),对日常生活质量有改善作用,部分缓解照料者压力。
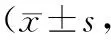
表1 2组AD病人治疗24周前后各项评分比较分,n=25)
注:与治疗前比较,*P<0.05
2.3 2组照料者基线资料比较 2组照料者基线时CPSS、PAC、SDS评分差异均无统计学意义(P>0.05),基线资料具有较好的均衡性,见表2。
2.4 2组照料者干预后资料比较 与干预前比较,CST组照料者PAC(t=- 3.219,P=0.004)和SDS(t=4.201,P=0.001)评分均有显著性改善;采用基线值做为协变量进行协方差分析,治疗后CST组照料者的PAC(F=8.817,P=0.005)、SDS(F=13.43,P=0.001)较CG组有显著改善,差异具有统计学意义,同时未增加照料者CPSS(F=0.213,P=0.646),见表2。

表2 2组照料者治疗24周前后各项评分比较分,n=25)
注:与治疗前比较,**P<0.01;与GC组比较,△△P<0.01
3 讨论
AD病人的认知功能衰退与其脑实质的丢失、突触和神经递质的减少密切相关。CST是基于“用进废退”的原理[12]。通过认知训练增强因缺少刺激而减退的突触功能[13]。无错性学习是一种消除学习过程中不正确反应的康复技术[6]。遵循无错学习原则,通过认知刺激反复强化每位病人关注日常生活需求相关的内隐记忆,可改善痴呆病人工具性日常生活能力[14- 15]。CST课程遵循上述原则,同时为避免出现沮丧情绪和挫败感,在训练过程中及时给予病人认知支持和心理支持。
研究显示基于AD病人尚存的认知功能,运用恰当的认知训练策略对病人进行的CST,可减轻病人的认知功能障碍[16]。本研究中CST训练未显著改善病人认知功能,考虑可能与以下因素有关:(1)研究中对认知能力的评估仅采用MMSE量表进行评定,未对其细化的认知能力进行评定;MMSE量表对较小认知能力变化的敏感性具有一定的局限性[17]。经CST后,病人部分认知功能有所改善,但总MMSE评分无显著好转。(2)因研究人群局限于驻京干休所,入选病人及照料者同质性较好但可入选样本量也较小,因此可能部分结果无法完全显示。(3)目前已有阳性结果的CST研究多为团体干预模式[18],该模式中,团体环境和参与团体治疗的其他成员带来的额外刺激可能与研究结果的差异有关[19]。
荟萃分析结果显示,痴呆病人家庭照料者的精神心理健康问题尤为突出,其中焦虑、抑郁症状最为显著[20]。因此由照料者实施的认知训练是否进一步增加照料者压力和负担,将直接影响认知训练计划实施的可行性及持久性。自我效能,指个体对自己能够应对某种情形的能力和信心的感知,这种信念和感知会对其行为的动机和结果产生重要的影响[8]。
研究中依照自我效能理论,课程内容依据每个病人及照料者特点进行个体化修正,逐渐增加照料者的个体成功体验,以增强其个人的直接自我效能感。建立照料者互助小组,鼓励照料者之间相互沟通、分享认知干预过程中的成功经验;利用社会劝说的方式增强照料者的间接自我效能感,减轻照料者主观知觉压力同时,促使照料者投入更多努力和毅力坚持下去。在24周治疗结束后,由照料者进行的CST并未增加痴呆照料者的知觉压力,同时,照料者的PAC评分显著增加,抑郁评分下降。
本研究优势在于由家庭照料者对AD病人进行居家个体化CST;在关注病人疗效的同时,注重减轻家庭照料者的压力和心理负担。但研究上存在以下不足:(1)研究中入选样本量较少,尚需以后的大样本研究结果支持;(2)入选者为驻京干休所老人,照料关系相对固定,依从性好,但也因此无法全面反映普通社区痴呆病人及照料者对此治疗的依从性;(3)压力的影响与压力事件存在时间的长短有关,本研究干预时间较短,无法反映长期干预治疗对照料者的影响。以后的研究可考虑选取普通社区病人及照料者,增加样本量的同时,对其依从性进行评定。
总之,由居家照料者实施的CST未增加早中期AD病人的精神神经症状,同时照料者的积极感受显著增加,抑郁症状有所减轻,该方法可作为早中期居家AD病人的辅助治疗应用于临床。
[1] Deb A, Thornton JD, Sambamoorthi U, et al. Direct and indirect cost of managing alzheimer’s disease and related dementias in the United States[J]. Expert Rev Pharmacoecon Outcomes Res, 2017,17(2):189- 202.
[2] Sallim AB, Sayampanathan AA, Cuttilan A, et al. Prevalence of mental health disorders among caregivers of patients with Alzheimer disease[J]. J Am Med Dir Assoc, 2015,16(12):1034- 1041.
[3] Kallio EL, Öhman H, Kautiainen H, et al. Cognitive training interventions for patients with Alzheimer’s disease: A systematic review[J]. J Alzheimers Dis, 2017,56(4):1349- 1372.
[4] Bahar- Fuchs A, Clare L, Woods B. Cognitive training and cognitive rehabilitation for mild to moderate Alzheimer’s disease and vascular dementia[J]. Cochrane Database Syst Rev, 2013, 5(6):CD003260.
[5] Knapp M, Thorgrimsen L, Patel A, et al. Cognitive stimulation therapy for people with dementia: cost- effectiveness analysis[J]. BJP, 2006,188:574- 580.
[6] Roberts JL, Anderson ND, Guild E, et al. The benefits of errorless learning for people with amnestic mild cognitive impairment[J]. Neuropsychol Rehabil, 2016,8:1- 13.
[7] Niu YX, Tan JP, Wang LN, et al. Cognitive stimulation therapy in the treatment of neuropsychiatric symptoms in Alzheimer’s disease: a randomized controlled trial[J]. Clinical Rehabilitation, 2010, 24(12):1102- 1111.
[8] Chenoweth L, Stein- Parbury J, White D, et al. Coaching in self- efficacy improves care responses, health and well- being in dementia carers: a pre/post- test/follow- up study[J]. BMC Health Serv Res, 2016, 16:166.
[9] Cummings JL. The neuropsychiatric inventory: assessing psychopathology in dementia patients[J]. Neurology, 1997, 48(5 Suppl 6):S10- S16.
[10] Ezzati A, Jiang J, Katz MJ, et al. Validation of the perceived stress scale in a community sample of older adults[J]. Int J Geriatr Psychiatry, 2014, 29(6): 645- 652.
[11] Siow JYM, Chan A, Østbye T, et al. Validity and reliability of the positive aspects of caregiving (PAC) scale and development of its shorter version (S- PAC) among family caregivers of older adults[J]. Gerontologist, 2017, 57(4):e75- e84.
[12] Swaab DF, Dubelaar EJ, Hofman MA, et al. Brain aging and Alzheimer’s disease; use it or lose it[J]. Prog Brain Res, 2002,138: 345- 375.
[13] Boyles JK, Zoellner CD, Anderson LJ, et al. A role for apolipoprotein E, apolipoprotein A- I, and low density lipoprotein receptors in cholesterol transport during regeneration and remyelination of the rat sciatic nerve[J]. J Clin Invest, 1989, 83(3):1015- 1031.
[14] Voigt- Radloff S, de Werd MM, Leonhart R, et al. Structured relearning of activities of daily living in dementia: the randomized controlled REDALI- DEM trial on errorless learning[J]. Alzheimers Res Ther, 2017,9(1):22.
[15] Bourgeois J, Laye M, Lemaire J, et al. Relearning of activities of daily living: A comparison of the effectiveness of three learning methods in patients with dementia of the Alzheimer type[J]. J Nutr Health Aging, 2016,20(1):48- 55.
[16] Kallio EL, Öhman H, Kautiainen H, et al. Cognitive training interventions for patients with Alzheimer’s disease: A systematic review[J]. J Alzheimers Dis, 2017,56(4):1349- 1372.
[17] Ciesielska N, Sokoowski R, Mazur E, et al. Is the Montreal Cognitive Assessment (MoCA) test better suited than the Mini- Mental State Examination (MMSE) in mild cognitive impairment (MCI) detection among people aged over 60? Meta- analysis[J]. Psychiatr Pol, 2016, 50(5):1039- 1052.
[18] Orrell M, Aguirre E, Spector A, et al. Maintenance cognitive stimulation therapy for dementia: single- blind, multicentre, pragmatic randomised controlled trial[J]. Brit J Psychiat, 2014,204(6):454- 461.
[19] Fischer A. Environmental enrichment as a method to improve cognitive function. What can we learn from animal models? [J] Neuroimage, 2016, 131: 42- 47.
[20] Farina N, Page TE, Daley S, et al. Factors associated with the quality of life of family carers of people with dementia: A systematic review[J]. Alzheimers Dement, 2017, 13(5):572- 581.
