高浓大豆分离蛋白酶解制备鲜味基料的研究
2018-01-23周文斯熊犍郑雪君陈智光王海萍崔春
周文斯,熊犍,郑雪君,陈智光,王海萍,崔春*
(1.华南理工大学 食品科学与工程学院,广州 510640;2.广东真美食品股份有限公司,广东 潮州 515637)
高浓技术是指在发酵或酶解过程中通过提高底物浓度、降低体系水分含量,从而提高单位设备生产效率、节约资源能源的一种新型绿色技术[1]。高浓蛋白酶解技术具有许多优点:显著提高了生产设备利用率,提升了单位设备的产能;单位产品产生废水更少,废水治理成本低;酶解产物的浓缩、干燥所耗能量更低。以生产水解度为4.5%的改性小麦面筋蛋白为例,当酶解体系的固形物浓度从10%提高到40%时,单位重量改性面筋蛋白所需水的消耗和浓缩能耗分别降低6倍和5.97倍,单位体积酶解罐的产能提高3.97倍[2]。因此,高浓蛋白酶解技术在食品工业中有着广泛的应用前景。本文将酶解液中固形物浓度超过20%或以上称为高浓体系。
然而,高浓蛋白酶解体系中,不溶性酶解残渣占酶解体系的比例显著增加,常规的离心或稀释处理可能导致水解度和蛋白回收率测定产生较大误差。此外,高浓蛋白酶解体系中蛋白质的溶解度和聚集状态发生较大变化[3,4],其酶切位点和酶解工艺可能与常浓蛋白酶解体系有较大差异。
因此,本实验拟以大豆分离蛋白为原料,优化了高浓蛋白酶解体系中水解度和蛋白回收率的测定方法,并通过酶种类、pH、温度和加酶量单因素试验,结合感官评价,对高浓大豆分离蛋白酶解工艺进行优化,以期为高浓大豆蛋白酶解的产业化提供理论指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
1.1.1.1 材料
大豆分离蛋白 山东香驰豆业科技有限公司;氢氧化钠(分析纯) 天津市明亮化学试剂厂;盐酸(分析纯) 广东省东红化工厂;硼酸(分析纯) 天津市福晨化学试剂厂;硫酸(分析纯) 江苏强盛功能化学股份有限公司;甲醛(分析纯) 广东光华化学有限公司;硫酸钾、溴甲酚绿、甲基红(分析纯) 广州市金华大化学试剂有限公司。
1.1.1.2 酶制剂
复合蛋白酶(食品级)、碱性蛋白酶(食品级)、风味蛋白酶(食品级) 北京诺维信酶制剂公司;中性蛋白酶(食品级) 杰能科生物工程有限公司;酸性蛋白酶(PR23食品级) 广东裕力宝酶制剂公司。
1.1.2 主要仪器设备
PHS-3E数显pH计 上海精密科学仪器有限公司;GL-21M高速冷冻离心机 湘仪离心机仪器有限公司;101A-2数显电热鼓风干燥箱 上海浦东跃欣科学仪器厂;Sartotius BP211D分析天平 中科院广州化学研究院;KND-2C定氮仪、KDN-40消化炉 上海纤检仪器有限公司;THZ-82A 水浴恒温振荡器 金坛市华城开元实验仪器厂;磁力搅拌器 国华电器有限公司。
1.2 检测与分析方法
1.2.1 水解度的测定方法
配制pH为3.5的大豆分离蛋白溶液100 g,浓度分别为8%,16%,24%,32%,添加底物质量1%的酸性蛋白酶(PR23),磁力搅拌均匀。在55 ℃下分别酶解8,18,48 h,沸水浴20 min灭酶。酶解物的总氮含量为TN,采用以下4种预处理方法并测定水解度:
直接测定酶解物的氨基酸态氮含量AN1;分别将浓度为16%,24%,32%的酶解物稀释到8%,测定稀释后酶解物的氨基酸态氮含量AN2;酶解物经6000 g离心15 min,过滤后获得上清液,测定上清液的氨基酸态氮含量AN3;分别将浓度为16%,24%,32%的酶解物稀释到8%,6000 g离心15 min,过滤后获得上清液,测定上清液的氨基酸态氮含量AN4。水解度的测定参考Cui等的方法[5],总氮含量的测定采用凯氏定氮法(参照GB 5009.5-2010),氨基酸态氮含量的测定采用甲醛滴定法。

1.2.2 蛋白回收率的测定方法
同1.2.1的方法,配制pH为3.5,不同浓度不同酶解时间的大豆分离蛋白溶液。原料总蛋白含量为M,采用以下2种预处理方法并测定蛋白回收率:
酶解物经离心、过滤后获得上清液,测定上清液的总蛋白含量为M1=上清液总氮×上清液质量;
分别将浓度为16%,24%,32%的酶解物稀释到8%,离心、过滤后获得上清液,测定上清液的总蛋白含量为M2=上清液总氮×上清液质量。
参考贾爱娟[6]的方法并稍做修改。采用凯氏定氮法分别测定上清液和原料中蛋白质的含量。

1.3 高固形物浓度酶解工艺优化
1.3.1 高固形物浓度酶解工艺中酶的筛选
配制底物浓度为32%,质量为100 g的大豆分离蛋白溶液5份。选取5种商业蛋白酶,分别调节pH和温度至各种酶的最适条件(风味蛋白酶、复合蛋白酶和中性蛋白酶的最适条件为50 ℃,pH 7.0,酶解时间8 h,加酶量1%;碱性蛋白酶的最适条件为55 ℃,pH 8.0,酶解时间8 h,加酶量1%;酸性蛋白酶(PR23)的最适条件为55 ℃,pH 3.5,酶解时间8 h,加酶量1%),磁力搅拌均匀后酶解8 h,沸水浴20 min灭酶,分别稀释至浓度为8%,测定其水解度和蛋白回收率。
1.3.2 高固形物浓度酶解工艺中pH、温度和加酶量的确定
配制底物浓度为32%,质量为100 g的大豆分离蛋白溶液10份,分别在pH为2.5,3.0,3.5,4.0,4.5,6.0,6.5,7.0,7.5,8.0条件下(温度为55 ℃,加酶量为底物重量的1%);在40,45,50,55,60 ℃条件下(pH 3.5,加酶量为底物重量的1%);分别添加底物质量0.2%,0.5%,1%,1.5%,2%的商业蛋白酶(温度为55 ℃);磁力搅拌均匀后酶解8 h,沸水浴20 min灭酶,分别稀释至浓度为8%,测定其水解度和蛋白回收率。
1.3.3 最优酶解工艺制备大豆鲜味基料的感官评价
感官评价法是对呈味物质分析最常用的方法[7]。本实验使用定量描述分析(QDA)方法,在(23±2) ℃的感官评定室进行评定。采用两种配方,分别是0.1%酶解物直接评价和0.1%酶解物+0.3%食盐调配,用饮用水配制成100 mL溶液。每个样品溶液取10 mL盛放在杯中,鉴评员将溶液全部浸入口中,并保持10 s左右的时间,然后吐出。感官评价使用线性图形标度,0~9分制(无感觉-阈值感觉-微弱-中等-强烈),定量描述分析结果用雷达图表示[8]。
2 结果与分析
2.1 高固形物浓度酶解体系中水解度和蛋白回收率预处理方法的建立
水解度(degree of hydrolysis, DH)是指蛋白质分子在水解过程中被断裂的肽键数和原料中总肽键数的百分比[9]。在蛋白质水解度的测定上,国际上普遍采用的预处理方法是离心或过滤处理[10,11]。
本实验将浓度为8%,16%,24%,32%的大豆分离蛋白溶液分别进行8 h(轻度),18 h(中度),48 h(深度)不同程度的酶解,采用4种不同预处理方法处理大豆蛋白水解物并测定酶解物的水解度,结果见图1。
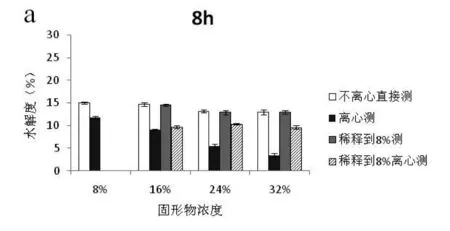

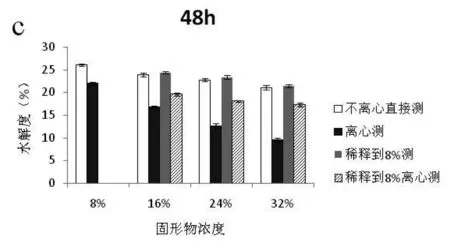
图1 预处理方法对不同浓度大豆蛋白酶解液的水解度的影响Fig.1 Influence of different pretreatments on DH of SPI for different concentration
注:DH分别随酶解时间8 h(a),18 h(b),48 h(c)的变化趋势。
由图1(a,b,c)可知,随着酶解时间的延长,大豆蛋白的水解度越高。在水解度的测定方面,不离心直接测定和稀释到8%测定酶解物水解度的结果基本一致,而采用离心处理后水解度显著降低,且固形物浓度越高,离心预处理造成的误差越大。推测是由于固形物浓度较高时,酶解物离心后残留渣较多,而残渣中保留一部分游离氨基酸和寡肽导致测定结果偏低。而稀释后离心处理可有效降低残留在残渣中氨氮含量,从而缩小测定值差距。上述结果表明:离心处理后所测的不同浓度下蛋白水解度不能反映其真实水解效果,因此本实验选取不离心直接测酶解物的方法作为高浓酶解物水解度测定的预处理方法。
采用两种不同预处理方法处理大豆蛋白水解物并测定酶解物的蛋白回收率,结果见图2。
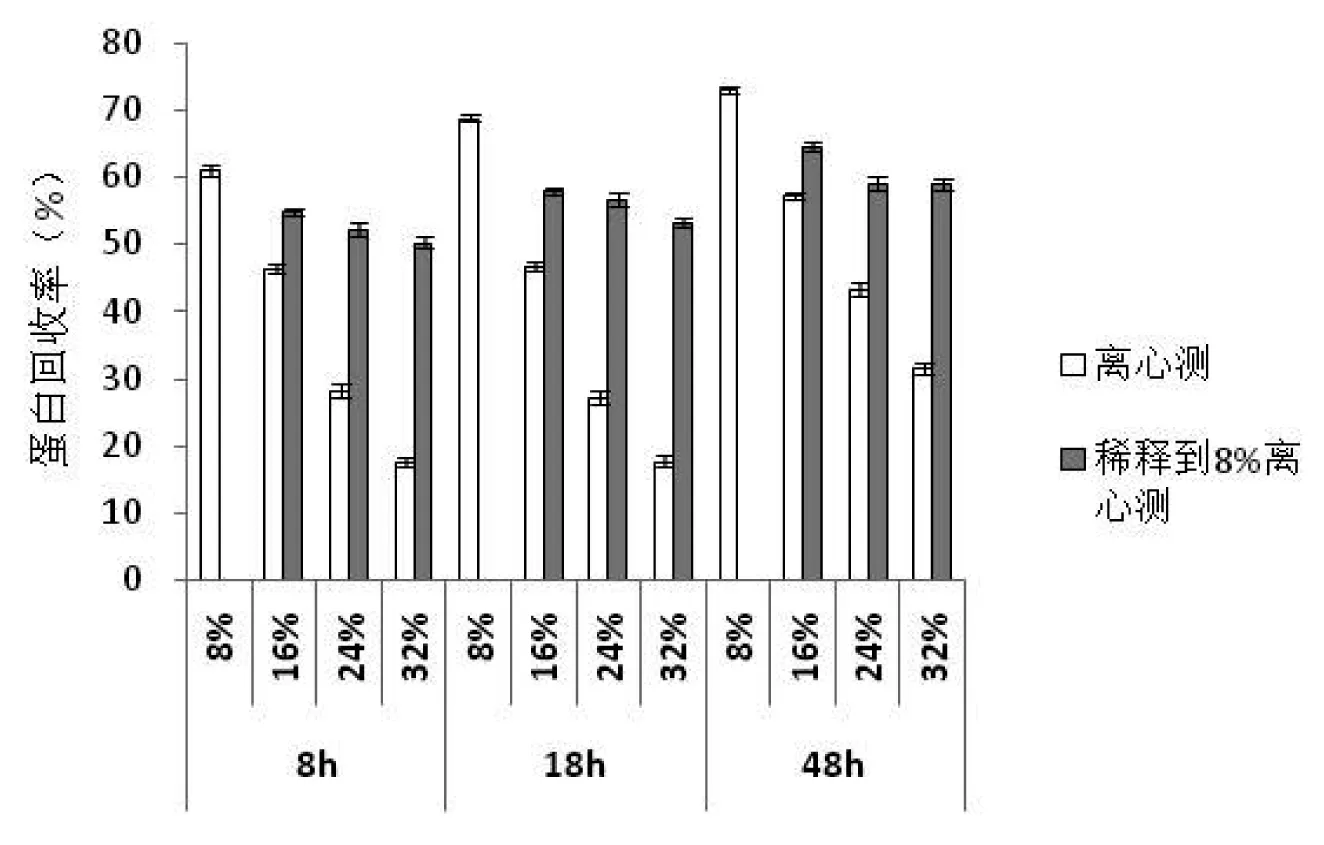
图2 预处理方法对不同浓度大豆蛋白酶解液的蛋白回收率的影响Fig.2 Influence of different pretreatments on protein recovery of SPI for different concentration
蛋白回收率表示原料中的蛋白质经生物酶分解作用后,酶解液上清液中的蛋白总量占原料中的蛋白总量的百分比,即原料中的蛋白质被分解回收的程度。由图2可知,直接离心测定的蛋白质回收率测定结果偏低,而稀释到8%再离心测定的蛋白回收率更接近准确值。这是由于固形物浓度较高时,蛋白质分子容易发生聚集反应,因此降低了可溶蛋白质含量。因此,本实验选取稀释到8%再离心酶解物的方法作为高浓酶解物蛋白回收率测定的预处理方法。经相关性分析,水解度(直接测定)和蛋白回收率(稀释离心)的相关系数r=0.773,相关性极显著(P<0.01),两个指标存在很强的相关性。在相同水解条件下,水解度越高,蛋白回收率越高。
2.2 高固形物浓度酶解工艺的优化
以大豆分离蛋白为原料,以水解度和蛋白回收率为指标,通过酶种类、pH、温度和加酶量单因素试验,结合感官评价,对高浓大豆分离蛋白酶解工艺进行优化。
2.2.1 不同商业蛋白酶对高浓大豆分离蛋白酶解效率的影响
大豆分离蛋白经控制酶解后可产生氨基酸和呈味肽,一般经验表明,水解度越高,大豆蛋白酶解物的呈味强度越高。本试验对各种商业蛋白酶的水解效率进行了评价,从而筛选出适用大豆蛋白水解的最佳酶制剂。不同商业蛋白酶对高浓大豆分离蛋白溶液水解的效果见图3。
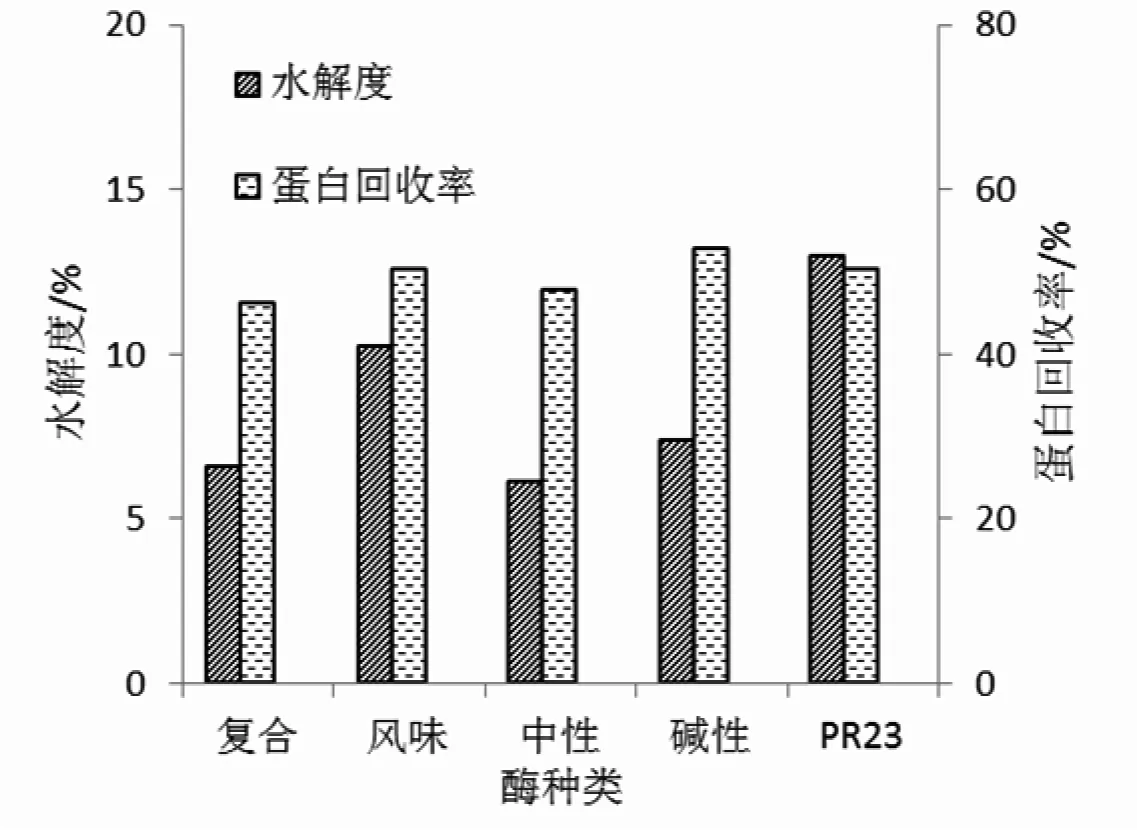
图3 不同商业蛋白酶对高浓大豆分离蛋白溶液水解效率的影响Fig.3 Influence of different proteases on hydrolysis degree of high-concentration SPI
由图3可知,5种商业蛋白酶对高浓大豆分离蛋白溶液均产生了不同程度的水解,其中酸性蛋白酶(PR23)、碱性蛋白酶、风味酶的效果较为明显,其中酸性蛋白酶(PR23)水解度最高,风味酶次之,分别达到12.98%和10.24%,其他3种酶均低于8%。碱性蛋白酶蛋白回收率最高,酸性蛋白酶(PR23)和风味蛋白酶次之,分别达到52.97%,50.28%和50.27%,其他两种酶均低于50%。综合考虑水解度和蛋白回收率这两个指标,选择酸性蛋白酶(PR23)进一步研究。
2.2.2 不同pH对高浓大豆分离蛋白酶解效率的影响
不同pH酸性蛋白酶(PR23)对高浓大豆分离蛋白酶解的影响见图4。
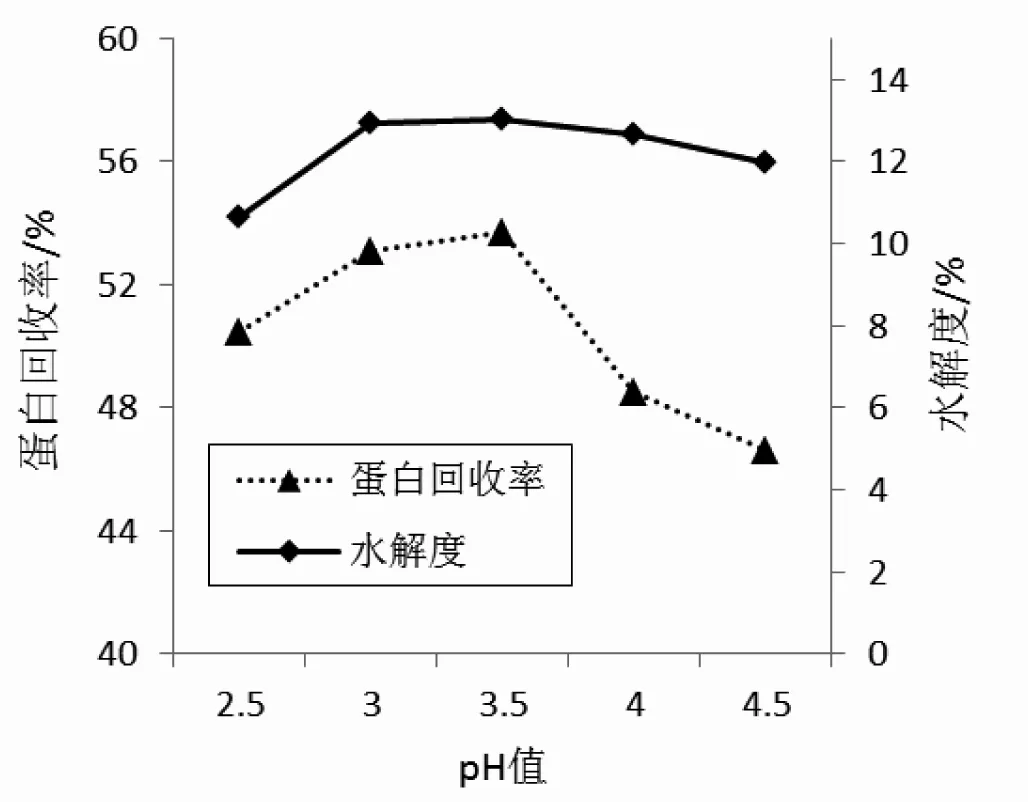
图4 不同pH值对酸性蛋白酶(PR23)酶解高浓大豆分离蛋白的影响Fig.4 Influence of different pH on hydrolysis degree of high-concentration SPI enzymatic hydrolyzed by acid protease(PR23)
pH是影响蛋白体系酶解效率的重要因素之一,影响酶分子的结构稳定性和底物的解离,从而影响酶解效率[12,13]。由图4可知,当pH从2.5上升到3.5时,水解度和蛋白回收率随之增大,当pH继续升高时,两指标反而下降。蛋白体系pH为3.5时,水解度和蛋白回收率分别达到13.00%和50.45%,为酸性蛋白酶(PR23)的最适pH值。
2.2.3 不同温度对高浓大豆分离蛋白酶解效率的影响
不同温度酸性蛋白酶(PR23)对高浓大豆分离蛋白酶解的影响见图5。
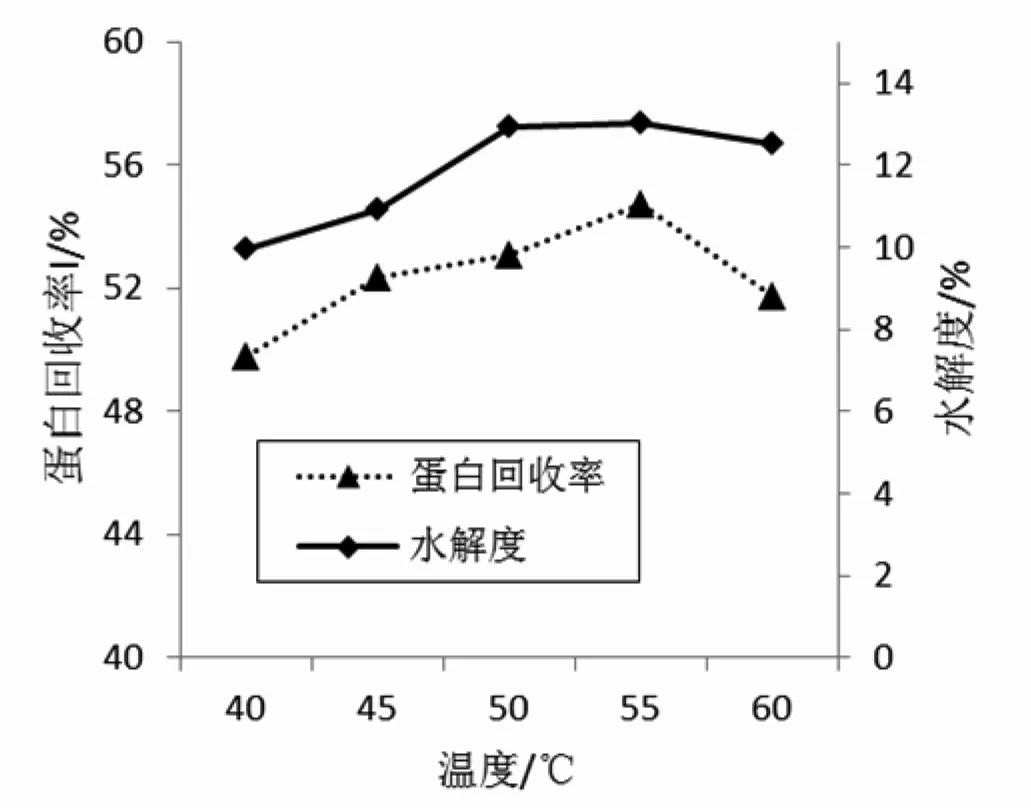
图5 不同温度对酸性蛋白酶(PR23)酶解高浓大豆分离蛋白的影响Fig.5 Influence of different temperatures on hydrolysis degree of high-concentration SPI enzymatic hydrolyzed by acid protease(PR23)
蛋白酶作用都有一个最适温度范围,温度过低不利于酶解,温度过高酶失活。由图5可知,当反应温度从40 ℃上升到55 ℃时,水解度和蛋白回收率随之增大,当温度继续升高时,两指标反而下降。蛋白体系反应温度为55 ℃时,水解度和蛋白回收率分别达到13.01%和54.71%,为酸性蛋白酶(PR23)的最适反应温度。
2.2.4 不同加酶量对高浓大豆分离蛋白酶解效率的影响
不同酶用量酸性蛋白酶(PR23)对高浓大豆分离蛋白酶解的影响见图6。

图6 不同加酶量对酸性蛋白酶(PR23)酶解高浓大豆分离蛋白的影响Fig.6 Influence of different protease amount on hydrolysis degree of high-concentration SPI enzymatic hydrolyzed by acid protease(PR23)
在酶解反应过程中,当酶浓度较低时,体系反应速度随着酶浓度的升高而加快,但当酶达到一定浓度时,酶自身相互水解限制了酶对底物的水解作用。由图6可知,随着酶用量的增加,水解度和蛋白回收率不断增大。工业生产的过程中,除了考虑酶解效率外,还需要考虑生产成本。因此,综合考虑,选择1%作为最适酶用量,水解度和蛋白回收率分别达到13.08%和51.13%。
2.2.5 大豆蛋白高浓酶解产物的感官评价

图7 两种配方高浓大豆分离蛋白酶解产物感官对比Fig.7 Comparison of two formula of SPI concentrated enzymatic hydrolysates on sensory quality results
由图7可知,两种配方高浓大豆分离蛋白酶解产物的感官评分相对差别较大。0.1%酶解物直接评价鲜味评分均为5.0,苦味评分均为5.0,酸味评分均为2.0,厚味评分均为4.0,咸味评分均为5.0;而0.1%酶解物+0.3%食盐调配的鲜味评分均为6.0,苦味评分均为3.0,酸味评分均为1.5,厚味评分均为6.0,咸味评分均为5.0。这表明添加食盐可显著地降低大豆蛋白酶解物的苦味,增强其鲜味和厚味。
3 结论
在高浓蛋白酶解体系中,水解度测定采用不离心直接测酶解物的预处理方法,蛋白回收率测定采用稀释离心的预处理方法较能反映真实水解效果。选择酸性蛋白酶(PR23)在pH 3.0,温度55 ℃,加酶量1%条件下,酶解8 h,水解度和蛋白回收率分别达到13.08%和51.13%;同时感官评价结果表明;0.1%高浓蛋白酶解物与3%食盐进行调配,显著降低了苦味,增强了鲜味和厚味。本文可为高浓大豆分离蛋白酶解制备鲜味基料的产业化提供理论指导。
[1]Xue Y,Jameel H,Phillips R,et al.Split addition of enzymes in enzymatic hydrolysis at high solids concentration to increase sugar concentration for bioethanol production[J].Journal of Industrial and Engineering Chemistry,2012,18(2):707-714.
[2]Hardt N A,Goot A J,Boom R M.Influence of high solid concentrations on enzymatic wheat gluten hydrolysis and resulting functional properties[J].Journal of Cereal Science,2013,57(3):531-536.
[3]O' Loughlin I B,Murray B A,Brodkorb A,et al.Whey protein isolate polydispersity affects enzymatic hydrolysis outcomes[J].Food Chemistry,2013,141(3):2334-2342.
[4]McPhie P,Ni Y,Minton A P.Macromolecular crowding stabilizes the molten globule form of apomyoglobin with respect to both cold and heat unfolding[J].Journal of Molecular Biology,2006,361(1):7-10.
[5]Cui C,Hu Q,Ren J,et al.Effect of the structural features of hydrochloric acid-deamidated wheat gluten on its susceptibility to enzymatic hydrolysis[J].Journal of Agricultural and Food Chemistry,2013,61(24):5706-5714.
[6]贾爱娟.提高高盐稀态法酿造酱油原料蛋白质利用率及氨基酸出品率的研究[D].杨凌:西北农林科技大学,2006.
[7]付娜,王锡昌.滋味物质间相互作用的研究进展[J].食品科学,2014,35(3):269-275.
[8]马永强,韩春然,刘静波.食品感官检验[M].北京:化学工业出版社,2007.
[9]徐英操,刘春红.蛋白质水解度测定方法综述[J].食品研究与开发,2007,28(7):173-176.
[10]Babini E,Tagliazucchi D,Martini S,et al.LC-ESI-QTOF-MS identification of novel antioxidant peptides obtained by enzymatic and microbial hydrolysis of vegetable proteins[J].Food Chemistry,2017,228:186.
[12]Cavallieri A L F,Da Cunha R L.The effects of acidification rate,pH and ageing time on the acidic cold set gelation of whey proteins[J].Food Hydrocolloids,2008,22(3):439-448.
[13]Machado F F,Coimbra J S R,Rojas E E G,et al.Solubility and density of egg white proteins: effect of pH and saline concentration[J].LWT-Food Science and Technology,2007,40(7):1304-1307.
