便携式鱼肉抗菌药物残留量拉曼检测系统设计研究
2018-01-23滕官宏伟张雷蕾
滕官宏伟,蒋 晗,张雷蕾,朱 诚
(中国计量大学 生命科学学院 浙江省海洋食品品质及危害物控制技术重点实验室,浙江 杭州 310018)
受大规模、高密度、集约化养殖模式的制约,在水产养殖生产过程中乱用滥用抗生素、杀虫剂等渔药,导致养殖水产品中药物残留的现象严重,由此引发的水产品安全问题层出不穷.为了提高水产品食用安全信息的完备性,有效保证水产品食用性、可靠性和安全性,亟需解决抗菌药物等化学污染物残留快速检测、控制及安全性评价的关键问题.常规检测手法如分子印迹技术、免疫分析法、色谱法及质谱法等,存在检测效率低、样品破坏、检测滞后等缺点[1-3].因此,如何实现水产品化学污染物残留的快速无损检测成为当务之急.
作为食品安全检测最具潜力的新方法之一,光谱技术具有快速、实时和无损伤三个技术特征,在水产食品品质安全检测领域发挥出巨大的潜力[4-5].Soroush H等[6]为了检测水中福美双、甲基对硫磷和孔雀石绿,设计了无泵式流动SERS微型检测系统,结果表明三种药物最低检测质量分数为1×10-9、5×10-6、0.1×10-9,对混合的三种杀菌剂也可以较为明显的区分.美国密苏里大学Li等[7]利用树枝状银纳米颗粒为基底,研究了溶液中氯霉素、恩诺沙星、环丙沙星三种抗生素SERS检测限,通过实验,环丙沙星的检测限为20×10-9,并且可以将三种抗生素的混合溶液区别开.光谱检测技术在水产品品质安全检测的应用上非常广泛[8-10].上海海洋大学海洋药物与健康食品研究团队,利用表面增强拉曼光谱技术进行水产品中多残留渔药的检测研究中取得了很好的成果[11-13].马海宽等[16]以银溶胶为表面增强拉曼活性基底,实现了比目鱼肉中磺胺类抗生素的痕量检测,在试验中,根据磺胺甲基嘧啶和磺胺二甲基嘧啶分别在1 102 cm-1和1 134 cm-1处的特征拉曼信号,检测质量分数都为1×10-6.
本文通过自行设计拉曼光学检测系统,选取磺胺二甲基嘧啶、氯霉素、恩诺沙星和氟苯尼考这四种常用抗菌药物为检测对象,检测得到相应的光谱图并对其进行特征峰识别,从而实现这四种抗生素在大黄鱼的残留状况定性判别,并分析此项技术应用于实际的可行性.
1 光学无损检测装置构成及工作原理
本文研制的便携式鱼肉抗菌药物残留拉曼检测系统,包括光源系统、信号采集系统和载物装置三大模块.
1.1 光源系统模块
光源系统是光学检测系统的重要部分,本试验采用基于外腔式体光栅技术500 mW的785 nm激光器(Laser-785, Ocean optics)作为激发光源,该激光器集成了反馈式稳定功率模块和内置半导体制冷,具有窄线宽、强度稳定的激光输出及可抑制待测样品荧光等特性,从而可以保证检测系统的精度和鲁棒性.
1.2 信号采集系统模块
该模块采用了可选择配置狭缝和光栅类型的微型拉曼光纤光谱仪(USB2000-VIS-NIR,Ocean optics).为了实现低照度条件响应,配置狭缝为50 um,探测器:TE制冷背照薄型面阵CCD阵列,所覆盖有效拉曼光谱范围:340~3 000 cm-1.同时为了采集785 nm激发波长下样品的斯托克斯光谱,配置有780 nm长通滤波片.仪器光谱分辨率为5 cm-1,信噪比1000∶1.非浸入式拉曼光纤探头(SPL-RPB-785,Ocean optics),该探头拥有深度激光谱线覆盖,瑞利线光学密度OD=6.所采用Y型光纤(数值孔径0.22)一端与光纤探头连接,另一端与光谱仪的输入端和激光器的输出端连接.
1.3 载物装置模块
高精度样品高度调节载物台由探头夹持器、样品放置平台和电动升降台组成.由于被检样品表面和镜头之间距离的变化会引起光谱强度的差异,并影响整个检测系统的检测精度和准确性,因此通过激光位移传感器(CD22-100-485, Optex Fa CO Ltd, Japan),保持检测距离一致.
整个检测系统置于一个封闭的暗箱内,避免外界光干扰,系统示意图如图1.
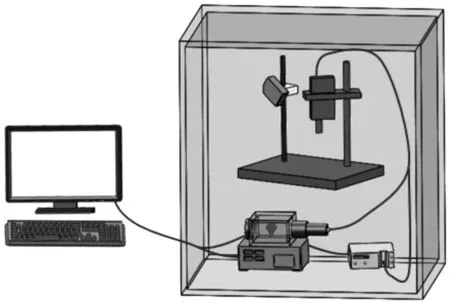
图1 水产品品质安全光学检测系统结构示意图Figure 1 Schematic diagram of the optical detecting system for quality and safety of aquatic products
1.4 工作原理
激光器产生稳定的785 nm激光耦合进Y型光纤的光源端,并传输到检测探头,照射到待测样品表面,所产生的散射光再由拉曼探头获取,通过滤除瑞利散射后进行光栅分光,然后投射到CCD探测器上,经过模数转换后传送至计算机,从而获取到拉曼位移光谱信号.通过光谱数据预处理,结合化学计量学方法提取样品及不同种类化学污染物的光谱特征参数,最终对待测样品残留的化学污染物进行定性识别分析.
1.5 系统软件开发
便携式鱼肉抗菌药物残留拉曼检测系统软件的设计与开发是基于windows操作系统MFC(Microsoft Foundation Classes)基础类库完成的,主要包括光学信号采集、光谱数据保存处理、标准拉曼光谱数据库查询、以及人机交互界面等功能.如图2所示.
检测参数设置模块主要是针对光谱仪的积分时间、平均次数等相关参数进行设置.数据处理模块是通过MATLAB和C++混合编程实现的,可执行光谱数据自动导入、实时显示、保存以及荧光剔除、光谱去噪等预处理等命令.在化学污染物痕量检测时,采集到的图谱通常会存在一部分重叠,以致影响各种类残留物质特征峰的准确识别.因此,光谱数据预处理的关键步骤是识别重叠峰并对其进行基线校准.
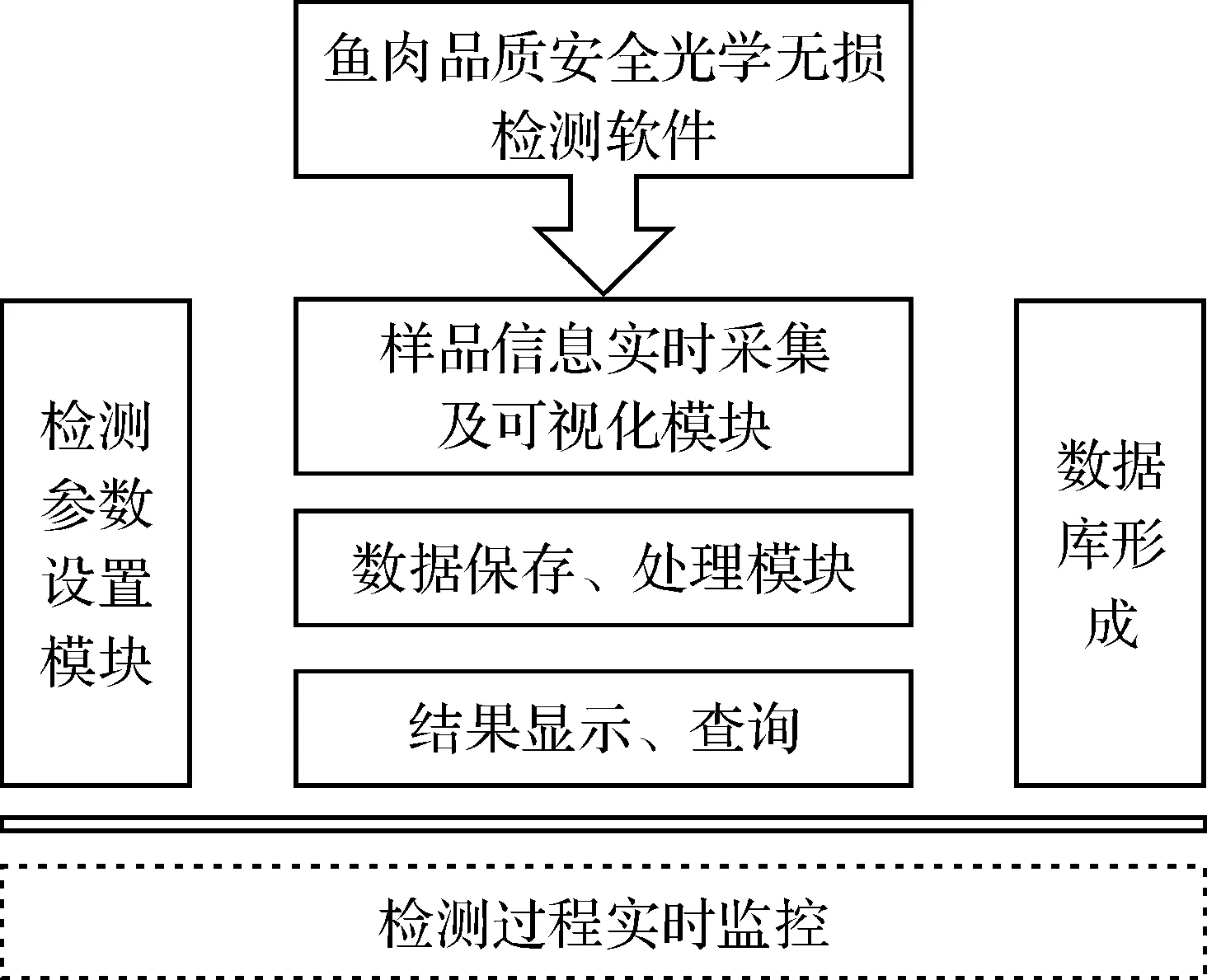
图2 系统软件功能模块Figure 2 Function module of the system software
2 装置试验测试
2.1 试剂及药物标准溶液的制备
以甲醇和乙醇作为溶剂,分别配制质量浓度100 mg/L氯霉素-乙醇标准溶液、磺胺二甲基嘧啶-乙醇标准溶液、恩诺沙星-甲醇标准溶液和氟苯尼考-甲醇标准溶液.将标准贮备液稀释成0.1 μg/mL、0.2 μg/mL、0.25 μg/mL和5 μg/mL 四个梯度,共16个药物样品溶液.
2.2 鱼肉样品准备和预处理
将购买于农贸市场新鲜的大黄鱼为研究对象,采取其鱼肉作为实验样品,鱼去鳞、皮后沿背脊取0.5 cm×0.5 cm×0.5 cm的肌肉块后混匀,然后用保鲜膜裹好放在冰箱中冰冻储存备用.取1 mg制备好的药品溶液分别和1 g鱼肉进行充分混合匀浆处理;将乙腈作为提取及剂添加到混合物中,使渗入鱼肉样本中的药物被重新提取,再进行离心处理取得上清液;用正己烷去除鱼肉中含有一些油脂类物质,从而减少这些物质对光谱检测及分析的干扰;离心去除正己烷后将待测液放在冰箱中保存[16].
2.3 检测条件设置及光学信号获取
采集四种药物固体纯品、不同质量浓度的药物标准溶液及提取液的拉曼特征光谱.取适量的抗菌药物标准品原料固体粉末于载玻片上压平;取适量不同药物不同质量浓度的标准液和提取液于比色皿中;将制备好的样品置于自主设计的便携式鱼肉抗菌药物残留拉曼检测系统中,调节探头与样品表面的距离为2 mm,设置激光器的功率为500 mW,中心波长为785.2 nm,设置光谱仪的平均次数为2次,积分时间为2 000 ms.利用系统软件控制并采集待检样品的光学图谱,再进行光谱平滑、荧光背景扣除等预处理,将光谱数据导入MATLAB2013a中进行进一步处理与分析.
3 结果与讨论
3.1 抗菌药物固体标准品的拉曼光谱检测及分析
分析四种不同种类的抗菌药物固体标准品的拉曼图谱,可以发现各个药物的特征峰比较明显,并对其各个特征峰进行指认归属,结果如图3.
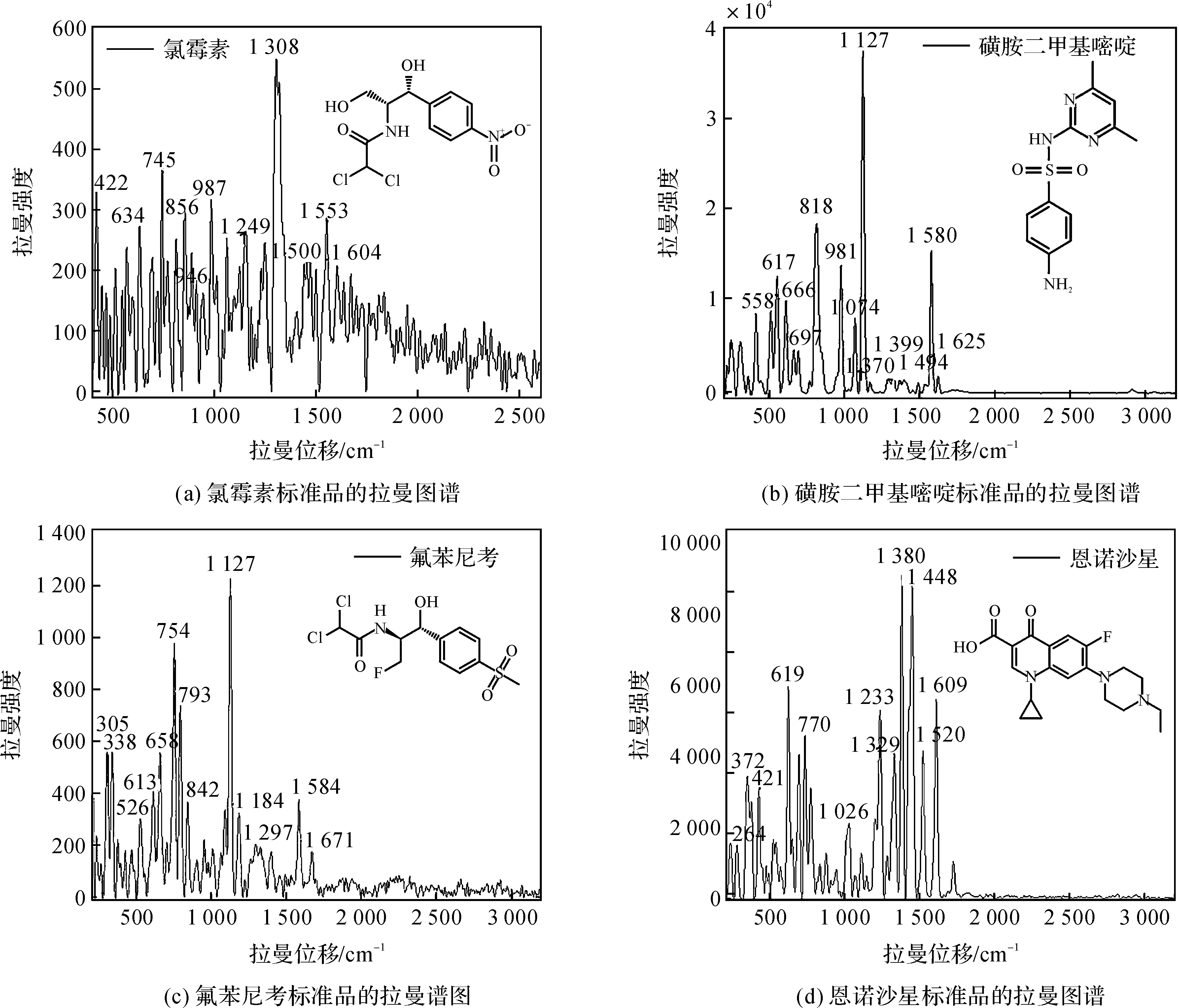
图3 抗菌药物固体标准品的图谱Figure 3 Spectra of pure antibactics
从图3(a)氯霉素标准品的拉曼光谱图分析其特征峰的相关峰归属,可知422 cm-1的特征峰属于C-C伸缩振动,745 cm-1的特征峰属于28C和Cl2的弯曲振动,987 cm-1的特征峰属于苯环上的CH3和苯环上的H伸缩运动.根据图3(b)磺胺二甲基嘧啶标准品的拉曼光谱图,分析其特征峰的相关峰归属可知,558 cm-1的特征峰属于C-S伸缩振动, 818 cm-1的特征峰属于对位二取代苯环呼吸振动,981 cm-1的特征峰属于C-H面内弯曲振动,1 074 cm-1的特征峰属于C-N伸缩振动,1 127 cm-1的特征峰属于SO2对称伸缩振动,1 580 cm-1的特征峰属于对位二取代苯环伸缩振动[17].从图3(c)光谱图中可以看出氟苯尼考标准品在359.277cm-1和203.528 cm-1等处有特征峰,其中 1 140 cm-1附近为 C-SO2-C的强峰.此外,氟苯尼考标准品的拉曼光谱图与氯霉素标准品的拉曼光谱图存在很大差异.这是因为氟苯尼考结构上的苯环对位硝基被甲磺酸基所取代,而氯霉素苯环上是对位硝基,所以二者相差很大.根据图3(d)恩诺沙星标准品的拉曼光谱图,分析其特征峰的相关峰归属可知,421 cm-1的特征峰属于δ(C-H)Q,619cm-1属于υ(C-C)Q,1 233 cm-1属于υ(C-F),1 380cm-1属于υa(O-C-O),1 448 cm-1属于υs(C=O)p,1 609 cm-1属于υas(C=O)p[13-14].四种抗菌药物标准品拉曼特征峰的相关峰归属如表1所示.
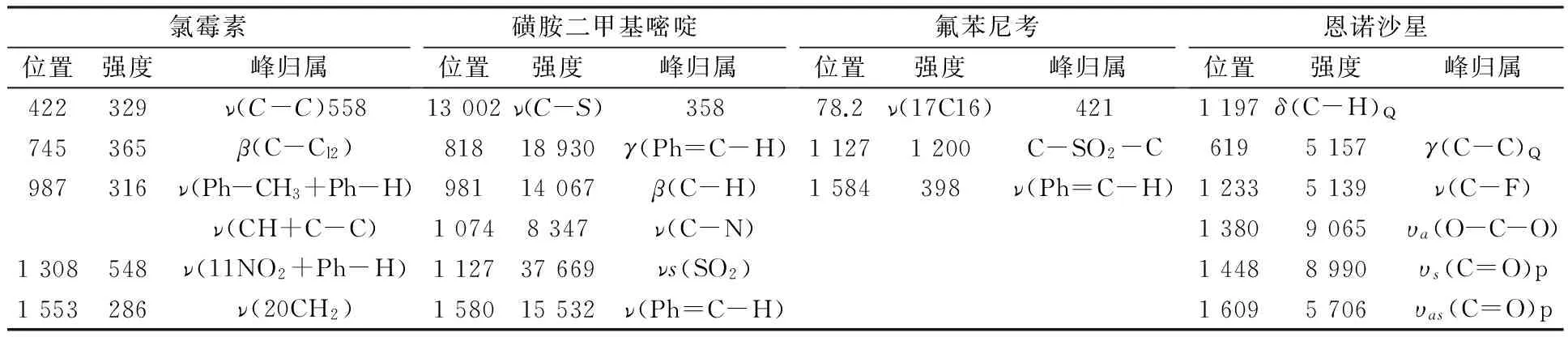
表1 四种抗菌药物标准品拉曼特征峰的相关峰归属
3.2 不同浓度梯度的抗菌药物标准溶液的拉曼图谱分析
对四种不同浓度的氯霉素-乙醇标准溶液、磺胺二甲基嘧啶-乙醇标准溶液、恩诺沙星-甲醇标准溶液和氟苯尼考-甲醇标准溶液溶液的拉曼光谱图进行比较分析,以恩诺沙星-甲醇标准溶液为例,如图4,从图中的特征峰可以发现不同浓度质量梯度的药物溶液的拉曼图谱中溶剂的峰较为明显,且不同的浓度梯度都存在着几个相同的拉曼峰位置,根据这几个特征峰也可以推断出它含有那类物质.

图4 不同浓度的恩诺沙星-甲醇标准溶液的拉曼图Figure 4 Raman spectra of standard solutions of enrofloxacin in methanol
3.3 鱼肉中药物残留的探测及危害识别
将具有高检测灵敏度的光谱检测技术与主成分分析(PCA)统计分析技术相结合,对鱼肉中不同药物残留提取液进行定性分析.利用matlab中[pc,score,variance,t] = princomp(x)函数对原始光谱进行降维,得到特征向量,在进行主成分PCA分析后,提高特征向量的维数,能够使提取的特征向量含有更多有利于分类鱼肉样本中残留药物的信息.图为PCA散点分布图,PC1、PC2、PC3分别作X、Y、Z轴.如图5所示,代表不同药物的数据点基本可以聚集到一起,但不能够完全区分开来.分析其原因,是在鱼肉样本中提取残留药物时,采用乙腈作为提取剂,在一定程度上具有较为强烈的拉曼特征峰,对四种不同种类抗菌药物自身的光谱峰有所掩盖.
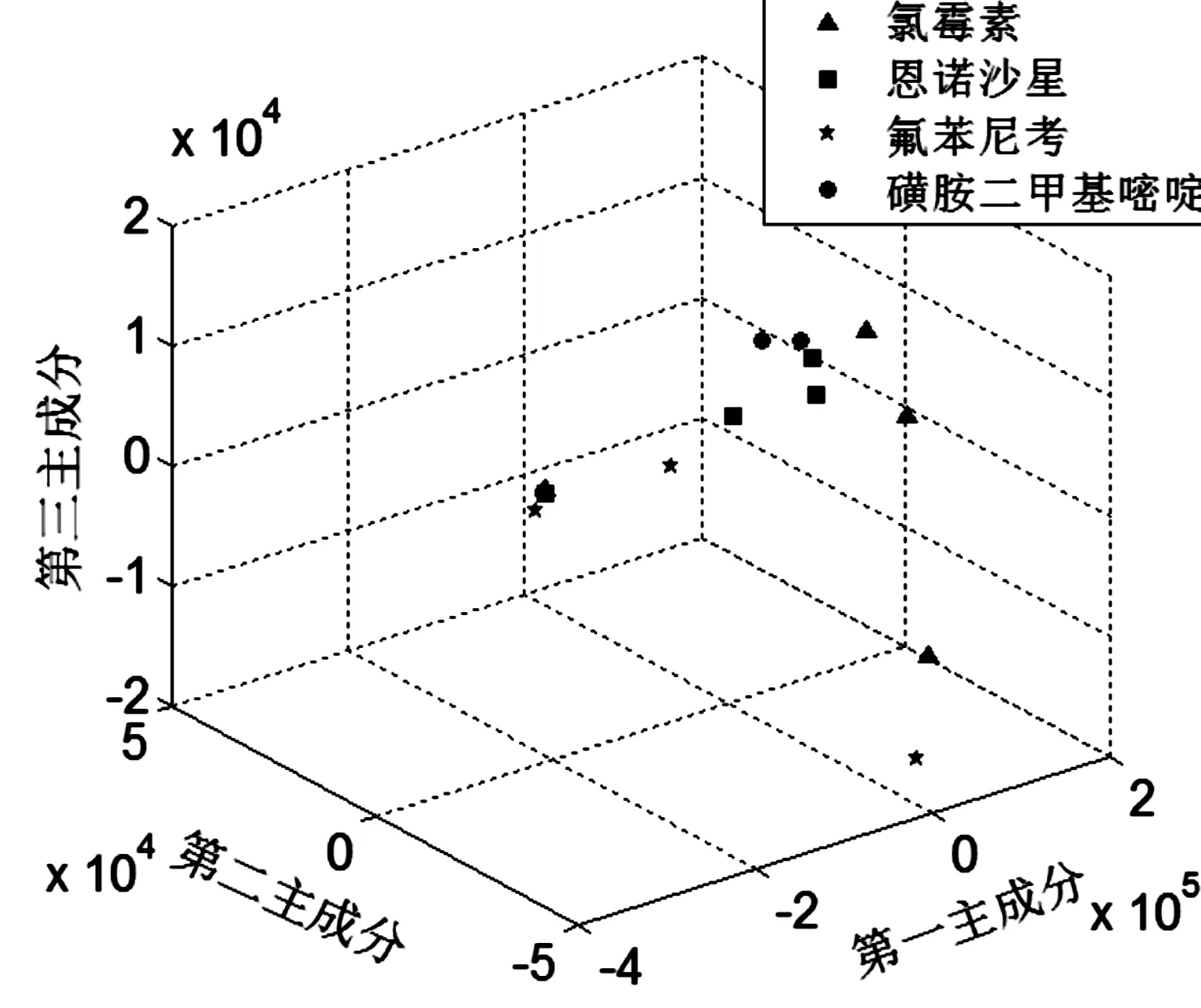
图5 鱼肉残留药物提取液拉曼光谱的主成分分析Figure 5 The Raman spectrum of principal component analysis of fish residual drug extraction
4 结 语
通过自行构建的便携式鱼肉抗菌药物残留拉曼检测系统,获取鱼肉中残留药物的光学信号,甄别出磺胺二甲基嘧啶、氯霉素、恩诺沙星和氟苯尼考等四种抗生素对应的特征峰,并对各个拉曼特征峰进行指认归属分析,实验得到的拉曼图谱以及对其特征峰的归属信息可以作为不同种类抗菌药物的定性鉴别依据.但也存在一些问题亟待进一步改进:1)尝试结合表面增强拉曼光谱技术,使鱼肉复杂样品中抗菌药物的最低检测浓度得以突破;2)进一步改进荧光背景消除方法,有效消除不同样品的组间数据波动;3)提高检测精度和准确度,消除探头到样本的距离对光谱数据采集的影响.
通过对不同抗菌药物在鱼肉残留中的拉曼光学检测的初探,为进一步研发功能完备、检测精度高、检测速度快、可移植性好的小型便携的水产品污染物检测仪器,实现渔业全产业链的药物有害物质残留控制和品质安全检测提供了研究基础.
[1] 张毅, 岳振峰, 郭文,等. 动物源性食品中药物多残留分析的研究进展[J]. 食品科学, 2016, 37(1): 213-221.
ZHANG Y, YUE Z F, GUO W, et al. Progress in multiresidue analysis of veterinary drugs in foods of animal origin [J].FoodScience, 2016, 37(1): 213-221.
[2] HE L, CHEN T, LABUZA T P. Recovery and quantitative detection of thiabendazole on apples using a surface swab capture method followed by surface-enhancement Raman spectroscopy [J].FoodChemistry, 2014, 148(3): 42-46.
[3] LI Q Q, DU Y P, XU Y, et al. Rapid and sensitive detection of pesticides by surface-enhanced Raman spectroscopy technique based on glycidyl methacrylate-ethylene dimethacrylate (GMA-EDMA) porous material [J].ChineseChemicalLetters, 2013, 24(4): 332-334.
[4] ZHANG X F, ZOU M Q, QI X H, et al. Detection of melamine in liquid milk using surface-enhanced Raman scattering spectroscopy [J].JournalofRamanSpectroscopy, 2010, 41(12): 1655-1660.
[5] XU Y, DU Y, LI Q, et al. Ultrasensitive detection of enrofloxacin in chicken muscles by surface-Enhanced raman spectroscopy using amino-modified glycidyl methacrylate-ethylene dimethacrylate (GMA-EDMA) powdered porous material [J].FoodAnalyticalMethods, 2014, 7(6): 1219-1228.
[6] YAZDI S H, WHITE L M. Mutiplexed detection of aquaculture fungicides using a pump-free optofluidic SERS microsystem [J].Analyst, 2013, 138(1): 100-103.
[7] HE L L, LIN M, LI H, et al. Surface-enhanced Raman spectroscopy coupled with dendritic silver nanosubstrate for detection of restricted antibiotics [J].JournalofRamanSpectroscopy, 2010, 41(7): 739-744.
[8] LAI KQ, ZHAI F L, ZHANG Y Y, et al. Application of surface enhanced Raman spectroscopy for analyses of restricted sulfa drugs [J].SensingandInstrumentationforFoodQualityandSafety, 2011, 5: 91-96.
[9] LIU B, LIN M, LI H. Potential of SERS for rapid detection of melamine and cyanuric acid extracted from milk [J].SensingandInstrumentationforFoodQualityandSafety, 2010, 4(1):13-19.
[10] CHENG Y, DONG Y. Screening melamine contaminant in eggs with portable surface-enhanced Raman Spectroscopy based on gold nanosubstrate [J].FoodControl, 2011, 22(5):685-689.
[11] 李春颖, 赖克强, 张源圆, 等. 表面增强拉曼光谱检测鱼肉中禁用和限用药物研究[J]. 化学学报, 2013, 71(2): 221-226.
LI C Y, LAI K Q, ZHANG Y Y, et al. Use of Surface-enhanced Raman spectroscopy for the test of residuals of prohibited and restricted drugs in fish muscle [J].ActaChimicaSinica, 2013, 7(2): 221-226.
[12] ZHANG Y Y, HUANG Y Q, ZHAI F L, et al. Analyses of enrofloxacin, furazolidone and malachite green in fish products with surface-enhanced Raman spectroscopy [J].FoodChemistry, 2012, 135(2): 845-850.
[13] ZHANG Y Y, LAI K Q, ZHOU J L, et al. A novel approach to determine leucomalachite green and malachite green in fish fillets with surface-enhanced Raman spectroscopy (SERS) and multivariate analyses [J].JournalofRamanSpectroscopy, 2012, 43(9): 1208-1213.
[14] ZHANG Y Y, YU W S, PEI L, et al. Rapid analysis of malachite green and leucomalachite green in fish muscles with surface-enhanced resonance Raman scattering [J].FoodChemistry, 2015, 169:80-84.
[15] LAI K Q, ZHANG Y Y, DU R, et al. Determination of chloramphenicol and crystal violet with surface enhanced Raman spectroscopy [J].SensingandInstrumentationforFoodQualityandSafety, 2011, 5(1): 19-24.
[16] 马海宽, 韩晓红, 张财华,等. 鱼肉中磺胺类抗生素的表面增强拉曼光谱探测与分析[J]. 激光生物学报, 2014, 23(6): 560-565.
MA H K, HAN X H, ZHANG C H, et al. The study of sulfonamide antibiotics in fish based on surface-enhanced Raman spectroscopy technology [J].ActaLaserBiologySinica, 2014, 23(6): 560-565.
[17] 樊玉霞, 赖克强, 黄轶群. 表面增强拉曼光谱技术在食品中痕量化学危害检测中的应用[J]. 光谱学与光谱分析, 2014, 34(7):1859-1864.
FAN Y X, LAI K Q, HUANG Y Q. Application of surface-enhanced Raman spectroscopy to the determination of trace chemical hazards in food products [J].SpectroscopyandSpectralAnalysis, 2014, 34(7): 1859-1864.
