豆薯花粉活力研究
2018-01-23陈忠文王德英文西强王宏飞潘晶晶
陈忠文,周 黎,王德英,黄 超,文西强,王宏飞,潘晶晶
(1余庆县种子管理站,贵州 余庆 564499;2黔东南民族职业技术学院,贵州 凯里 556000;3余庆中学,贵州 余庆 564499;4余庆县农牧局,贵州 余庆 564499)
豆薯(Pachyrhizus erosus)原产南美洲,传入我国约 400余年历史,是一种食药兼用作物[1,2]。国内研究起步较晚,侧重于豆薯种子繁殖、肉质根栽培及加工等[3~6],育种工作相对滞后。陈忠文等选育出“余庆地瓜1号”豆薯新品种[7],并报道了杂交方法[8]。关于豆薯花粉活力测定,则未见相关报道。笔者在之前关于豆薯开花习性研究的基础上[9,10],采用几种常用测定方法比较豆薯花粉活力,以为豆薯杂交育种及种子生产安全隔离提供参考。
1 材料与方法
1.1 材料
余庆地瓜1号、余庆地瓜2号和牧马山地瓜等3个豆薯品种(品系)的花粉,分别于2015年、2016年7月上、中旬采自于贵州省余庆县白泥镇豆薯种子生产基地。
仪器:显微镜(10×40~100倍);载玻片;盖玻片;镊子;恒温箱;硫酸纸;棕色试剂瓶;烧杯;量筒;天平;pH酸度计或试纸等。
试剂:0.5%的2,3,5-氯化三苯基四氮唑溶液(TTC)粉剂,购于上海华蓝化学科技有限公司;单质I2、KI;硼酸 1 g;蔗糖 50 g;95%酒精。
1.2 花粉采集
1.3 花粉活力测定
(1)TTC法
①试剂配制。称取0.5 g TTC放入烧杯中,加入少许95%酒精使其溶解,然后用蒸馏水稀释至100 mL。溶液装入褐色玻璃瓶避光保存待用,若发红,则不能再用[11]。
②染色。取少量花粉置于普通载玻片上,滴入TTC溶液2滴,用镊子搅拌均匀,盖上盖玻片,在室温(25~28℃)下放置15~20 min。
③显微镜观察。具较强生活力的花粉粒呈红色,微弱活力的花粉粒呈淡红色,无活力或不育的花粉为无色。取少许花粉置于载玻片上,加1~2滴TTC溶液,盖上盖玻片。观察3个制片,每片取5个视野,统计并计算花粉活力百分率(花粉萌发率=萌发花粉粒数/视野花粉粒数×100%)。
(2)I2-KI法
①I2-KI的配制。称取2 g KI溶于10 mL蒸馏水中,然后加入1 g I2,待全部溶解后,加蒸馏水定容至300 mL,制成0.1%I2-KI溶液。
②染色。取少量花粉置于载玻片上,滴上1~2滴I2-KI染色液,5 min后在显微镜下观察。
数据的标定用来获得传感器的静态特性,其标定的精度将直接影响传感器使用时的测量精度,其重要程度显而易见。
③显微镜观察。凡是染成蓝黑色的花粉粒具较强活力,淡蓝色次之,几乎无色则为无活力花粉。观察3个制片,每片取3个视野,统计并计算花粉活力百分率。
(3)花粉离体萌发测定法
①液体培养基的配制。硼酸设10、50、100 mg/L等3个水平,蔗糖浓度设5%、10%、20%等3个梯度,并测定对应的pH值(表1)。
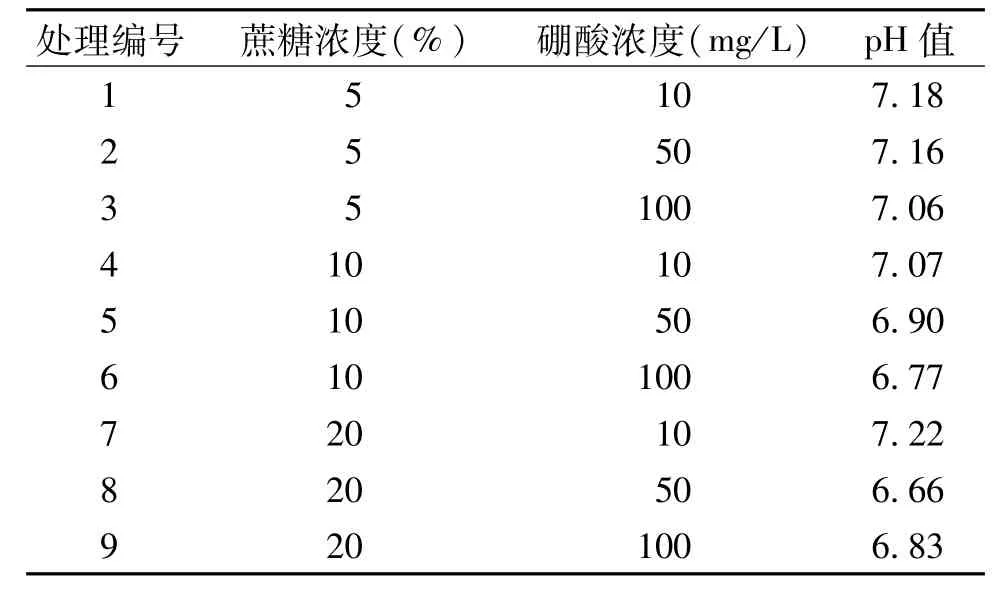
表1 花粉离体萌发测定法的蔗糖、硼酸浓度及pH值
②培养基筛选。采用L9(34)正交试验设计。
③花粉萌发观察。用镊子夹住花萼部,用手轻拍花朵,使花粉均匀散落于载玻片上,取2~3滴培养基溶液滴于花粉上,盖上盖玻片,编号,置于底部铺有用水浸湿的滤纸的培养皿上,于30℃光照培养箱中培养30 min、1、2、3、4、5、6、7、8 h,在光学显微镜下观察花粉萌发率。以花粉管的长度大于和等于花粉的直径计为萌发花粉粒,每次观察3张片,每片取3个视野,记录平均值,统计花粉萌发率。
2 结果与分析
2.1 不同测定方法豆薯花粉活力比较
3种花粉活力测定方法结果表明:⑴不同的测定方法结果差异较大,I2-KI染色测定花粉活力达到92%以上,其次为TTC染色法达45%以上,并有相近的测定结果,离体测定较低,在36%以下并相差较大(表2)。
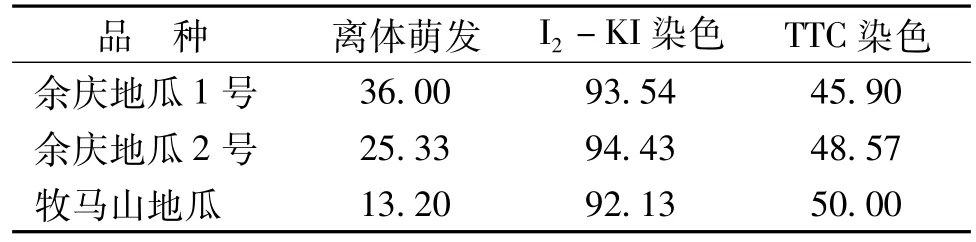
表2 3种方法测定豆薯花粉活力(%)结果
⑵不同豆薯品种对于相同的测定方法亦存在差异。离体萌发测定显示‘余庆地瓜1号’花粉萌发率达36.00%,明显高于‘余庆地瓜2号’和‘牧马山地瓜’两个品种,与品种的荚粒数9~12、8~10、6~8粒相对应,而TTC染色效果则刚好相反。
本试验TTC法染色效果不明显。
2.2 I2-K I染色及不同浓度效果比较
在实验时发现1%I2-KI染色时间快、染色深,必须即时观察,有碍批量处理,故而进行不同浓度染色比较,结果以0.5%为宜(表3)。

表3 I2-KI染色效果比较
2.3 培养条件对豆薯花粉离体萌发率的影响
因处理1~5豆薯花粉基本无萌发,不能统计分析。
2.3.1 豆薯花粉离体萌发时间
因品种而异,不同的豆薯品种花粉在1~2 h后开始萌发,6~7 h达到最高值(表4)。因此,在豆薯花粉离体6~7 h进行离体测定无疑是最合适的。
2.3.2 蔗糖、硼酸浓度对豆薯花粉离体萌发的影响
在蔗糖浓度≤10%、硼酸浓度为5、50 mg/L时,3个豆薯品种花粉基本无萌发。蔗糖浓度10%、硼酸浓度100 mg/L时,‘余庆地瓜1号’无萌发,‘牧马山地瓜’和‘余庆地瓜2号’分别在1和2 h开始萌发。蔗糖浓度20%、硼酸浓度50 mg/L时,仅‘余庆地瓜1号’花粉能萌发;硼酸浓度100 mg/L‘牧马山地瓜’无萌发,其余品种萌发。蔗糖浓度20%、硼酸浓度10 mg/L时,pH值7.22,3个品种皆能萌发,是本试验花粉离体萌发测定最佳处理。

表4 不同品种在蔗糖和硼酸浓度组合下的萌发结果(%)
2.4 豆薯花粉粒数量
在10×40倍镜下观测,单个豆薯花药花粉760~860粒,推算每朵花的花粉量7600~8600粒。而豆薯荚粒数一般在12粒以下,表明豆薯自花授粉率在0.15%以下,非常低。
3 讨论
(1)花粉活力的测定方法很多。本试验关于豆薯花粉活力测定仅采用TTC法、I2-KI法和离体培养方法。染色效果最为明显的是I2-KI法,可能是因为豆薯花粉中的淀粉含量很高,I2-KI较易渗透进花粉壁而使花粉粒染色[12]。I2-KI染色法的基本原理是根据淀粉遇碘变蓝的特性,根据蓝色的深浅程度来判断花粉粒中淀粉的含量,从而确定花粉粒活性的高低。凡是染成蓝黑色的花粉粒具较强活力,淡蓝色次之,几乎无色则为无活力花粉[13]。本试验豆薯花粉遇1%I2-KI能快速染成蓝黑色,表明其花粉活力非常强,用0.5%I2-KI溶液处理能达到同样效果且便于操作和延时观察。
(2)本试验豆薯花粉离体培养萌发测定结果与豆薯品种的结荚粒数相对应,似乎更能反映其实际结果。
(3)本试验中TTC法测定染色效果不明显,是否与TTC粉剂未经过磷酸盐缓冲溶液而直接用95%酒精配制有关,有待进一步验证。
[1] 王清惠 .凉薯的功效与作用[DB/OL].http://zyk.99.com.cn/zyfj/zysy/2013/0123/350740.html[2013-01-23].
[2] 陈忠文,周介雄,文西强.贵州地瓜产业发展分析与评价[J].种子,2008,27(12):140-142.
[3] 陈忠文,文西强.余庆地瓜1号种子高产技术[J].长江蔬菜,2007(12):28.
[4] 毕光美,李光武,李 梅,等.豆薯引种及高产栽培技术研究初报[J].北方园艺,2011(13):39-40.
[5] 张连平.豆薯高产栽培技术[J].蔬菜,2011(7):15-16.
[6] 郑兵福,李彦坡,蒋立文.凉薯加工产品的发展现状[J].农产食品科技,2010,4(2):52-54.
[7] 陈忠文,冯仕喜,郭仕平,等.余庆地瓜1号的选育与利用[J].种子,2007,26(6):80-81.
[8] 陈忠文,李雪维.豆薯杂交技术探讨[J].中国园艺文摘,2015,31(6):27,29.
[9] 陈忠文,曾祥忠,冯仕喜.豆薯开花习性观察研究[J].现代农业科技,2013(21):80-82.
[10]陈忠文,文西强,王宏飞,等.豆薯种子与花冠颜色及花器结构描述[J].作物研究,2014,28(2):152-153.
[11] 氯化三苯基四氮唑法[DB/OL].https://baike.baidu.com/item/%E6%B0%AF%E5%8C%96%E4%B8%89%E8%8B%AF%E5%9F%BA%E5%9B%9B%E6%B0%AE%E5%94%91%E6%B3%95/9885951 fr=aladdin.
[12]韩成刚,盖树鹏.芍药花粉活力测定方法的研究[J].江苏农业科学,2012,40(5):124-126.
[13]左丹丹,明 军,刘 春,等.植物花粉生活力检测技术进展[J].安徽农业科学,2007,35(16):4742-4745.
