中国传统豆制品中异黄酮的超高效液相色谱-紫外检测器快速定量法
2018-01-22,,,,*
,,, ,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.江南大学食品安全国际合作联合实验室,江苏无锡 214122;3.玛氏食品(中国)有限公司,北京 101407)
大豆异黄酮是大豆生长过程中形成的次级代谢产物,具有调节体内激素水平、蛋白质合成、生长因子活性、代谢生物学活性等生理功能[1-3]。亚洲,尤其是中国,大豆制品是人民日常膳食的重要组成。中国是大豆的故乡,我国人民利用大豆研制了种类丰富的豆制品,如素鸡、豆腐、豆浆、百叶等,其中大部分豆制品为中国独有的特色食品。随着健康意识的提升,2010-2012年间调查显示,我国每人每天居民豆类及豆制品的摄入量约为10.9 g,但远没有达到我国平衡膳食宝塔建议(30~50 g),这说明豆制品未来在我国市场仍具有巨大的发展潜力[4]。因此,对我国传统豆制品中大豆异黄酮的定性定量方法学研究,对豆制品工业生产工艺的提高、产品的质量控制及营养评估均有重要意义。
自然界中的大豆异黄酮主要以游离型的苷元和结合型的糖苷两种形式存在,主要包括三种苷元(大豆苷、大豆苷元、染料木素),苷元的三种7-O-葡萄糖苷,三种6″-O-丙二酰葡萄糖苷和三种6″-O-乙酰基葡萄糖苷,共12种结构[5]。已报道的异黄酮定量分析包括紫外分光光度法、三波长法、高效液相法(HPLC)、超高效液相色谱法(UHPLC)、液相色谱质谱法(LC MS)等[6-9]。其中,LC-MS除定量外,还可对未知异黄酮成分进行结构推测,但由于价格昂贵,不为实验室广泛配备[10-13]。HPLC具有准确、快速、灵敏度高等优势,已被各单位广泛配置[6,8,14],因此,目前以HPLC法为主对进行异黄酮定量,分析时间一般为20~40 min之间[6,8,14]。在基于HPLC的分析中,由于丙二酰化、乙酰化的葡萄糖苷大豆异黄酮极性相近,需要通过长时间的梯度洗脱来实现分离[6,8,14]。UPLC是在传统HPLC的制造技术、扩散条件和耐受压力进行了优化,耐压达到15000 psi上,匹配小于2 μm颗粒度色谱柱,柱外扩散体积小于15 μL,从而使分析速度、分离效率、分析灵敏度显著提高[15-16]。然而,在实际应用中,由于丙二酰化和乙酰化的葡萄糖苷大豆异黄酮标准样品价格昂贵且不稳定,在实际生产质控中难以实现对6种丙二酰和乙酰化的大豆异黄酮进行标准品直接定量。同时,豆制品加工过程,尤其是热处理过程会促使丙二酰基和乙酰基修饰的葡萄糖苷的降解,也可能导致对葡萄糖配基的进一步修饰,从而使豆制品中大豆异黄酮的组成更为复杂[13,17-18]。这意味着即使对12种大豆异黄酮同时进行标准样品定量也仍有一部分未知异黄酮修饰物含量无法评估。为了更为准确的评估豆制品中大豆异黄酮的含量,利用酸性条件将大豆异黄酮衍生物上葡萄糖配基上的修饰基团去除,使丙二酰化、乙酰化及其他葡萄糖配基修饰的衍生物均转化为对应的葡萄糖苷,从而将豆制品中可能存在的12种以上异黄酮物质降低为6种标准品易得价格相对低廉的三种葡萄糖苷和三种苷元。
本文以中国传统豆制品豆干、素鸡、素百叶、腐竹、内酯豆腐、嫩豆腐和老豆腐为研究对象,利用酸化提取,建立基于超高效液相色谱-紫外检测器(UPLC-UV)中的大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素、染料木素快速检测方法。
1 材料与方法
1.1材料与仪器
大豆苷(daidzin,DAI-G,纯度≥98%)、黄豆黄苷(glycitin,纯度≥98%)、染料木苷(genistin,纯度≥98%)、大豆苷元(daidzein,纯度≥98%)、黄豆黄素(glycitein,纯度≥98%)、染料木素(genistein,纯度≥98%) 上海士锋生物科技有限公司;色谱纯甲醇 美国天地试剂公司;盐酸 国药集团化学股份有限公司;超纯水(18.2 MΩ);豆干、素鸡、素百叶、腐竹、内酯豆腐、嫩豆腐和老豆腐 购于本地华润万家超市;乙腈、甲醇、甲酸 色谱纯(TEDIA,USA);实验用水 Milli-Q超纯水;标准储备液 准确称取各上述标准品加至50 mL容量瓶中,均用乙腈溶解并稀释至标线,配制成100 mg/L的标准储备溶液,4 ℃冷藏保存。
Acquity UPLC超高效液相色谱仪 美国沃特世公司;Acquity UPLC二极管阵列紫外检测器 美国沃特世公司;Masslynx 4.1工作站 美国沃特世公司;Kinetex-C18超高效液相色谱柱(2.1 mm×100 mm,1.7 μm) 美国沃特世公司;SB-3200D超声清洗剂 宁波新芝生物公司。
1.2实验方法
1.2.1 色谱条件 流动相为乙腈和0.1%甲酸。流动梯度洗脱程序:0~0.5 min,10%乙腈;0.5~10 min,10%~45%乙腈;10~12 min,45%~100%乙腈,流速:0.3 mL/min,柱温:45 ℃,紫外检测波长260 nm;进样量1 μL。
1.2.2 标准曲线制作 大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素、染料木素标准储备溶液分别逐级稀释,配成浓度分别为0.05、0.1、0.3、0.5、1、5、10、25、50、75、100 mg/L的混合标准溶液,在1.2.1分析条件下检测各组分含量。
1.2.3 大豆异黄酮提取 酸化提取方法根据José L. Pealvo等[8]建立的方法,并稍加改进。利用天平准确称取0.10 g固体样品,溶于10 mL酸化的80%甲醇水提取液(1 mol·L-1HCl),均质5 min,超声提取5 min,80 ℃下水浴加热1 h。取上清100 μL,甲醇稀释10倍后,10000 r/min离心3 min,过0.22 μm滤膜后待测。
2 结果与分析
2.1色谱条件的优化
本实验中,采用梯度洗脱,有利于提高分离效率,同时有效缩短分析时间。如图1所示,本实验中采用乙腈和0.1%甲酸(V/V)在8 min内实现6种大豆异黄酮的基线分离。洗脱峰依次为:大豆苷(3.25 min),黄豆黄苷(3.42 min),染料木苷(4.29 min),大豆黄素(6.03 min),黄豆黄素(6.37 min),染料木素(7.70 min)。在豆制品中,含有极性较强且在260 nm检测波长下具有紫外吸收的嘌呤碱类化合物[15-17],因此在梯度洗脱起始阶段设计了0.5 min的10%乙腈等梯度洗脱阶段,使该类化合物在被测物前从色谱柱中洗脱,从而保证检测结果的准确性,优化色谱峰峰型,避免由于失流出等对大豆异黄酮定量结果产生干扰。

图1 6种大豆异黄酮标准样品的色谱图.Fig.1 The UPLC chromatogram of six standards of Isoflaovnes
2.2线性范围、检出限及精密度
利用梯度浓度标准品混合液进样,以1.2.1中色谱条件检测,以大豆苷、黄豆黄苷、染料木苷、大豆苷元、黄豆黄素和染料木素6种标准样品的质量浓度为横坐标,260 nm检测波长下测得的色谱峰积分峰面积为纵坐标,建立了6种大豆异黄酮的标准曲线方程。大豆苷、黄豆黄苷、染料木苷的线性范围确定为0.3~100 mg/L,大豆苷元和黄豆黄素的线性范围确定为0.15~50 mg/L,染料木素的线性范围确定为0.15~250 mg/L。同时通过稀释法,以信噪比等于3为检出限,确定了6种大豆异黄酮的检出限。其中,大豆苷、黄豆黄苷、染料木苷、染料木素的检出限为0.1 mg/L,黄豆黄素的检出限为0.08 mg/L,大豆苷元的检出限为0.05 g/L。
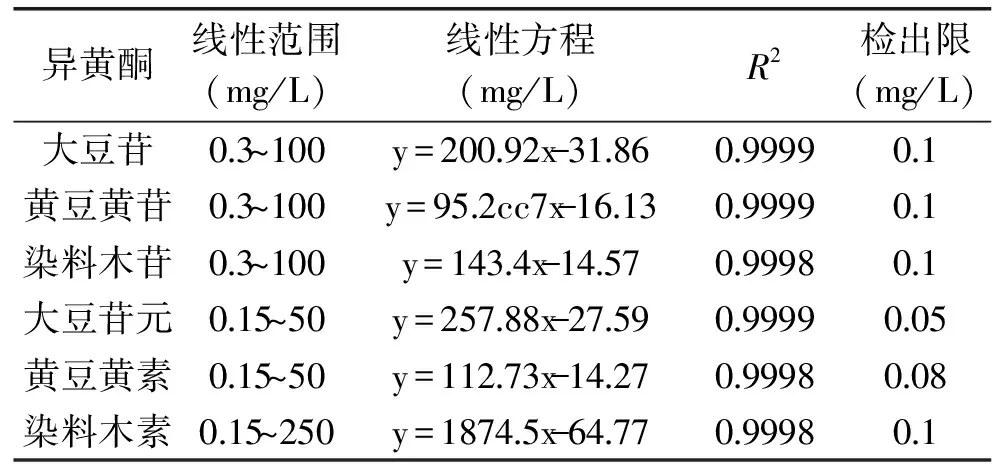
表1 线性方程、线性范围、相关系数及检出限Table 1 Linear equations,correlation coefficients and limits of detection
2.3样品处理与回收率
本实验采取一步提取法对豆制品中大豆异黄酮进行提取。将提取液中甲醇比例控制在80%,目的为沉淀蛋白,同时防止脂类等非极性杂质的共溶出[18]。加入1 mol·L-1HCl,使样品中大豆异黄酮修饰物水解,葡萄糖苷配基上的丙二酰和乙酰基等衍生基团解离,生成对应的大豆苷、黄豆黄苷、染料木苷等三种糖苷型大豆异黄酮[8],使最终的检测对象为3种葡萄糖苷和3种异黄酮苷元。为考察方法准确性,以豆腐为对象,设计了3个质量浓度水平的添加收回实验(n=3)。结果见表2,三个添加水平(0.5, 5, 20 mg/kg)的大豆苷、染料木苷、黄豆黄苷回收率在96.5%~99.8%之间,三个添加水平(0.1, 1, 5 mg/kg)的大豆苷元、黄豆黄素、染料木素回收率在96.7%~102.3%之间,达到分析测试要求。
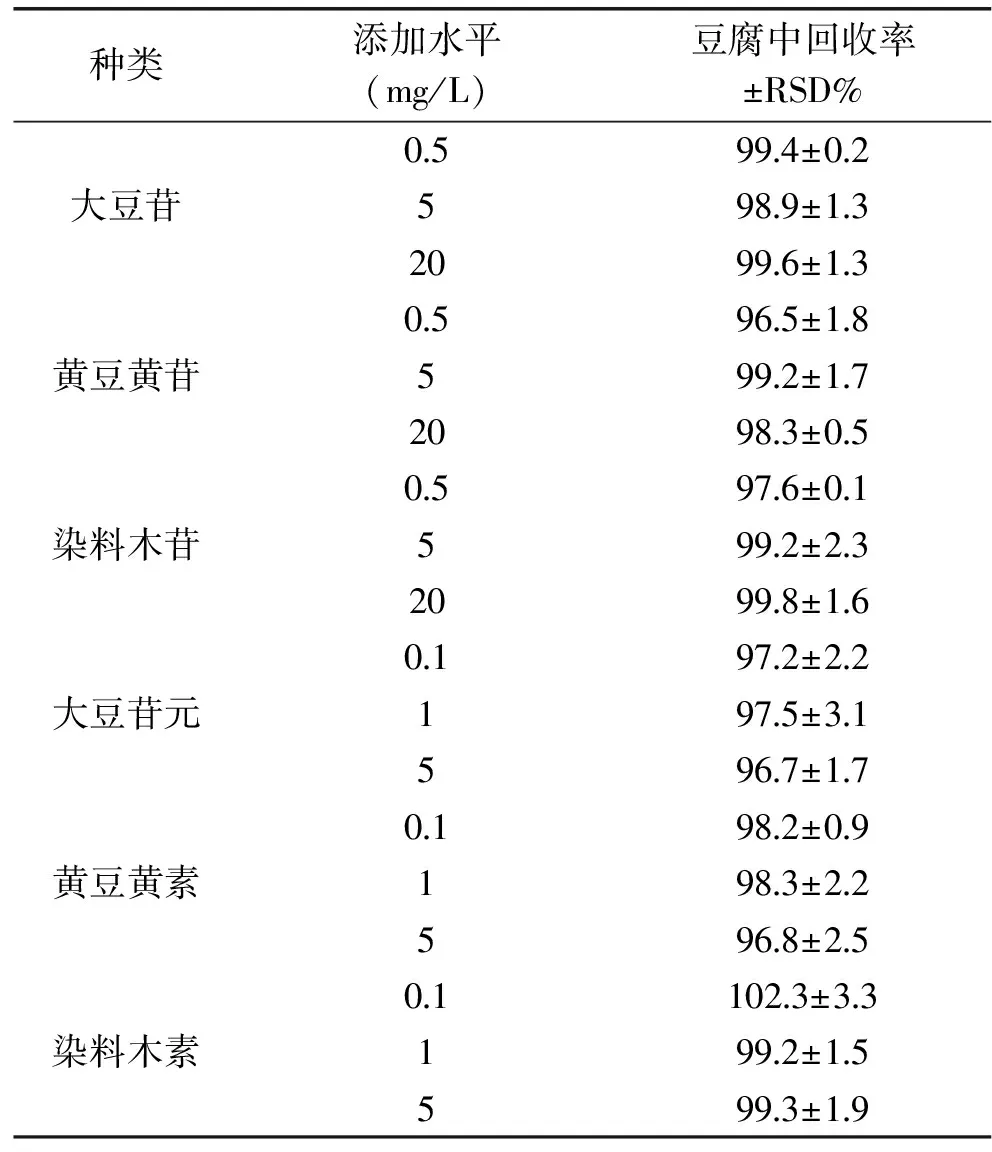
表2 豆腐中6种大豆异黄酮的添加回收率Table 2 Recovery rates of six isoflavones in Soymilk and Tofu
2.4豆制品中6种大豆异黄酮的测定
在市场中购买了我国消费者日常生活中最常购买的7种大豆制品,具体为腐竹、豆干、素百叶、素鸡、嫩豆腐、老豆腐和内酯豆腐,按1.2方法进行样品前处理和色谱检测。7种豆制品样品出峰如图2所示,可知本方法可以对6种大豆异黄酮组分实现有效分离,同时可保证6种被测物与其他色谱峰实现基线分离,从而避免对定量结果造成干扰。利用表1中标准曲线方程计算6种大豆异黄酮含量,结果见表3。7种豆制品中总大豆异黄酮的含量分别为,内酯豆腐9.76 g/kg,硬豆腐13.8 g/kg,软豆腐8.67 g/kg,素百叶14.22 g/kg,豆干16.14 g/kg,素鸡16.48 g/kg,腐竹25.83 g/kg。7种豆制品随机购于市场中,但6种大豆异黄酮中均以大豆苷和染料木苷为主要成分,二者含量在总大豆异黄酮含量占比为88.0%~93.4%,这与大豆原料本身的异黄酮组成一致[13,18]。结果表明,本研究建立的UPLC法可有效降低杂质干扰,色谱基线稳定且峰型良好,在10 min内实现对6种大豆异黄酮的快速定量检测,可良好应用于常见市售豆制品的营养评估与质量控制。

表3 豆制品中6种大豆异黄酮的检测(n=3)Table 3 The analysis of six isoflavones in soybean products

图2 260 nm下的不同豆制品中大豆异黄酮的UPLC色谱图Fig.2 The UPLC chromatograms of isoflavones in different soy foods at 260 nm
3 结论
本方法在酸性条件下,将豆制品中主要的大豆异黄酮修饰物水解,使其葡萄糖苷配基上的丙二酰和乙酰基等衍生基团解离,生成对应的糖苷型大豆异黄酮,从而将豆制品中可能存在的12种以上异黄酮物质降低为6种标准品易得价格相对低廉的三种葡萄糖苷和三种苷元。色谱分析采用乙腈和0.1%甲酸(V/V)梯度洗脱,在8 min内实现6种大豆异黄酮的基线分离,并在梯度洗脱起始阶段设计了0.5 min的10%乙腈等度洗脱以排除嘌呤碱类化合物对检测的干扰。建立了6种大豆异黄酮的标准曲线方程,其中大豆苷、黄豆黄苷、染料木苷的线性范围为0.3~100 mg/L,大豆苷元和黄豆黄素的线性范围为0.15~50 mg/L,染料木素的线性范围为0.15~250 mg/L。三个添加水平(0.5,5,20 mg/kg)的大豆苷、染料木苷、黄豆黄苷回收率在96.5%~99.8%之间,三个添加水平(0.1,1,5 mg/kg)的大豆苷元、黄豆黄素、染料木素回收率在96.7%~102.3%之间,达到分析测试要求。利用本方法对腐竹、豆干、素百叶、素鸡、嫩豆腐、老豆腐和内酯豆腐等7种我国传统豆制品中的大豆异黄酮进行了定性定量分析,总大豆异黄酮含量在8.67~25.83 g/kg间。不同豆制品间均以6种大豆异黄酮中大豆苷和染料木苷为主要成分,占88.0%~93.4%。结果表明,本研究建立的UPLC法可有效降低杂质干扰,色谱基线稳定且峰型良好,在10 min内实现对6种大豆异黄酮的快速定量检测,可良好应用于常见市售豆制品的营养评估与质量控制。
[1]姜雪,迟玉杰,许岩,等. 大豆异黄酮代谢终产物:雌马酚的研究进展[J]. 食品工业科技,2012,33(19):401-403,408.
[2]Toi M,Hirota S,Tomotaki A,et al. Probiotic beverage with soy isoflavone consumption for breast cancer prevention:a case-control study[J]. Current Nutrition and Food Science,2013,9(3):194.
[3]Tse G,Eslick G D. Soy and isoflavone consumption and risk of gastrointestinal cancer:a systematic review and meta-analysis[J]. European Journal of Nutrition,2014:1-11.
[4]丁刚强,高洁. 中国居民营养的发展与挑战[J]. 中国食品学报,2016,16(7):1-5.
[5]刘琴,牛文慧,张薇娜,等. 大豆与大豆芽中异黄酮的含量、组成及比较研究[J]. 食品工业科技,2013,34(21):60-64.
[6]张海军,苏连泰,李琳,等. 高效液相色谱法(HPLC)测定大豆异黄酮含量的研究[J]. 大豆科学,2011,30(4):672-675.
[7]张海军,王英,王庆钰. 大豆异黄酮检测方法研究概述[J].粮食与油脂,2011(3):39-42.
[9]孙冬梅,董玉娟,胥爱丽,等. 基于 UPLC/Q-TOFMS 的大豆异黄酮保健食品中异黄酮成分的快速分析[J]. 世界科学技术-中医药现代化,2015,1:22.

[11]Lu J,Xie Y,Tan Y,et al. Simultaneous determination of isoflavones,saponins and flavones in Flos Puerariae by ultra performance liquid chromatography coupled with quadrupole time -of-flight mass spectrometry[J]. Chemical and Pharmaceutical Bulletin,2013,61(9):941-951.
[12]Gaya P,Arqués J L,Medina M,et al. A New HPLC-PAD/HPLC-ESI-MS Method for the Analysis of Phytoestrogens Produced by Bacterial Metabolism[J]. Food Analytical Methods,2015:1-11.
[13]Shuang Zhang,Zong-Ping Zheng,Mao-mao Zeng,et al. A novel isoflavone profiling method based on UPLC-PDA-ESI-MS[J]. Food Chemistry,2017,219:40-47.
[14]Gasparetto J C,Smolarek F S F,De Francisco T M G,et al. Development and validation of an HPLC-DAD method for analysis of the six major isoflavones in extracts from soybean processing[J]. Journal of the American Oil Chemists’ Society,2012,89(7):1211-1222.
[15]袁波,甄慧娟,姜璇,等. UPLC法测定大豆制品及相关制剂中大豆异黄酮含量[J]. 食品科学,2013,34(8):164-167.
[16]You-Shin Shim,Won-Jin Yoon,Jin-Bong Hwang,et al. Rapid method for the determination of 14 isoflavones in food using UHPLC coupled to photo diode array detection[J]. Food Chemistry,2015,187:391-397.
[17]Aguiar C L,Haddad R,Eberlin M N,et al. Thermal behavior of malonylglucoside isoflavones in soybean flour analyzed by RPHPLC/DAD and eletrospray ionization mass spectrometry[J]. LWT-Food Science and Technology,2012,48(1):114-119.
[18]Yerramsetty V,Mathias K,Bunzel M,et al. Detection and structural characterization of thermally generated isoflavone malonylglucoside derivatives[J]. Journal of Agriculture and Food Chemistry,2011,59(1):174-183.
