芒果皮渣多糖脱蛋白和脱色工艺研究
2018-01-22,,*,,,,,
,,*,,,,,
(1.中国热带农业科学院南亚热带作物研究所,农业部热带果树生物学重点实验室,广东湛江 524091;2.中国热带农业科学院农产品加工研究所,广东湛江 524001)
芒果,又名蜜望、檬果,是漆树科常绿乔木,含有丰富的糖类、蛋白质、维生素、类胡萝卜素和钙质等营养成分[1],素有“热带水果之王”之称[2-4]。多糖是芒果皮渣的主要活性成分之一,研究表明,芒果多糖具有抗氧化[5-7]、抗癌[8]、抗肝毒[9]、抗菌[10]等作用。游离蛋白质和色素是芒果皮渣多糖提取过程中的主要杂质,不但影响多糖的纯度和生物活性,而且对其分离纯化及结构表征研究带来很大困难[11]。因此,寻求一种除蛋白效果好、脱色率高、对多糖损失少的脱蛋白和脱色工艺尤为重要。目前,植物多糖常用的脱蛋白方法有Sevage法、三氯乙酸(TCA)法、酶法、盐酸法和鞣酸法等,由于单独使用一种方法蛋白质脱除率较低,因而也有将几种方法联用来进行脱蛋白[12]。脱色方法主要有活性炭法[13]、壳聚糖法、H2O2法[14]、聚酰胺法、大孔吸附树脂法[15]等,活性炭由于吸附能力强,脱色成本低且不易影响提取物的生物活性而在工业化生产中得到了广泛应用。基于此,本研究以实验室自制的芒果皮渣多糖为原料,采用9种方法对其进行脱蛋白处理,选择活性炭对TCA-正丁醇法脱蛋白后的多糖溶液进行脱色,并寻求最佳的脱蛋白和脱色工艺,为进一步分离纯化芒果皮渣多糖提供理论参考。
1 材料与方法
1.1材料与仪器
台农1号芒果 购自广西百色;粉末活性炭 广东韩研活性炭制造有限公司;HPD100、HPD-100A、HPD300、AB-8、X-5、D3520、D4020、S-8、NKA-9、NKA-II大孔吸附树脂 郑州华溢科技新材料股份有限公司;牛血清白蛋白、考马斯亮蓝(G-250) 美国Sigma公司;木瓜蛋白酶 Solarbio公司;葡萄糖、苯酚、三氯乙酸、盐酸 天津市福晨化学试剂厂;浓硫酸 廉江市爱廉化试剂有限公司;无水乙醇、正丁醇、30% H2O2天津市富宇精细化工有限公司;氯仿、丙酮 广州苏喏化工有限公司。
DHG 9140A电热鼓风干燥箱 上海一恒科学仪器有限公司;GL-20G-II高速冷冻离心机 美国Thermo公司;EL 104电子天平 梅特勒-托利多仪器(上海)有限公司;RE-3000B旋转蒸发仪 德国海道尔夫公司;FD-1C-50型真空冷冻干燥机 上海乔跃电子有限公司;UV-2550型紫外分光光度计 日本岛津公司;MAXQ800型恒温摇床 美国Thermo公司;79-1型磁力搅拌器 新康医疗器械有限公司;SHZ-D(III)循环水式多用真空泵 巩义市英峪高科仪器;HH-4恒温水浴锅 常州澳华仪器有限公司。
1.2实验方法
1.2.1 芒果皮渣多糖的制备 取成熟、无腐烂的芒果皮渣,清洗,55 ℃烘干24 h,粉碎,过40目筛,备用。称取一定重量的芒果皮渣粉,以蒸馏水为提取剂,按照本实验室优化的工艺参数进行提取(料液比1∶40 g/mL、水浴温度98 ℃,水浴时间4 h),随后以6000 r/min离心10 min,收集上清液,残渣重复提取1次。合并上清液,减压浓缩至原体积1/5,加入浓缩液4倍体积95%乙醇,4 ℃静置过夜,3000 r/min离心10 min,沉淀依次用无水乙醇、丙酮、乙醚洗涤2~3次,冷冻干燥即得芒果皮渣粗多糖。
1.2.2 芒果皮渣多糖脱蛋白
1.2.2.1 不同脱蛋白方法的比较 配制5 mg/mL芒果皮渣多糖溶液,取30 mL,分别采用9种不同的方法进行脱蛋白。
三氯乙酸(TCA)法[16]:加入30 mL 20% TCA(m/V),160 r/min振荡2 h,4000 r/min离心10 min,取上清液分别测定蛋白质含量和多糖含量。
TCA-正丁醇法[17-18]:加入60 mL TCA-正丁醇溶液[TCA(20%)∶正丁醇=1∶10 (V/V)],160 r/min振荡2 h,倒入分液漏斗中静置2 h,待分层后取下层溶液,分别测定蛋白质含量和多糖含量。
Sevage法[19]:加入7.5 mL Sevage试剂[氯仿∶正丁醇=4∶1(V/V)],180 r/min振荡60 min,4000 r/min离心10 min,弃去下层有机相和中间层胶状变性蛋白质,取上层溶液分别测定蛋白质含量和多糖含量。
TCA+Sevage法:用TCA法脱除一次,再用Sevage法脱除一次,分别测定蛋白质含量和多糖含量。
木瓜蛋白酶法[20]:配制1 mg/mL木瓜蛋白酶溶液,取1.5 mL加入到多糖溶液中,调节pH为6.5,65 ℃水浴振荡水解3 h,沸水浴灭酶5 min,冷却后4000 r/min离心10 min,取上清液分别测定蛋白质含量和多糖含量。
木瓜蛋白酶+Sevage法[21]:用木瓜蛋白酶法脱除一次,再用Sevage法脱除一次,分别测定蛋白质含量和多糖含量。
木瓜蛋白酶+TCA法[26]:依次用木瓜蛋白酶法和TCA法脱蛋白,分别测定蛋白质含量和多糖含量。
木瓜蛋白酶+TCA-正丁醇法[22]:依次用木瓜蛋白酶法和TCA-正丁醇法脱蛋白,分别测定蛋白质含量和多糖含量。
HCl法[23]:加入30 mL 1 mol/L HCl,160 r/min振荡2 h,4000 r/min离心10 min,取上清液分别测定蛋白质含量和多糖含量。
1.2.2.2 TCA-正丁醇法脱蛋白工艺优化 选取对TCA-正丁醇法脱蛋白效果影响较大的3个因素TCA-正丁醇与样液体积比(A)、TCA与正丁醇体积比(B)和振荡时间(C),按L9(34)正交表安排实验,因素水平见表1。数据处理采用综合加权评分法[24],评分标准为:分别测定蛋白质脱除率和多糖保留率,将各项指标除以该列最大值再乘以100,为该项得分,设定蛋白质脱除率和多糖保留率两者的权重系数均为0.5,对两项指标进行加权求和,按下式计算综合评分。
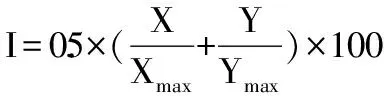
式中,X为蛋白质脱除率,Y为多糖保留率,Xmax为蛋白质脱除率最大值,Ymax为多糖保留率最大值。
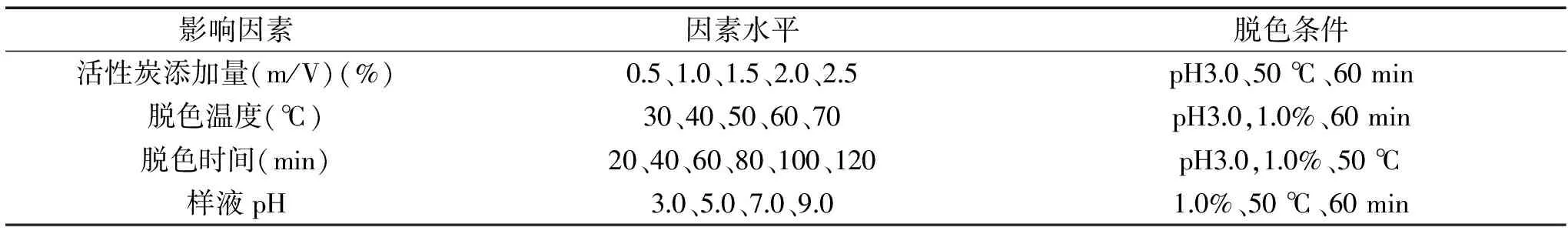
表2 活性炭脱色单因素实验Table 2 Univariate experiments on decoloration by active carbon

表1 TCA-正丁醇法脱蛋白正交实验因素及水平表Table 1 Factors and levels of orthogonal test on deproteinzation by TCA-n-butanol method
1.2.3 活性炭脱色
1.2.3.1 单因素实验 取20 mL经TCA-正丁醇法脱蛋白后的多糖溶液,以脱色率和多糖保留率为评价指标,分别探讨活性炭添加量、脱色温度、脱色时间和样液pH对芒果皮渣多糖溶液脱色效果的影响,每个水平做3个重复。其单因素实验水平设计见表2。
1.2.3.2 正交实验 根据单因素实验结果,选取脱色温度(D)、脱色时间(E)、活性炭添加量(F)、样液pH(G)4个因素,每个因素设置3个水平,按L9(34)正交表设计实验(见表3),以脱色率和多糖保留率为考察指标进行条件优化。进行综合评分时以指标的最大值为参照将数据进行归一化,脱色率和多糖保留率的权重系数各为0.5。
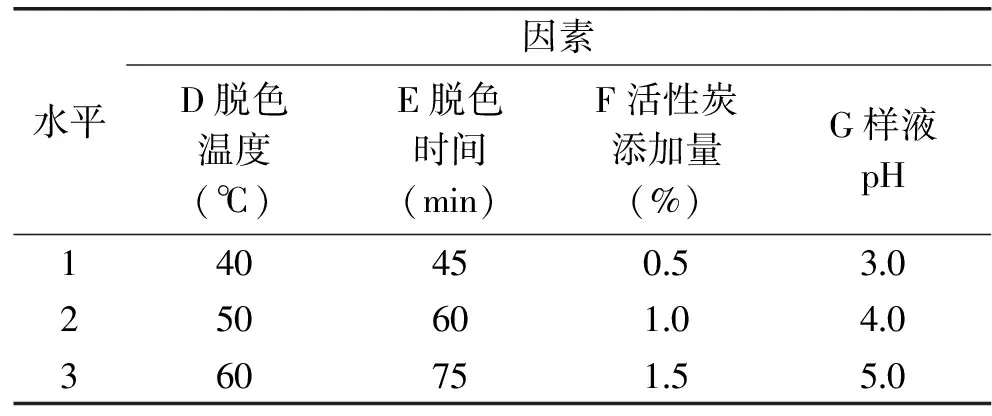
表3 活性炭脱色正交实验因素水平表Table 3 Factors and levels of orthogonal test on decoloration by active carbon
1.2.4 分析方法
1.2.4.1 多糖保留率的测定 采用苯酚-硫酸法[25]测定多糖含量。以葡萄糖标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程:y1=0.0110x1-0.0002,式中x1为葡萄糖浓度,y1为吸光度,R2=0.9994,线性范围为0~0.07 mg/mL。多糖保留率按下式计算。
多糖保留率(%)=脱蛋白(脱色素)后多糖含量/脱蛋白(脱色素)前多糖含量×100
式(1)
1.2.4.2 蛋白质脱除率的测定 采用考马斯亮蓝G-250法测定蛋白质含量。以牛血清白蛋白标准品含量为横坐标,于595 nm处测得的吸光度值为纵坐标,绘制标准曲线,得到回归方程y2=0.0007x2+0.0057,式中x2为蛋白质含量,y2为吸光度,R2=0.9996,即蛋白质含量在0~1.0 mg范围内与吸光度呈现良好的线性关系。蛋白质脱除率按下式计算。
蛋白质脱除率(%)=脱蛋白前蛋白质含量-脱蛋白后蛋白质含量/脱蛋白前蛋白质含量×100
式(2)
1.2.4.3 脱色率的测定 将经TCA-正丁醇法脱蛋白后的芒果皮渣多糖溶液于200~600 nm波长范围内进行紫外-可见光谱全波长扫描,结果表明多糖溶液在310 nm下有最大吸收峰,故选择310 nm为检测波长测定芒果皮渣多糖溶液脱色前后的吸光度,并按下式计算脱色率。
脱色率(%)=脱色前吸光度-脱色后吸光度/脱色前吸光度×100
式(3)
2 结果与分析
2.1芒果皮渣多糖脱蛋白
2.1.1 不同脱蛋白方法的比较 由图1可知,9种方法对芒果皮渣多糖均有一定的脱蛋白效果,但在脱除蛋白质的同时,造成不同程度的多糖损失。从脱蛋白效果来看,TCA-正丁醇法和木瓜蛋白酶+TCA-正丁醇结合法对粗多糖中蛋白质脱除效果较好,脱除率均高于80%,且后者稍高于前者,这可能是由于蛋白酶除了酶解多糖溶液中的游离蛋白质外,还对与多糖结合的蛋白质产生了酶解作用。从多糖的损失方面来看,木瓜蛋白酶+TCA-正丁醇结合法略高于TCA-正丁醇法,这可能是由于多次操作造成部分多糖损失。此外,TCA法、TCA+Sevage法、HCl法和木瓜蛋白酶+TCA法对芒果皮渣多糖的蛋白质脱除率均高于45%,但多糖损失严重;而Sevage法、木瓜蛋白酶法和木瓜蛋白酶+Sevage法的多糖损失较少,但脱蛋白效果较差,脱除率均低于10%。综上所述,选择TCA-正丁醇法对芒果皮渣多糖进行脱蛋白处理。
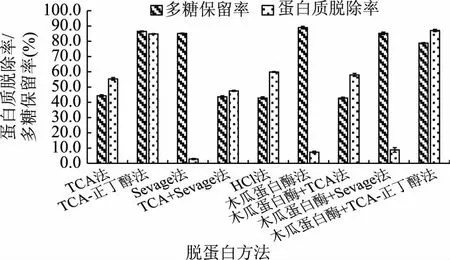
图1 不同方法对蛋白质脱除率与多糖保留率的影响Fig.1 Effect of different methods on the rate of deproteinization and polysaccharide retention
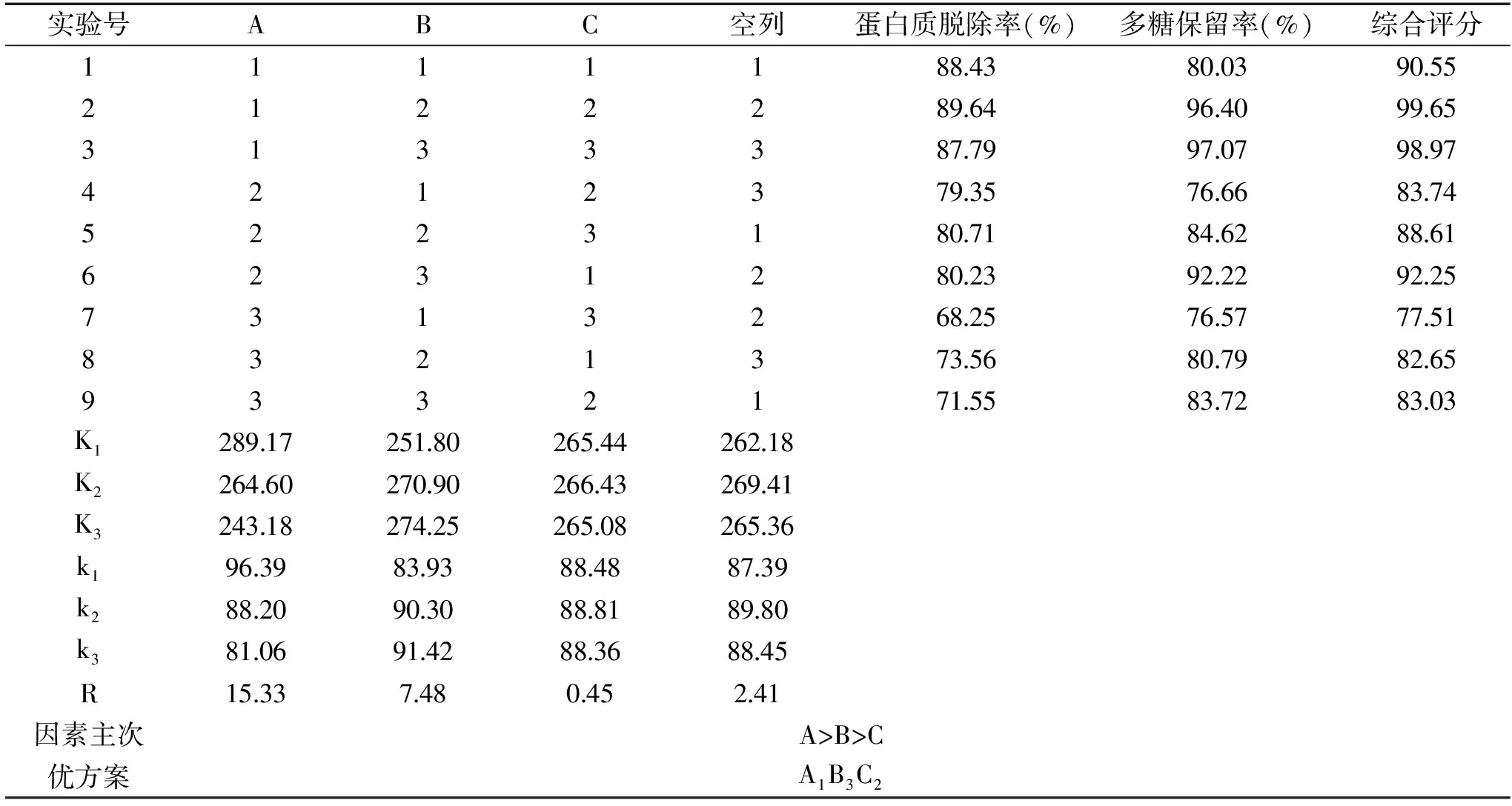
表4 TCA-正丁醇法脱蛋白正交实验结果Table 4 Results of orthogonal test on deproteinization by TCA-n-butanol

表5 方差分析和显著性检验结果Table 5 Results on analysis of variance and significance test
注:F0.05(2,2)=19.00;F0.01(2,2)=99.00;**表示差异极显著(p<0.01);*表示差异显著(p<0.05);表7同。
2.1.2 TCA-正丁醇法脱蛋白工艺条件优化 由表4可知,影响TCA-正丁醇法脱蛋白效果的因素大小顺序为:A>B>C,即TCA-正丁醇与样液的体积比对脱蛋白效果影响最大,其次为TCA与正丁醇的体积比,振荡时间对脱蛋白效果影响最小。TCA-正丁醇法脱蛋白的最佳工艺条件为A1B3C2,即TCA-正丁醇与样液体积比为2∶1,三氯乙酸与正丁醇体积比为1∶20,振荡时间为2 h。对正交实验结果进行方差分析,结果如表5所示。由表5可知,因素A、B对蛋白质脱除率有非常显著的影响,因素C对蛋白质脱除率有显著影响。在最佳工艺条件下进行3次验证实验,得出蛋白质脱除率为90.08%,多糖保留率为96.40%,此时综合得分为99.90。
2.2活性炭脱色工艺研究
2.2.1 活性炭添加量对芒果皮渣多糖脱色效果的影响 由图2可知,随着活性炭添加量的增加,脱色率不断增大,当活性炭添加量大于1.0%时,脱色率增大趋势减缓。而多糖保留率随着活性炭添加量的增加呈逐渐降低的趋势,综合考虑,选择活性炭添加量为1.0%。
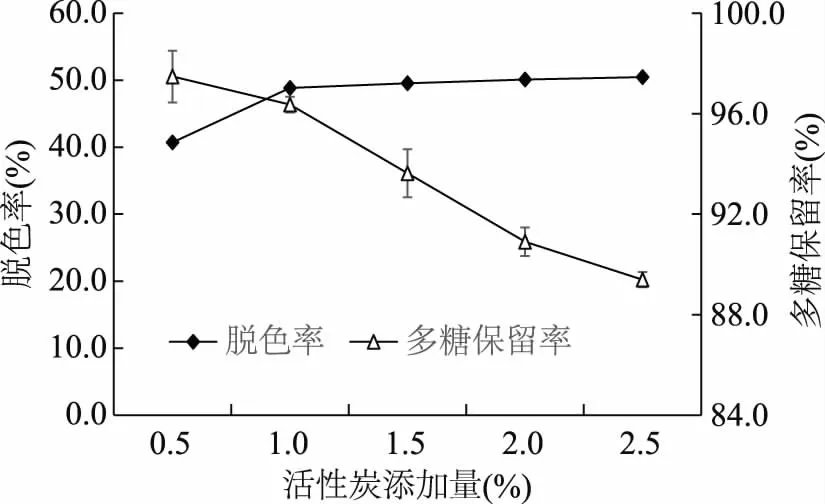
图2 活性炭添加量对脱色率和多糖保留率的影响Fig.2 Effect of amounts of active carbon on decoloration and polysaccharide retention
2.2.2 脱色温度对芒果皮渣多糖脱色效果的影响 由图3可知,随着脱色温度的升高,脱色率呈先增大后减小趋势,当温度为50 ℃时,脱色率达到最大。脱色温度在30~40 ℃内,多糖保留率显著增加,当温度为40 ℃时,多糖保留率达到最大,此后继续升高温度,多糖保留率逐渐降低。这可能是因为温度较低,分子扩散运动不明显,色素分子与活性炭不能很好的接触吸附;温度过高,部分多糖丧失活性,进而影响多糖含量。综合考虑,选择脱色温度为50 ℃。
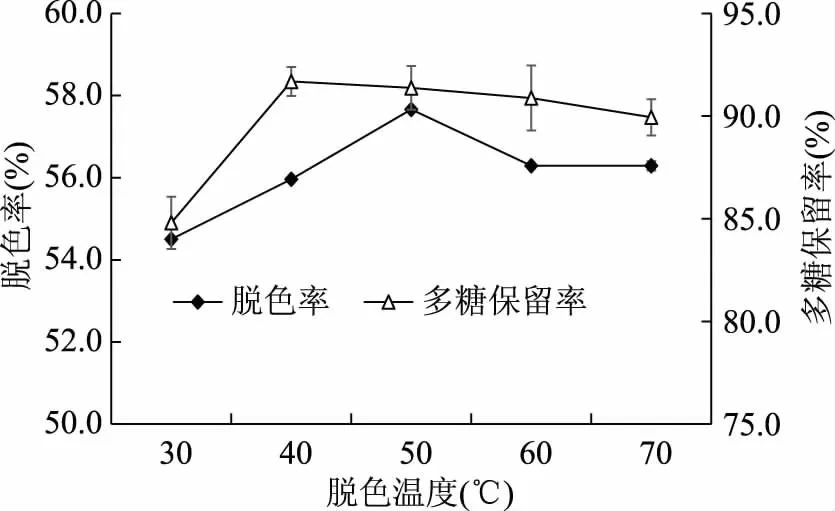
图3 脱色温度对脱色率和多糖保留率的影响Fig.3 Effect of decolorating temperature on decoloration and polysaccharide retention
2.2.3 脱色时间对芒果皮渣多糖脱色效果的影响 由图4可知,随着脱色时间的延长,脱色率呈先增加后减小趋势,当脱色时间为60 min时,脱色率达到最大;多糖保留率随着脱色时间的延长缓慢降低,在60~100 min的范围内降低趋势较平缓,这可能是由于多糖被活性炭产生吸附的缘故。综合考虑选择最佳脱色时间为60 min。
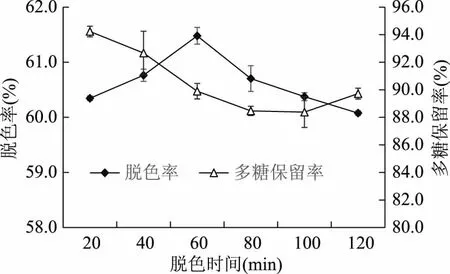
图4 脱色时间对脱色率和多糖保留率的影响Fig.4 Effect of decolorating time on decoloration and polysaccharide retention
2.2.4 样液pH对芒果皮渣多糖脱色效果的影响 由图5可知,在测定pH范围内,脱色率随着样液pH的增加逐渐降低。样液pH在3.0~5.0范围内,多糖保留率显著增加,pH为5.0时,多糖保留率达到最大;此后继续增大样液pH,多糖保留率变化不大。以上结果表明酸性条件有利于活性炭的吸附脱色作用,而多糖在碱性条件下比在酸性条件下稳定。综合考虑脱色率和多糖保留率,选择样液pH为3.0~5.0来开展后续实验。
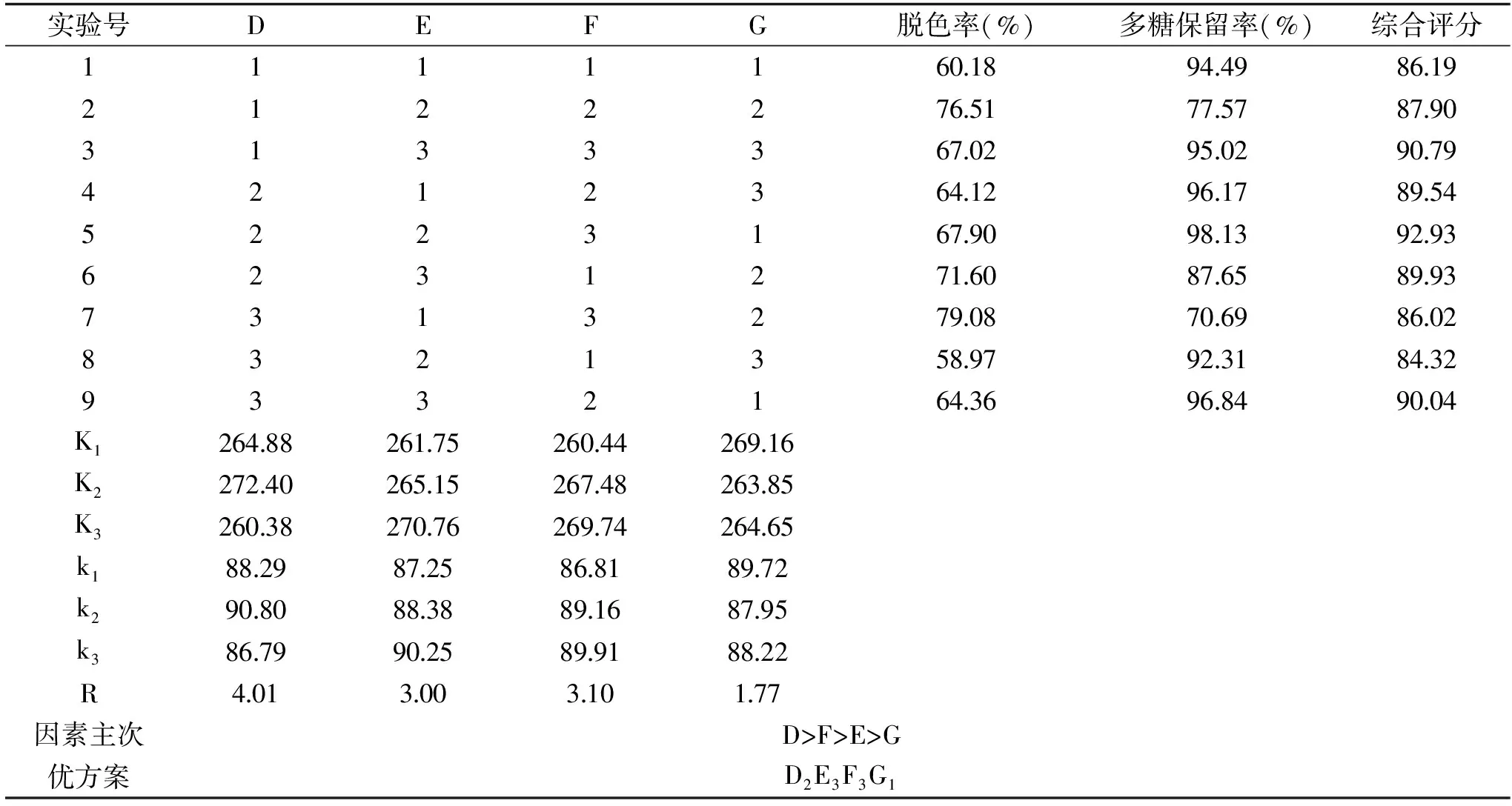
表6 活性炭脱色正交实验结果Table 6 Results of orthogonal test on decoloration by active carbon
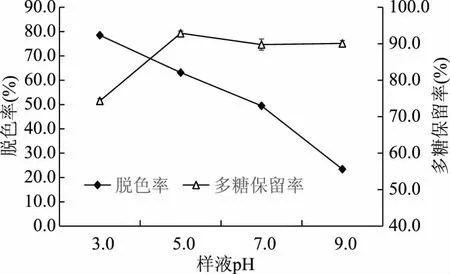
图5 样液pH对脱色率和多糖保留率的影响Fig.5 Effect of sample pH on decoloration and polysaccharide retention
2.2.5 正交实验结果 由表6和表7分析可知,影响活性炭脱色综合评分的因素大小顺序为:D>F>E>G,即脱色温度对综合评分影响最大,其次为活性炭添加量,再次是脱色时间,样液pH对脱色效果影响最小。活性炭脱色的最佳工艺条件为D2E3F3G1,即脱色温度50 ℃,脱色时间75 min,活性炭添加量1.5%,样液pH3.0。按优化的工艺条件进行3次验证实验,得到脱色率为70.98%,多糖保留率为92.77%,综合评分为93.66,表明实验所确定的工艺条件为最优脱色工艺条件。
3 结论
本实验采用9种不同的方法对实验室自制的芒果皮渣多糖进行脱蛋白研究,结果表明TCA-正丁醇法的脱蛋白效果较好。

表7 活性炭脱色方差分析表Table 7 Analysis of variance of decoloration by active carbon
为探索TCA-正丁醇法脱蛋白的适宜条件,选取TCA-正丁醇与样液体积比、TCA与正丁醇体积比、振荡时间3个因素安排正交实验,结果发现3个因素对脱蛋白效果的影响主次顺序为:TCA-正丁醇与样液体积比>TCA与正丁醇体积比>振荡时间,适宜的脱蛋白工艺为TCA-正丁醇与样液体积比2∶1,TCA与正丁醇体积比1∶20,振荡时间2 h,在此条件,蛋白质脱除率为90.08%,多糖保留率为96.40%。采用活性炭对经TCA-正丁醇法脱蛋白后的多糖溶液进行脱色处理,分别考察了脱色温度、脱色时间、活性炭添加量和样液pH对脱色效果的影响,在单因素实验的基础上通过正交实验优化最佳脱色工艺,结果表明,当调节样液pH为3.0,添加1.5%的活性炭,50 ℃振荡吸附75 min,脱色率为70.98%,多糖保留率为92.77%。本方法降低了粗多糖中蛋白质和色素含量,改善了其外观,提高了多糖的纯度,为后续芒果皮渣多糖的进一步研究提供了参考。
[1]孙延芳,梁宗锁,张欣,等. 芒果多糖的纯化与光谱分析[J]. 食品科学,2012,33(7):93-95.
[2]王维民,汪敏. 芒果皮粗多糖提取的影响因素及工艺的研究[J]. 农产品加工·学刊,2005,9(2):128-131.
[3]RN Tharanathan,HM Yashoda,TN Prabha. Mango,“the king of fruits”-an overview[J]. Food Reviews International,2006,22(2):95-123.
[4]Prassana V,Prabha T N,Tharanathan R N. Pectic polysaccharides of mango(MangiferaindicaL.):structural studies[J]. Journal of the Science of Food & Agriculture,2004,84(13):1731-1735.
[5]Chen Y,Luo H,Gao A,et al. Extraction of polysaccharides from mango(MangiferaindicaLinn)seed by response surface methodology and identification of their structural characteristics[J]. Food Analytical Methods,2012,5(4):800-806.
[6]Airianah O B,Vreeburg R A M,Fry S C. Pectic polysaccharides are attacked by hydroxyl radicals in ripening fruit:evidence from a fluorescent fingerprinting method[J]. Annals of Botany,2016,117(3):441-455.
[7]Sadeq H A S,Amin I,Mohd Y M,et al. Purification,characterization and antioxidant activity of polysaccharides extracted from the fibrous pulp of Mangifera pajang fruits[J]. LWT-Food Science and Technology,2012,2(48):291-296.
[8]Maran J P,Swathi K,Jeevitha P,et al. Microwave-assisted extraction of pectic polysaccharide from waste mango peel[J].
Carbohydrate Polymers,2015,123:67-71.
[9]Fahmy S R,Amien A I,Abd-Elgleel F M,et al. Antihepatotoxic efficacy of Mangifera indica L. polysaccharides against cyclophosphamide in rats[J]. Chemico-Biological Interactions,2016,244:113-120.
[10]Alok P,Keerthana V,Kumar J C,et al. Antibacterial property of two different varieties of Indian mango(Mangiferaindica)kernel extracts at various concentrations against some human pathogenic bacterial strains[J]. International Research Journal of Biological Science,2013,2:28-32.
[11]李小蓉,黄毓娟,权彦. 倒卵叶五加多糖脱色工艺研究[J]. 食品工业科技,2013,24(4):296-299.
[12]屈小玄,郑永清,吕远平. 猴头菇多糖脱蛋白方法的比较研究[J]. 食品科技,2015,40(9):170-175.
[13]贾淑珍,王成忠,于功明. 香菇多糖脱色方法的研究[J].食品科技,2007,36(6):113-115.
[14]杨大伟,吴永尧,唐巧玉. 碎米荠多糖的过氧化氢脱色方法研究[J]. 食品科技,2008,33(1):174-177.
[15]张丛丛,王莹,朴美子. 响应面法优化黄秋葵多糖脱色工艺[J]. 食品工业科技,2014,35(19):251-256.
[16]郭思维,刘胜姿,李威,等. 人工冬虫夏草多糖脱色脱蛋白工艺研究[J]. 食品科技,2013,38(5):207-211.
[17]李锦运. 冷破碎苹果皮渣中多糖的提取、分离纯化及抗氧化性研究[D]. 西安:陕西师范大学,2011.
[18]李艳红. 山植多糖的提取、分离纯化及结构研究[J]. 太原:山西大学,2006.
[19]于晓红. 西洋参多糖结构表征及免疫活性研究[D]. 哈尔滨:哈尔滨理工大学,2016.
[20]刘小攀,田启建,田春莲. 黄精多糖酶法脱蛋白的工艺研究[J]. 西北林学院学报,2016,31(1):238-242.
[21]方婷,曾红亮,陈晓垚,等. 猪肚菇粗多糖脱蛋白脱色工艺优化研究[J]. 热带作物学报,2015,36(6):1166-1172.
[22]汪艳群,孟宪军,李冬男,等. 五味子多糖脱蛋白工艺的研究[J]. 食品工业科技,2011,37(3):280-284.
[23]郭育东,单斌,李敏仪. 苦瓜多糖脱蛋白方法的比较研究[J]. 安徽农业科学,2009,37(7):3225-3227.
[24]廖春燕,许海润,黄瑶. 猫须草多糖脱蛋白脱色工艺[J]. 广西科技大学学报,2016,27(4):111-115.
[25]李金花,农石生,韦柳培,等. 芒果叶多糖的提取及含量测定[J]. 食品研究与开发,2012,33(3):135-137.
[26]何沂飞,刘平怀,黄良果,等. 库拉索芦荟凝胶多糖脱蛋白方法研究[J]. 食品工业科技,2014,35(17):190-192.
