生防菌株洋葱伯克氏菌对草莓果实采后病害控制及安全性评价
2018-01-22,,
,,
(1.山西大学生命科学学院,山西太原 030006;2.山西省农业科学院农产品贮藏保鲜研究所,山西太原 030031)
微生物防治方法由于其无残留、不产生耐药性等优点,被认为是最有可能替代化学杀菌剂的方法之一[1-2]。洋葱伯克氏菌(Burkholderiacepacia)在20世纪50年代作为一种植物病原菌被人们认识,Burkholder首次报道该菌可引起洋葱鳞茎腐烂,称为洋葱假单胞菌(Pseudomonascepacia)[3]。洋葱伯克氏菌广泛存在于土壤、水和植物根际。农业领域中,洋葱伯克氏菌具有生物防治、生物降解以及促进植物生长等多种功能,在农业方面有广泛应用前景及生物防范功效[4-6]。
洋葱伯克氏菌是一类基因型不同、表型相近的菌株复合群,目前已发现17个基因型,称为洋葱伯克氏菌复合群(Burkholderiacepaciacomplex,简称Bcc)[7-8]。Bcc能防治多种植物的真菌性病害,如由腐霉(Pythiumspp.)、立枯丝核菌(Rhizoctoniasolani)和镰刀菌(Fusariumspp.)引起的植物猝倒病[9];Parke J L[9]等发现洋葱伯克氏菌对梨青霉病(Penicilliumexpansum)、苹果灰霉病(Botrytiscinerea)和桃褐腐(Sclerotinialaxa)以及柑橘各种采后病害也具有生防效果;De Costa等[10]从香蕉表面也分离到伯克氏菌,可有效防治香蕉炭疽病(Colletotrichummusae)的发生。本实验室从杏果实分离得到基因型为Burkholderiacontaminans的洋葱伯克氏菌,初步研究发现[11]该菌株可以降低玫瑰香葡萄采后腐烂率。Bcc复合群中的一些基因型曾作为人体的条件致病菌[12-14],在英国、加拿大等囊性肺纤维化(CF)病人中大流行,引起败血症、肺炎、心内膜炎和伤口感染等[15-16],因此研究该类生防菌株的安全性也十分必要。本文一方面研究洋葱伯克氏菌对草莓果实采后病害的防治效果,另一方面进行动物实验,进一步测定其安全性,旨在为生防菌洋葱伯克氏菌的开发利用奠定理论基础。
1 材料与方法
1.1材料与仪器
洋葱伯克氏菌(B.contaminans) 本实验室制备;灰葡萄孢霉(Botrytiscinerea) 分离于自然发病的草莓果实;草莓果实 采自山西省晋中市东阳镇大棚内,早8点前采收,品种为“红颜”,采摘当天运回实验室预冷并贮藏于0 ℃冷库中;Wistar大鼠(体重180~220 g,动检号:070101)、家兔(体重2.5~3.0 kg)、豚鼠(体重为200~250 g) 山西医科大学实验动物中心提供。
LS-B50L-I型压力蒸汽灭菌器 江阴滨江医疗设备有限公司;BSD-WF2200振荡培养箱 上海博讯实业有限公司;HDL型超净工作台 北京东联哈尔仪器制造有限公司;DHP-9272型电热恒温培养箱 上海一恒科技有限公司。
1.2实验方法
1.2.1 生防菌B-1发酵液的制备 生防菌洋葱伯克氏菌B.contaminansB-1由本实验室分离于杏果实表面,进行分子和生理生化鉴定。将保存于-80 ℃的B-1在PDA固体培养基活化培养后,挑取单菌落于50/250 mL LB液体培养基中28 ℃ 200 r/min摇瓶培养。
1.2.2 孢子悬浮液的制备 由发病果实分离的灰葡萄孢霉于PDA平板26 ℃培养5~7 d后,刮取分生孢子,采用血球计数法用无菌水配制成1.0×105孢子/mL的悬浮液。
1.2.3 草莓果实的预处理 自然腐烂法所用草莓果实为同一成熟度及颜色大小一致的果实,无病虫害及机械损伤。伤口接种法预处理:将同一大小颜色的健康草莓果实置于2%的次氯酸纳溶液中浸泡2 min,无菌风吹干放于灭菌的塑料筐中,用灭菌针在草莓腰部刺直径5 mm深度3 mm的伤口,每个果实刺1个伤口。
1.2.4 不同发酵时间对草莓果实采后病害的抑制 将经过6、12、24、48、72、96 h摇瓶培养的发酵液分别浸泡挑好的无伤口的草莓果实(CK处理不浸泡,阴性对照用无菌水浸泡),浸泡时间为3 min,无菌风吹干外套保鲜膜,于6 ℃下贮藏20 d。重复上述操作,16 ℃下贮藏9 d。每次处理0.5 kg的草莓果实,实验重复3次。
参考李静[17],根据果实腐烂等级,计算果实腐烂指数,用果实腐烂指数代表果实采后病害的程度。果实腐烂程度分5个等级,分级标准为:0级:果实完好,无任何腐烂;1级:果实表面现轻微斑点,腐烂面积小于1/3;2级:果实腐烂面积约果实表面的1/3~1/2;3级:果实腐烂部位超过果面1/2,但尚有一定硬度;4级:果实整体完全溃烂。腐烂指数计算公式如下:
果实腐烂指数(%)=[∑(各级腐烂果个数×腐烂级别)]/(最高腐烂级别×果实总个数)×100
1.2.5 不同处理方式对草莓果实采后病害的抑制 将1.2.1发酵24 h的发酵液置于小型喷雾器中,对放置于筐中挑好的无伤口草莓果实,进行均匀的喷淋实验,喷至表面果实均有液滴覆盖。另取相同的发酵液对草莓果实进行浸泡实验,分别浸泡0.5、1、2、3、4 min(CK不浸泡),喷淋或浸泡后无菌风吹干,外套保鲜袋,放置16 ℃贮藏9 d,参考1.2.4计算草莓果实的腐烂指数。每次处理0.5 kg的草莓果实,实验重复3次。
1.2.6 生防菌不同处理液对草莓采后病害的抑制 将1.2.1发酵24 h的发酵液分别进行如下处理。A:发酵原液;B:稀释5倍发酵液;C:稀释10倍发酵液;D:菌悬液(发酵液离心后,菌株用无菌水稀释至原体积);E:5倍菌悬液(同上,菌体稀释5倍);F:10倍菌悬液(同上,菌体稀释10倍);G:上清液;H:稀释5倍上清液;I:稀释10倍上清液。
将挑好的无伤口的草莓果实置于上述不同处理液中浸泡3 min,CK用无菌蒸馏水浸泡3 min。处理后用无菌风吹干,外套保鲜袋,放置16 ℃下贮藏9 d,参考1.2.4计算果实草莓的腐烂指数。每次处理0.5 kg的草莓果实,实验重复三次。
1.2.7 生防菌不同处理液对草莓采后灰霉病的影响 发酵液A、B、C、D、E的处理同1.2.6的A、B、C、D、G。F:热杀死液(发酵液经过121 ℃下灭菌15 min)。在草莓果实伤口处加不同的生防菌菌处理液40 μL,CK加无菌蒸馏水。无菌风吹2 h后,于每个伤口再加15 μL孢子悬浮液,外套保鲜袋,放置16 ℃下贮藏5 d。每次处理0.5 kg的草莓果实,实验重复3次。
参考赵妍[18]统计果实发病率及病斑直径。果实发病率为被感染的伤口数与伤口总数的百分比表示,病斑直径为用十字交叉法测量病斑最长值和最短值,取其平均值为腐烂部位的直径。
1.2.8 动物实验方法 根据《农药登记毒理学实验方法》[19]的标准,对该生防菌株进行相关实验,包括大鼠急性经口毒性实验、皮肤刺激实验、眼刺激实验和皮肤变态(致敏)实验。动物采用标准饲料喂食,自由饮水的方式。
1.2.8.1 大鼠急性经口毒性实验 将受试大鼠按体重随机分为4组,每组8只,雌雄各半。分别以发酵液1000、2150、4640、5000 mg/kg的剂量进行一次经口灌胃,灌胃体积为1 mL/100 g体重。灌胃前隔夜禁食,自由饮水。灌胃后立即观察中毒表现,2 h后喂食。记录中毒症状及死亡时间,持续观察2周,用Horn氏法计算LD50值,按“急性经口毒性分级标准”评价结果。
急性经口毒性分级标准[19]:经口LD50(mg/kg):<5为剧毒,5~50为高毒,50~500为中毒,>500为低毒。若>5000,动物仍不死亡,不需要进行更高剂量的实验。
1.2.8.2 家兔急性皮肤刺激实验 选用无皮肤疾患的健康家兔4只,将躯干中部脊柱两侧皮毛剪短后用8%的Na2S溶液涂抹脱毛,脱毛面积为5×6 cm2,脱毛后24 h确认皮肤无损伤后,将0.5 mL菌剂滴于2×3 cm2大小的4层纱布上,贴敷于一侧脱毛区,盖1层玻璃纸后,用胶布和绷带固定;另一侧为对照,滴等量生理盐水。两侧分别接触4 h后,用温水洗净皮肤。按“皮肤刺激评分标准”评价结果。
皮肤刺激评分标准[19]:A 红斑:无红斑0分,红斑勉强可见1分,红斑明显可见2分,重度红斑3分,紫红色红斑到轻度焦痂形成4分;B 水肿:无水肿0分,水肿勉强可见1分,水肿明显隆起2分,水肿皮肤处隆起1 mm,且轮廓清楚3分,水肿隆起1 mm以上并伴有扩大4分。总积分A+B,最高分值8分。
1.2.8.3 眼刺激实验 选用健康家兔4只,分别取受试物0.1 g,撒入左眼结膜囊内,立即轻闭眼睑约1 min,对照右眼加等量生理盐水。观察动物受药后1、24、48、72、96、168 h后眼结膜、虹膜和角膜的刺激损伤和恢复情况。按照“眼损伤程度”评分[19]。眼损伤程度:
A结膜,观察指标3项,充血状态A1:血管正常充血0分,充血呈鲜红色1分,充血呈深红色血管不易分辨2分,弥漫性充血呈血红色3分。水肿A2:无水肿0分,轻微水肿1分,明显水肿,伴有部分眼睑外翻2分,水肿至眼睑近半闭合3分,水肿至眼睑超过半闭合4分。分泌物A3:无分泌物0分,少量分泌物1分,分泌物使眼睑和睫毛潮湿或粘着2分,分泌物使整个眼区潮湿和粘着3分。将动物A1、A2、A3分值相加即为结膜A的损伤情况。最高积分为10。
B虹膜,正常为0,皱折明显加深,充血,肿胀,角膜周围有轻度充血,瞳孔对光仍有反应1分,出血,肉眼可见破坏,对光无反应(或出现其中之一)2分。
C角膜(以最致密部位为准)角膜情况C1:无浑浊为0,弥漫性浑浊,虹膜清晰可见1分,半透明区易分辨,虹膜模糊不清2分,出现灰白色透明区,虹膜细节不清,瞳孔大小明显看清3分,角膜不清楚,虹膜无法辨认4分。角膜受损范围C2:角膜受损程度<1/4为1分,1/4~1/2为2分,1/2~3/4为3分,3/4~1为4分,角膜C受损程度为C1×C2。最高积分16。
眼刺激积分指数(I.A.O.I)=A×2+B×5+C×5,最高积分为110。
1.2.8.4 豚鼠皮肤变态反应(致敏)实验 将20只豚鼠随机分成两组,实验组和阳性对照组。实验组给以生防菌,阳性对照组给以2,4-二硝基氯苯溶液。步骤如下:
A. 致敏接触:实验前24 h将动物背部左侧去毛3×3 cm2。将0.2 mL的菌剂发酵液均匀涂于脱毛区,用2层纱布和1层玻璃纸覆盖,再以无刺激胶布封闭固定,持续6 h后用温水洗去受试物。第7 d和14 d以同样方法重复一次。阳性对照组给以1% 2,4-二硝基氯苯溶液0.2 mL,操作同上。
B. 激发接触:实验前24 h将动物背部右侧去毛2×2 cm2。末次致敏后14 d,将0.2 mL生防菌剂均匀涂于右侧去毛区,操作方法同致敏接触,持续6 h后用温水洗去受试物,每日观察皮肤情况至12 d。阳性对照组给以0.1%的2,4-二硝基氯苯溶液0.2 mL,操作方法同上。
将出现皮肤红斑或者水肿(无论程度轻重)的动物数除以动物总数,求出动物致敏率[19]。
1.2.9 数据分析实验数据 采用Origin 85和Excel 2007软件进行处理分析。Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1生防菌不同发酵时间对草莓果实采后自然腐烂的影响
草莓于6 ℃下贮藏20 d后,结果见图1 A。CK和经无菌水浸泡的果实腐烂指数无显著性差异,其腐烂指数分别为87.96%和89.32%。生防菌经过不同时间的发酵后,与CK比,其腐烂指数有显著性差异,其中发酵24 h的菌液效果最好,腐烂指数为40.15%,与CK比腐烂指数下降了54.35%。草莓于16 ℃下贮藏9 d后(见图1 B),与6 ℃的结果相似,发酵24 h腐烂指数最低为51.43%,比CK下降了43.95%。该实验结果与李静[17]的体外实验相一致,李静发现该菌发酵24 h的平板抑菌圈直径最大,其原因可能是发酵培养24 h时,该生防菌已完成了对数生长期,其活菌数达到最大值,其抑菌活性物质得到最大富集,从而且提高了抑菌活性最强,表现为果实腐烂率最低。

图1 不同发酵时间对草莓自然腐烂的影响Fig.1 Effect on natural decay of strawberries with different fermentation times注:A:6 ℃ 20 d;B:16 ℃ 9 d。

图2 不同处理方式对草莓自然腐烂的影响(16 ℃ 9 d)Fig.2 Effect on natural decay of strawberries with different process ways(16 ℃ 9 d)
2.2生防菌不同处理方式对草莓果实采后自然腐烂的影响
由图2可知,采用喷淋和浸泡的方法均可以降低草莓果实的腐烂。喷淋的方式和浸泡30 s、1、2 min相比,无显著差异,继续增加浸泡时间,浸泡3 min中草莓的腐烂指数最低,为41.00%,与CK相比,其抑制达46.74%。再继续增加浸泡时间为4 min时,草莓腐烂指数略有上升。其原因可能是浸泡时间较短或者喷淋时,菌株不能很好的附着在果实表面,随着时间延长,附着菌液也会增多,能够实现有效定殖,增强抑制能力,而当浸泡时间过长,由于草莓果皮较娇嫩,缺乏保护层,果皮容易造成机械损伤,造成病害侵染,故腐烂指数增加。
2.3生防菌不同处理液对草莓采后自然腐烂的影响
草莓果实经生防菌不同处理液浸泡后,其自然腐烂情况见图3。上清液、5倍稀释上清液和10倍稀释上清液的效果与CK相比无显著差异,而发酵液和菌悬液及它们的5倍、10倍稀释液与CK比有显著差异,说明该生防菌的抑菌活性物质可能不在上清液中。其中,稀释5倍的发酵液效果最好,果实腐烂指数为56.39%,与CK比,腐烂指数下降了37.56%。发酵液稀释5倍后效果反而比发酵原液好,其原因可能是菌株的浓度太高,一些对果实不利的代谢产物分泌也较多,对果实造成一定伤害。

图3 生防菌不同处理液对草莓自然腐烂的影响Fig.3 Effect on natural decay of strawberries with different treatment of B. contaminans注:CK:无菌水;A:发酵原液;B:稀释5倍发酵液;C:稀释10倍发酵液;D:菌悬液;E:稀释5倍菌悬液;F:稀释10倍菌悬液;G:上清液;H:稀释5倍上清液;I:稀释10倍上清液。
2.4生防菌不同处理液对草莓采后灰霉病的影响
生防菌不同处理液对草莓采后灰霉病的抑制效果见表1。从表1中可知,接种5 d后,CK发病达98.20%,病斑达到1.21 cm,发酵原液、稀释5倍发酵液和菌悬液处理均未发病,稀释10倍发酵液轻微发病,发病率为9.00%,而上清液和热杀死液与CK发病率无显著性差异,则抑菌效果好的主要是菌悬液和发酵液,这一结果与自然腐烂结果相似,进一步证明菌体胞外的上清液无抑菌活性,该菌株的主要抑菌物质为菌体细胞。
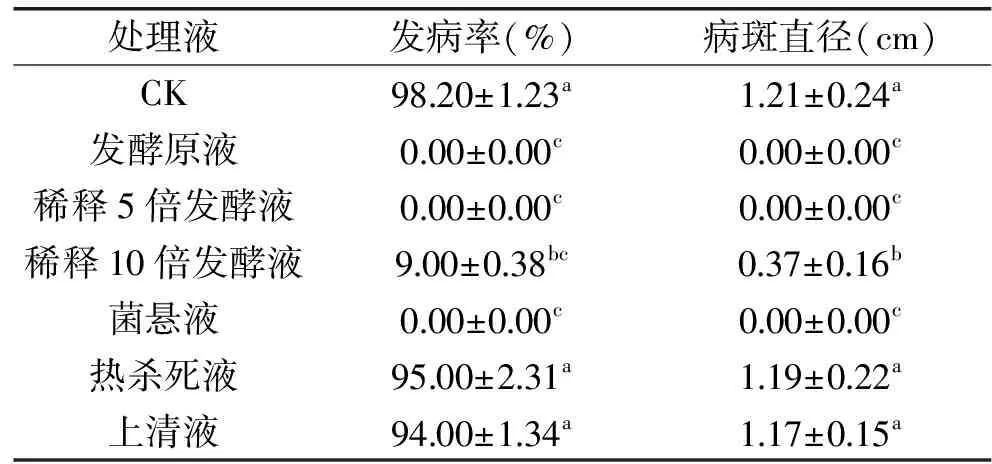
表1 生防菌不同处理液对草莓灰霉病的抑制Table 1 Inhibitory of different treatments of B. contaminans on Botrytis cinerea
2.5大鼠急性经口毒性实验
经口给药后,大鼠急性经口毒性实验结果见表2。根据急性经口毒性标准,当LD50>5000 mg/kg即杀死一半实验总体时的有毒物质的剂量>5000 mg/kg,可以不用在进行更高剂量的实验,基本可认为该物质是低毒物质,从表2中可以看出,雌、雄性大鼠经口 LD50>5000 mg/kg,且在2周的观察期内受试大鼠无死亡且无其他异常,因此,可认为该生防菌属于低毒物质。

表2 大鼠急性经口毒性实验结果Table 2 Result of acute oral toxicity test on rats

表3 家兔皮肤刺激实验结果Table 3 Result of stimulation on the skin of rabbits
注:刺激强度分级:0~0.4无刺激性,0.5~1.9轻度刺激性,2.0~5.9中等刺激性,6.0~8.0强刺激性。

表4 眼刺激(不冲洗)实验结果Table 4 Result of stimulation on the eyes(no wash)
注:I.A.O.I为0~5,M.I.O.I 48 h后为0为无刺激性;I.A.O.I为5~15,M.I.O.I 48 h后<5为轻度刺激性;I.A.O.I为15~30,M.I.O.I 96 h后小于5为轻度至中等刺激性;I.A.O.I为30~60,M.I.O.I 168 h后小于20为中度刺激性;I.A.O.I为60-80,M.I.O.I 168 h后小于40为中度至重度刺激性;I.A.O.I为80~110为重度刺激性。
2.6家兔皮肤刺激实验
家兔皮肤刺激实验结果见表3,根据皮肤刺激标准评分结果显示,该生防菌没有造成家兔皮肤产生红斑及水肿,经皮肤刺激实验72 h时,家兔皮肤刺激强度仍为无刺激性,因此可判断该生防菌不会对皮肤产生刺激反应。则家兔皮肤刺激实验结果为无刺激性。
2.7家兔眼刺激实验
给药后不洗眼,家兔眼刺激实验结果如表4,从表中可看出,再受药处理后的1、24、48、72、96、168 h时,该生防菌对眼结膜、虹膜和角膜刺激分数均为0,即眼刺激积分指数(I.A.O.I)为0,停止受药后,观察48 h后眼睛损伤恢复情况,眼刺激平均指数(M.I.O.I)48 h为0。实验表明,家兔眼刺激实验不冲洗实验结果为无刺激性。
2.8豚鼠皮肤变态反应(致敏)实验
表5为豚鼠皮肤致敏实验结果。实验期间,阳性对照(2,4-二硝基氯苯)组动物皮肤均出现不同程度的红斑和水肿,皮肤粗糙等;实验组动物皮肤均无红肿,其致敏率为0%,致敏强度I级,属弱致敏物。

表5 豚鼠皮肤致敏实验结果Table 5 Results of dermal allergy reaction on guinea pigs
注:致敏率0~8,致敏强度为Ⅰ级,属于弱致敏物;致敏率9~28,致敏强度为Ⅱ级,属于轻度致敏物;致敏率29~64,致敏强度为Ⅲ,属于中度致敏物;致敏率65~80,致敏强度为Ⅳ级,属于强度致敏物;致敏率81~100,致敏强度Ⅴ级,属于极强度致敏物。
3 结论
伯克氏菌可产生硝吡咯菌素、吩嗪、苯基吡咯、Cepaciamide A、Cepacidine A等多种次生代谢物质,在农业领域中具有生物防治、生物降解以及促进植物生长等多种功能,有广泛应用前景[20-21]。目前已有伯克氏菌用于果实采后相关的报道,范青[22]发现伯克氏菌对甜樱桃果实采后褐腐病表现显著的抑制作用;该菌株可提高果实抗性相关酶POD、SOD、CAT、PPO、PAL等的活性[11]。本次实验的研究表明,生防菌洋葱伯克氏菌B.contaminans可以有效抑制草莓采后病害发生,且24 h发酵液的抑制效果最好。无论是自然腐烂,还是伤口接种,与CK比较均具有显著性的抑制效果。在不同处理液中,菌悬液抑制效果显著,上清液无抑菌性。这为我们研究抑菌机理,提取抑菌活性物质提供了基础理论依据。
Vanlaere[23]认为洋葱伯克霍尔德氏菌种内分为9个基因型,2008年Vanlaere[24]又分出Burkholderiaubonensis和另外5个新种,2009年Elke Vanlaere[25]又分出两个新的基因型Burkholderiacontaminans和Burkholderialata,至此洋葱伯克霍尔德氏菌复合群共包括17个其因型。文献报道[26-27],对人体有致病性的基因型主要是基因型Ⅱ(B.multivorans)、基因型Ⅲ(B.cenocepacia)。本实验中发现BurkholderiacontaminansB-1在动物急性经口毒性实验,皮肤和眼刺激实验及皮肤致敏性实验中,没有毒性,且对皮肤和眼睛没有刺激性,对皮肤也没有致敏性,说明该基因型菌株作为生防菌的人体安全性,具有进一步开发和应用价值。
[1]Yang S,Yang S Y,Zhang C P,et al. Population dynamics of Myzus persicae on tobacco in Yunnan Province,China,before and after augmentative releases ofAphiduisgifuensis[J]. Biocontrol Science and Technology,2009,19(2):219-228.
[2]张旭,尚楠,张宝,等. 抗瓜果腐霉芽孢杆菌优良菌株的筛选及生物学特性[J]. 食品科学,2012,33(5):138-143.
[3]Coenye T,Vandamme P,Govan J R W,et al. Taxonomy and identification of theBurkholderiacepaciacomplex[J]. Journal of Clinical Microbiology,2001,39(10):3427-3436.
[4]Poupin M J,Timmermann T,Vega A,et al. Effects of the plant growth bacterium Burkholderia phytofirmans PsJN throughout the life cycle of Arabidopsis thaliana[J]. PLos One,2013,8(7):e69435.
[5]Johnson S L,Bishop-Lilly K A,LADNER J T,et al. Complete genome sequences for 59 burkholderia isolates,both pathogenic and near neighbor[J]. Genome Announcements,2015,3(2):e00159-15.
[6]Seo Y S,Lim J Y,Park J,et al. Comparative genome analysis of rice-pathogenic Burkholderia provides insight into capacity to adapt to different environments and hosts[J]. BMC Cenomics,2015,16(1):349.
[7]Coenye T,Vandamme P. Diversity and significance of Burkholderia species occupying diverse ecological niches[J]. Environmental Microbiology,2003,5(9):719-729.
[8]De S B,Mayo M,Peeters C,et al. Burkholderia stagnalis sp. nov. and Burkholderia territorii sp. nov. two novelBurkholderiacepaciacomplex species from environment and human sources[J].International Journal of Systematic and Evolutionary Microbiology,2015,65(7):2265-2271.
[9]Parke J L,Guriansherman D. Diversity of theBurkholderiacepaciacomplex and implications for risk assessment of biological control strains[J]. Annual Review of Phytopathology,2001,39(1):225-258.
[10]Costa D,Erabadupitiya H. An integrated method to control postharvest diseases of banana using a member of theBurkholderiacepaciacomplex[J]. Postharvest Biology & Technology,2005,36(1):31-39.
[11]范三红,李静,施俊凤. 拮抗菌Burkholderiacontaminans对玫瑰香葡萄采后灰霉病的抗性诱导[J]. 食品科学,2016,37(2):266-270.
[12]Ki H K,Kim S H,Han S W,et al. A case of native valve endocarditis caused byBurkholderiacepaciawithout predisposing factors[J]. BMC Infectious Diseases,2011,11(1):1-4.
[13]徐成良. 洋葱伯克霍尔德菌的耐药性分析[J]. 上海预防医学,2016(7):484-485.
[14]胡娟,樵星芳,韦莉,等. 饮水中洋葱伯克霍尔德菌的分离鉴定及消毒剂灭活实验[J]. 环境工程,2016,(S1):6-8.
[15]Lynch K H,Deenis J J. LCangene gold medal award lecture-Genomic analysis and modification ofBurkholderiacepaciacomplex bacteriophages[J]. Canadian Journal of Microbiology,2012,58(3):221-235.
[16]Holden M,Sethsmith H,Crossman L,et al. The genome of Burkholderia cenocepacia J2315,an epidemic pathogen of cystic fibrosis patients[J]. Journal of Bacteriology,2009,191(1):261-277.
[17]李静. 伯克霍尔德氏菌BurkholderiacontaminansB-1对玫瑰香葡萄采后病害生防潜力研究[D]. 太原:山西大学,2016.
[18]赵妍. 拮抗酵母及结合热空气处理对樱桃番茄采后病害的防治及其机理研究[D].南京:南京农业大学,2010.
[19]中华人民共和国农业部. GB 15670-1995中华人民共和国国家标准农药登记毒理学实验方法[S]. 北京:中国标准出版社,1995.
[20]韩超,武贵元,刘爱新,等. 吡咯伯克霍尔德氏菌A12筛选鉴定及其对烟草幼苗的促生作用[J]. 浙江农业学报,2012,24(5):880-885.
[21]Van V T,Berge O,Ke S N,et al. Repeated beneficial effects of rice inoculation with a strain of Burkholderia vietnamiensis on early and late yield component in low feitility sulphate acid soils of Vietnam[J]. Plant and Soil,2012,218(1):273-284.
[22]范青,田世平,姜爱丽,等. 采摘后果实病害生物防治拮抗菌的筛选和分离[J]. 中国环境科学,2001,21(4):313-316.
[23]Vandamme P,Holmes B,Coenye T,et al. Burkholderia cenocepacia sp. nov.-a new twist to an old story[J]. Research in Microbiology,2003,154(2):91-96.
[24]Vanlaere E,Lipuma J J,Baldwin A,et al. Burkholderia latens sp. nov.,Burkholderia diffusa sp. nov.,Burkholderia arboris sp. nov.,Burkholderia seminalis sp. nov. and Burkholderia metallica sp. nov.,novel species within the Burkholderia cepacia complex[J]. International Journal of Systematic and Evolutionary Microbiology,2008,58(7):1580-1590.
[25]Vanlaere E,Baldwin A,Gevers D,et al. Taxon K,a complex within theBurkholderiacepaciacomplex,comprises at least two novel species,Burkholderiacontaminanssp. nov. andBurkholderialatasp. nov[J]. International Journal of Systematic and Evolutionary Microbiology,2009,59(1):102-111.
[26]张立新,苏婷,谢关林. 洋葱伯克氏菌群不同基因型菌株对几种重要植物病原真菌的抑制作用及其潜在致病性[J]. 中国生物防治,2009,25(1):25-29.
[27]Ramos C G,Sousa S A,Grilo A M,et al. The Burkholderia cenocepacia K56-2 pleiotropic regulator Pbr,is required for stress resistance and virulence[J]. Microbial Pathogenesis,2010,48(5):168-177.
