毛细管电泳电化学发光法快速分离检测水果中的精胺
2018-01-22,,2,*
,,2,*
(1.陕西理工大学生物科学与工程学院,陕西汉中 723001;2.陕西理工大学陕西省资源生物重点实验室,陕西汉中 723001)
我国的季节性水果很多,如桑椹、草莓等浆果,柔软多汁,表皮极薄,在采摘和运输过程中极易受到损害,不耐贮运和贮藏,货架期极短。桑椹在常温条件下仅能保鲜12~18 h[1],草莓在常温下放置1~2 d就会出现变色、变味、软化腐烂[2],大大降低其商品性,造成严重的经济损失;还有极易氧化的水果,如苹果,它的果肉裸露在空气中2~3 min就会发生褐变。因此,桑椹、草莓等浆果的贮藏保鲜和苹果的延缓氧化一直以来都是科学研究的热点和难点。所以,为了延长水果的食用和加工供货期,研究其保鲜技术显得尤为重要。
精胺(SPM)是多胺的一种,带有两个或两个以上氨基的脂肪族化合物,具有一定的生物活性,少量精胺是生物体内正常存在的成分,在生物细胞中具有重要的生理功能。精胺在生物体中广泛存在,朱新卫[3]等研究指出,精胺能延缓赛买提杏的果实硬度和可溶性固形物含量的下降,降低腐烂率,有效提高其贮藏品质。张政[4]等研究也指出,精胺能够显著延缓鲜枣果实的衰老,提高果实冷藏期间的贮藏品质。刘春泉[5]等以蔬菜大豆为实验对象,研究了外源精胺对其冷害、采后保鲜的机制,结果显示精胺能有效延缓蔬菜大豆的贮藏冷害。由此可见,果蔬中精胺的含量对其贮后品质具有重要的研究意义。因此,发展一种更为简便、快速、灵敏且适于痕量检测的方法十分必要。
目前,多胺的分析方法主要是高效液相色谱法(HPLC)[6-7]、超高效液相色谱法UPLC[8-10],国家标准方法[11]的衍生过程耗时,检出限偏高,操作繁杂。此外,还有电化学传感技术[12]、毛细管电色谱-激光诱导荧光检测法[13],这两种技术都具备检测范围宽、检出限低、灵敏度高的优点,但实验过程繁琐。毛细管电泳是继传统电泳和色谱方法发展而来的一种分离技术,具有分离速率高、分析时间短、样品消耗痕量等优点。含氮基团能够与钌联吡啶发生化学反应,产生光信号,且钌联吡啶电化学发光技术灵敏度高、分析控制性强、操作简单、成本低。基于此,本文通过优化毛细管电泳和检测条件,建立了精胺的毛细管电泳电化学发光技术分析方法,并将该方法应用于草莓、桑椹、苹果等水果中精胺的检测。文中首次将CE-ECL检测技术应用于水果中精胺的分析,对研究水果采后保鲜贮藏和延长货架期,具有重大的意义。
1 材料与方法
1.1材料与仪器
桑椹、草莓、苹果(一等级鲜果质量要求,食用成熟度)[14-16]陕西理工大学北门水果市场;钌联吡啶 Ru(bpy)3Cl2·6H2O,99.95%,美国Sigma-Aldrich公司;精胺标准品98% 百灵威科技有限公司;其他试剂 均为分析纯;实验用水 二级蒸馏水。
MPI-B型多参数化学发光分析系统(该检测仪器主要包括数控毛细管电泳高压电源、电化学分析仪、多功能化学发光检测仪和多功能化学发光检测器) 西安瑞迈分析仪器有限公司生产,中国科学院长春应用化学研究所研发;KQ 5200 DE型数控超声波清洗器 昆山市超声仪器有限公司;TGL-20M离心机 湖南赛特湘仪离心机仪器有限公司;EL20实验室pH计 梅特勒-托利多仪器上海有限公司;Millipore超纯水机 美国,Millipore公司;AL 204电子天平 梅特勒-托利多仪器有限公司;未涂层的熔融石英毛细管(50 cm×25 μm i.d.),CE及ECL检测采用三电极系统:工作电极是直径500 μm的铂丝电极,参比电极是直径300 μm的Ag/AgCl电极(饱和KCl溶液),辅助电极为直径1 mm的铂电极 西安瑞迈分析仪器有限公司;0.22 μm的尼龙纤维素膜 津隆。
1.2实验方法
1.2.1 标准溶液的配制 精胺标准溶液:准确称取0.010 g精胺,然后加水稀释到10 mL,摇匀,用0.22 μm滤膜过滤,置于4 ℃冰箱中密封冷藏备用。
1.2.2 样品前处理 取足量桑椹、草莓、苹果等样品,分别将其在预冷研钵中捣碎,准确称取三种样品各1.000 g加入到50 mL离心管中,加入10 mL 0.1 mol/L HCl,搅拌提取25 min,4 ℃ 4000 r/min离心10 min,取上清液,用0.22 μm滤膜过滤,置于4 ℃冰箱中冷藏备用。
1.2.3 毛细管电泳电化学发光检测步骤 选取内径为25 μm×50 cm未涂层溶融石英毛细管。实验前对毛细管进行处理。首次使用毛细管前先用0.1 mol/L NaOH溶液浸泡12 h进行活化,每天实验前需依次用0.1 mol/L NaOH、超纯水压力冲洗10 min,再用分离缓冲液平衡10 min以上。
工作电极为铂丝电极,长期使用2~3个月,当铂丝电极发黑以后,需用金相砂纸打磨后再用粒径0.05金相的氧化铝粉末在绒布上抛光平整,达到镜面效果,再使用超纯水超声清洗8 min,晾干后使用。参比电极为Ag/AgCl电极,当发现有沉淀时,需要及时更换。利用光学显微镜观察,使工作电极与毛细管出口对齐,并调整两者之间的距离为100 μm。

1.2.4 检测条件及毛细管电泳条件的优化
1.2.4.1 检测电位的优化 在1.2.3的基础上,考察检测电位在1.00~1.30 V范围内,ECL强度的变化趋势,实验条件为5 mmol/L的钌联吡啶(溶于pH7.8硼酸盐缓冲液),运行缓冲液为12 mmol/L的硼酸盐缓冲液(pH7.8),固定其他参数为系统默认值,以精胺标准溶液对检测电位进行优化。
1.2.4.2 检测池中缓冲液浓度和pH的优化 在1.2.3的基础上,结合优化的检测电位,其他参数不变的条件下,研究25~150 mmol/L硼酸盐缓冲液浓度对ECL强度的变化影响。固定检测池缓冲液的浓度为50 mmol/L,在pH7.4~8.7范围内考察硼酸盐缓冲液pH对ECL强度的影响。
1.2.4.3 运行缓冲液浓度和pH的优化 在1.2.3的基础上,结合优化的检测电位、检测池中缓冲液浓度和pH,控制硼酸盐缓冲液的pH为7.8,在浓度为4~24 mmol/L范围内研究其对ECL强度的影响;同时固定运行缓冲液的浓度为12 mmol/L,观察pH在7.4~9.0范围内的电化学发光强度变化。
1.2.4.4 运行高压、进样高压、进样时间的优化 在已优化的检测条件下,研究运行高压在9~19 kV内对样品迁移时间和分离的影响;进样高压在6~18 kV范围内、进样时间在2~16 s范围对ECL强度及理论塔板数的影响。理论塔板数通过半峰宽和迁移时间来进行计算,公式为:N=5.54(tm/Y1/2)2,其中N是待测样品的理论塔板数;tm是待测样品的迁移时间;Y1/2是待测样品的半峰宽。
1.2.5 线性关系 将1 mg/mL精胺标准溶液依次稀释为0.1、0.01、0.05、0.001 mg/mL,按照1.2.4中优化的检测条件和毛细管电泳条件进行电化学发光检测,记录其对应的ECL强度。以不同浓度精胺标准溶液为横坐标、ECL强度为纵坐标,绘制标准曲线,标准曲线用I=pc+q表示。
1.2.6 检出限 在信噪比约为3时计算检出限。
1.2.7 精密度 对0.14 mmol/L的精胺标准溶液连续进样7次,按照1.2.4中的优化条件进样,计算其迁移时间、峰高、峰面积的相对标准偏差(RSD)。
1.2.8 样品测定 按照1.2.2中的方法制备样品,按照1.2.4中的优化条件进样,分别测定桑椹、草莓、苹果3种样品。
1.2.9 回收率实验 分别取待测样适量,平均分成3份,将0.03、0.06、0.14 mmol/L三个标准品溶液精密加入到待测样品中(平行三份),按1.2.4中检测条件进行分析,计算回收率和RSD。
1.3数据统计分析
所有实验重复3次,数据计算均在Microsoft Excel 2010中完成。
2 结果与分析
2.1检测条件及毛细管电泳条件的优化
2.1.1 检测电位的优化 检测电位是影响发光信号强度的一个决定性因素之一。实验中采用恒电位法研究检测电位对精胺电化学发光信号的影响。结果如图1所示,在1.00~1.10 V之间,ECL强度随着检测电位的增大而呈直线上升,在1.10~1.20 V之间,光强度的增长趋势减缓,但是出现基线上扬,信噪比差,之后,继续增加检测电位,光强反而减小。因此,结合ECL强度和检测基线,以1.15 V作为本实验的最优检测电位。

图1 检测电位对ECL强度的影响Fig.1 Effect of detection potential on the ECL intensity
2.1.2 检测池中缓冲液浓度和pH的优化 检测池中溶解钌联吡啶的硼酸盐缓冲液浓度和pH对ECL强度有一定的影响。如图2(a)所示,在50 mmol/L硼酸盐缓冲液下,精胺有满意的发光强度和信噪比。

图2 检测池中浓度(a)和pH(b)对ECL强度的影响Fig.2 Effect of pH(b)and concentration(a)in detection cell on ECL intensity
2.1.3 运行缓冲液浓度和pH的优化 运行缓冲液的浓度能通过影响毛细管壁对样品的吸附能力而影响分离效果,运行缓冲液的pH能通过影响毛细管内部的电渗流而影响样品的迁移时间。如图3(a),当缓冲液的浓度为12 mmol/L时,ECL强度达到最大。而当运行缓冲液的 pH在7.8 时ECL强度明显较高(如图3(b))。故选择pH7.8,浓度为12 mmol/L的硼酸盐缓冲液。

图3 运行缓冲液浓度(a)和pH(b)对ECL强度的影响Fig.3 Effect of running buffer pH(b)and running concentration(a)on the intensity of ECL
2.1.4 运行高压、进样高压、进样时间的优化 运行高压主要影响样品的迁移时间和分离效率。在运行高压9~19 kV范围内变化时,迁移时间从370.8 s降到185.6 s,变化范围很大。本实验研究了运行高压对样品迁移时间和分离的影响,结果如图4所示,在9~15 kV范围内,ECL强度随着运行高压的升高呈直线递增,当运行高压为17 kV时,发光强度明显下降,这是由于运行高压过大,毛细管产生焦耳热,样品在极短的时间内由毛细管进入检测池,使得各电极表面钌联吡啶浓度稀释,发光效率降低。故综合考虑迁移时间、分离效率、灵敏度、噪音和焦耳热等因素,确定最佳运行高压为15 kV。
进样高压和进样时间决定着样品进样量的大小,进而影响电化学发光强度和分离效率。精胺的分离效率通过理论塔板数得来。精胺进样方式采用的是电动进样,在已优化的检测条件下,如图5(A)所示,随着进样高压的递增,ECL强度也呈上升趋势,而理论塔板数则一直下降,同时在运行高压为14 kV时出现峰展宽严重,柱效降低,且在18 kV出现严重的基线上扬。所以选择14 kV作为最佳进样高压。图5(B)中随着进样时间的增大,ECL强度增大,理论塔板数减小,迁移时间延后,精胺的峰形变宽。所以,选择最佳进样时间为8 s。

图4 运行高压对ECL强度(a)和迁移时间(b)的影响Fig.4 Effect of running voltage on the intensity and migration time of ECL
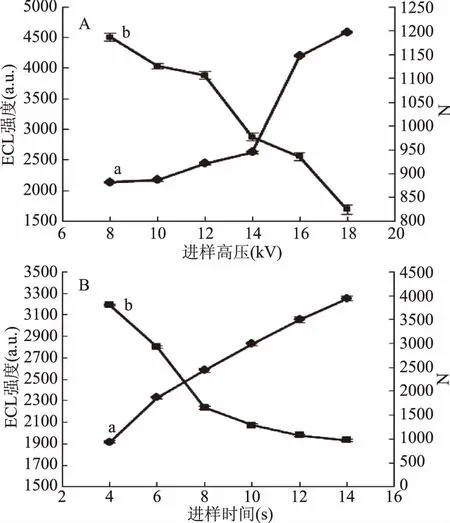
图5 进样高压(A)和进样时间(B)对ECL强度(a)及理论塔板数(b)的影响Fig.5 Effect of injection voltage(A)and injection time(B) on the intensity(a)and plate number(b)of ECL
2.2线性范围、检出限、精密度
精胺标准溶液在2×10-4~3×10-1mmol/L浓度范围内与ECL强度呈良好的线性关系,其线性方程为I=1114.2c+99.41(r=0.9996),检出限(S/N=3)为9.9×10-5mmol/L。
对0.14 mmol/L的精胺标准溶液进行7次检测,得到其迁移时间、峰高、峰面积的相对标准偏差(RSD)分别为0.7%、3.5%、2.7%,表明该仪器的精密度良好[18]。
2.3样品测定和加标回收率
如图6所示为未加标待测样品与加标后样品的毛细管电泳电化学发光对照图,可发现加标后的ECL强度明显高于未加标的待测样。表1为3种样品中精胺含量及其加标回收率。

图6 样品待测液未加标(A、C、E)与加标0.14 mmol/L(B、D、F)的CE-ECL图Fig.6 Electropherograms of aquatic product samples(A、C、E) and added 0.14 mmol/L standard samples(B、D、F)
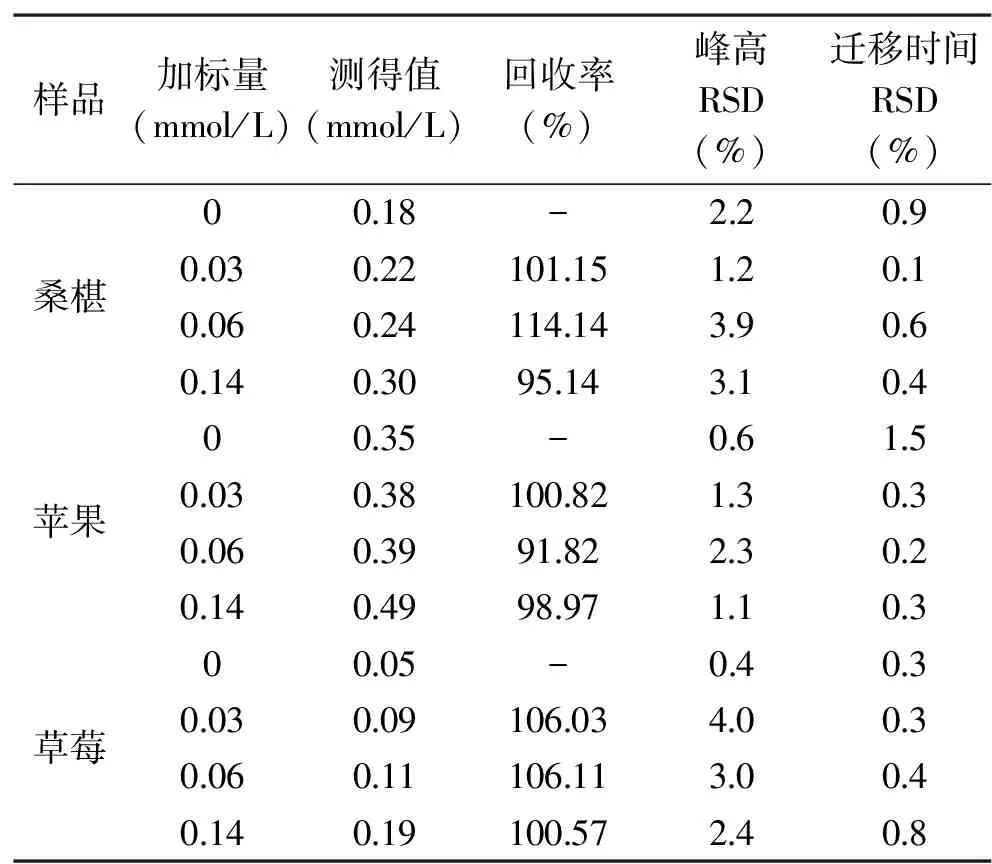
表1 3种样品中精胺含量及其加标回收率Table 1 Spermine content and the recovery adding standard in three kinds of samples
3 结论
本文建立了一种用毛细管电泳电化学发光分离检测水果中精胺含量的新方法,并对影响分离检测精胺的各影响因素进行了研究。结果表明:在最佳的实验条件下,该方法的最低检出限(S/N=3)可达9.9×10-5mmol/L,线性范围2×10-4~3×10-1mmol/L,线性相关系数r=0.9996,在6 min内即可完成分离检测。该方法用于检测精胺具有操作简便,检测快速,灵敏度高,样品消耗少,以及重现性良好和成本低等优势,为其他多胺的检测提供了实验基础,且对今后研究果蔬采后保鲜贮藏和延长货架期提供了理论依据。
[1]Chen Zhao,Zhu Chuanhe,Han Ziqiang. Effects of aqueous chlorine dioxide treatment on nutritional components and shelf-life of mulberry fruit(MorusalbaL.)[J]. Journal of Bioscience and Bioengineering,2011,111(6):675-681.
[2]聂青玉,刘丹,王燕飞,等. 壳寡糖处理对草莓贮藏品质的影响[J]. 农产品加工(创新版),2010(7):31-33.
[3]朱新卫,张辉,潘俨,等.精胺处理对新疆赛买提杏冷藏品质的影响[J].保鲜与加工,2014,14(5):20-23,30.
[4]张政,王倩,吴斌,等.外源精胺对哈密大枣冷藏期间贮藏
特性的影响[J].食品研究与开发,2016,14(37):163-167.
[5]刘春泉,宋江峰,王远,等.外源精胺对菜用大豆贮藏冷害及蔗糖代谢的影响[J].中国农业科学,2015,48(8):1588-1596.
[6]MR Rui,IM Valente,JA Rodrigues. Analysis of biogenic amines in wines by salting-out assisted liquid-liquid extraction and high-performance liquid chromatography with fluorimetric detection[J]. Talanta,2014,124(124):146.
[7]郑晓菊,许泳吉,刘云云,等.高效液相色谱法测定贝壳类海洋生物中的多胺含量[J].青岛科技大学学报自然科学版,2014,35(5):446-450.
[8]林绍艳,张芳,徐颖洁.植物中多胺含量超高效液相色谱法的建立[J].南京农业大学学报,2016,39(3):358-365.
[9]曾立威,蔡翔宇,吴玉杰,等.超高效液相色谱法同时快速测定多种动物源食品中 9 种生物胺的含量[J].食品安全质量检测学报,2017,8(3):968-074.
[10]BD Rio,B Redruello,DM Linares,et al. The dietary biogenic amines tyramine and histamine show synergistic toxicity towards intestinal cells in culture[J]. Food Chemistry,2017,218:249-255.
[11]食品中多胺的测定[S]. GB 5009.208-2016.
[12]姜随意,吴业宾,王浩,等. 用于组胺检测的新型电化学传感技术研究[J].食品研究与开发,2017,4(38):113-118.
[13]张冰宇,蔡晓蓉,尹艳艳,等.毛细管电色谱-激光诱导荧光检测法分析食品中的生物胺[J].色谱,2017,35(3):345-350.
[14]鲜苹果[S]. GB/T 10651-2008.
[15]草莓等级规格[S]. NY/T 17889-2009.
[16]桑椹(桑果)[S]. GB/T 29572-2013.
[17]Hu Lianzhe,Xu Guobao. Applications and trends in electrochemiluminescence[J]. Chemical Society Reviews,2010,39:3275-3304.
[18]寿林均,程巧鸳,黄柳倩,等. 高效液相色谱法测定益之康胶囊中总蒽酮(大黄素和大黄素甲醚)的含量[J].食品工业科技,2017(7):252-256,267.
