响应面法优化海鲜菇中多糖提取工艺
2018-01-22,,,,,,
, ,,,,,
(1.北京农业职业学院,北京 102442;2.中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193;3.黑龙江省农业科学院畜牧研究所,黑龙江哈尔滨 150086)
海鲜菇(Hypsizygusmarmoreus)又名真姬菇、白玉菇,因其味道鲜美,营养丰富,具有提高免疫力、降血脂、抗氧化、抗衰老、抗过敏等功效而闻名国内外[1,2]。研究表明,海鲜菇抗氧化活性与多糖含量及结构特性密切相关[3]。聂莹[4]研究发现真姬菇多糖具有一定的还原能力和Fe2+螯合能力。目前关于海鲜菇多糖的提取方法较多,如贺江[5]和覃逸明[6]分别采用超声波和微波法提取真姬菇多糖,多糖得率分别为5.68%和2.86%。每种提取方法各有优缺点,如石堃[7]报道了榆黄蘑子实体多糖的热水浸提法工艺条件温和,多糖得率较高,为8.422%。梁涛等[8]用稀碱溶液处理杏鲍菇子实体,得到易溶于水、不溶于乙醇的浅黄色海绵状多糖。该方法提取后需要迅速中和或透析,并且可能伴随生成色素、生物活性遭到破坏。邹东恢等[9]采用复合酶处理平菇子实体时,发现该方法具有提取条件温和、时间短、回收率高、节省能源、避免高温对多糖成分的破坏等优点。但酶价格一般较昂贵,且易失活,对提取设备要求较高,目前仅适用于实验室或小规模提取。因此,酶法提取多糖目前推广应用起来还有一定的困难。超声波及微波辅助提取法在促进食用菌多糖物质的释放、提高提取率方面具有较好的效果,但热稳定性差的多糖会遭到超声波和微波破坏其结构和生物活性方可使用,因此,其应用范围受到一定限制[10]。热水浸提法成本低、环境污染少、多糖提取率高、多糖破坏性小,是一种不可多得的提取方法。
为了提高多糖得率,保证多糖原有的结构特点,同时提高海鲜菇的残菇的利用率,提高经济效益,本文以热水浸提法提取海鲜菇的残菇中多糖,通过单因素及响应面分析,建立多糖预测模型,为今后海鲜菇化学结构特性及抗氧化活性的研究提供一定的基础。
1 材料与方法
1.1材料与仪器
海鲜菇的残菇(海鲜菇的残菇为生长120~130 d的产品,该产品经过分离、分割、60 ℃烘干后粉碎过100目筛,并贮藏于干燥器中备用) 北京市菌类生产基地;苯酚,浓硫酸、乙醇及其他药品(分析纯) 北京北化试剂公司。
T6新世纪紫外可见分光光度计 北京普析通用仪器有限公司;3-18K超低温台式离心机 德国Sigma公司。
1.2实验方法
1.2.1 海鲜菇多糖的提取 海鲜菇粉→浸提→离心→浓缩上清液→醇沉多糖→测定
1.2.1.1 浸提 称取1.0 g 样品,在不同条件下进行多糖提取,经过前期优化,浸提次数为3次;
1.2.1.2 离心 将浸提液在8000 r/min下离心20 min,收集上清液;
1.2.1.3 浓缩上清液 将上清液真空浓缩至体积为20 mL左右,以便于后期处理;
1.2.1.4 醇沉多糖 以浓缩液的3倍体积的85%乙醇缓慢倒入浓缩液中,4 ℃下静置12 h,4000 r/min离心20 min,沉淀用85%乙醇洗涤5次,得沉淀;
1.2.1.5 多糖测定 沉淀复溶后用苯酚硫酸法测定多糖含量。
1.2.2 单因素实验设计
1.2.2.1 提取温度 在液料比为20∶1,提取时间为2.5 h的情况下,分别在60、70、80、90、100 ℃进行提取。
1.2.2.2 提取时间 在提取温度为90 ℃,液料比为20∶1的情况下,分别在1、1.5、2、2.5、3、3.5 h进行提取。
1.2.2.3 液料比 在提取温度为90 ℃,提取时间为2.5 h时,分别液料比按20∶1、30∶1、40∶1、50∶1、60∶1进行提取。
1.2.3 响应面优化 在单因素优化基础上,进行响应面优化实验,以提取温度、提取时间、液料比为考察因素,分别以X1,X2,X3表示,采用Design-Expert软件的B-B方法进行残菇中多糖提取的响应面实验设计(如表1所示)。
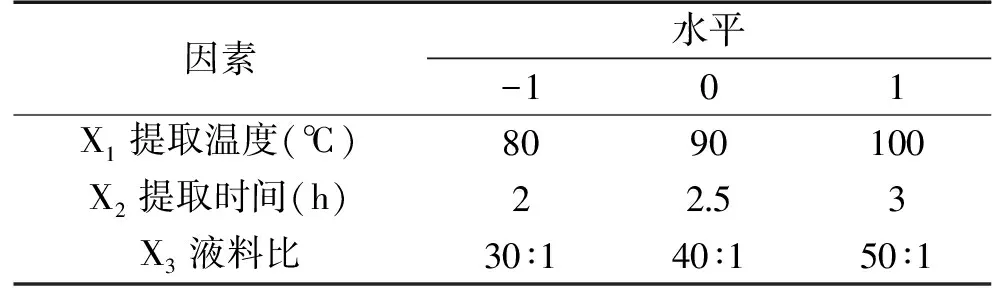
表1 响应面优化因素水平及编码Table1 Levels of Independent process variables used for response surface analysis
1.2.4 多糖含量的测定 参考GB/T 15672-2009方法进行,略有改动。取6支具塞试管,分别加入100 μg/mL葡萄糖标准液0、0.2、0.3、0.4、0.5、0.6 mL,各补加蒸馏水至1.0 mL,然后各加入5%苯酚溶液1.0 mL和5.0 mL浓H2SO4溶液,静置10 min,涡旋振荡器充分混合,30 ℃水浴中加热20 min,冷却至室温后于490 nm波长处测定吸光度值。以葡萄糖浓度μg/mL为横坐标,以吸光度为纵坐标,绘制标准曲线,标准曲线方程为Y=0.010X-0.005(R2=0.999)。
取上清液1.0 mL,然后各加入5%苯酚溶液1.0 mL和5.0 mL浓H2SO4溶液,静置10 min,涡旋振荡器充分混合,30 ℃水浴中加热20 min,冷却至室温后于490 nm波长处测定吸光度值,并在标准曲线上查得样品中多糖的浓度。
1.3数据分析方法
实验数据重复3次,实验数据用平均数±标准差表示。所有数据采用SPSS 18.0进行方差分析、显著性分析。响应面实验设计及分析采用Design 8.0软件。
2 结果与分析
2.1单因素实验
2.1.1 温度对多糖提取效果的影响 当液料比为20∶1,提取时间为2.5 h时,残菇中多糖得率随着浸提温度的升高而逐渐升高,当温度升高至90 ℃时,多糖得率达到最大值,当提取温度继续升高时,多糖得率略有降低趋势。分析其原因可能是随着提取温度的升高,多糖溶解度增大,提取率增加,当温度高于90 ℃时,温度过高,多糖分解而导致含量逐渐降低。
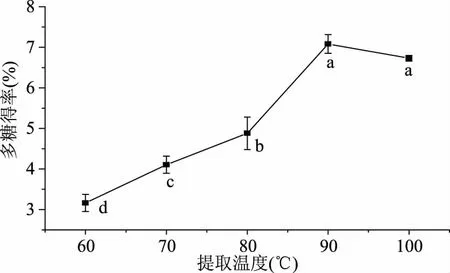
图1 温度对多糖提取效果的影响Fig.1 Effect of temperature on the extraction rate of Polysaccharides
2.1.2 时间对多糖提取效果的影响 当提取温度为90 ℃,液料比为20∶1时,随着浸提时间的延长,多糖得率逐渐增加,当提取时间为2.5 h时多糖得率达到最大值,随着提取时间的延长,多糖提取率没有显著的增加。随着浸提时间的延长,多糖溶解量逐渐增加,当提取时间增加至2.5 h时,多糖基本溶解出来,再增加提取时间,对提取效果没有显著的改善作用。
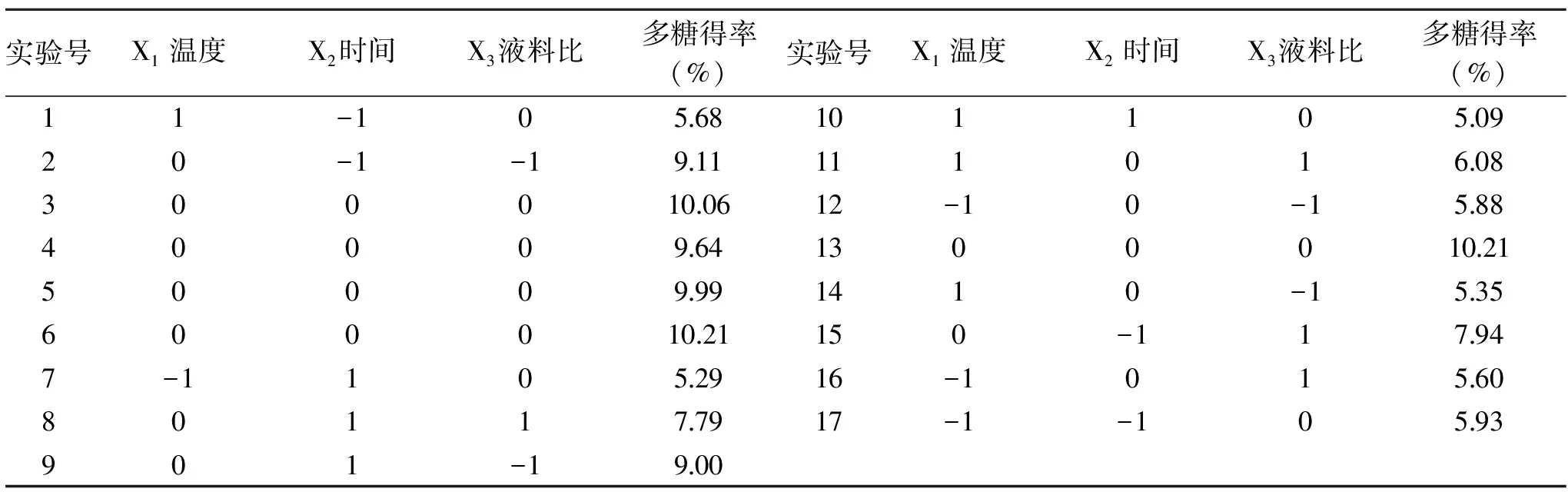
表2 响应面实验设计及结果Table 2 Experimental design and results for response surface analysis

图2 时间对多糖提取效果的影响Fig.2 Effect of time on the extraction rate of Polysaccharides
2.1.3 液料比对多糖提取效果的影响 在提取温度为90 ℃,提取时间为2.5 h时,多糖得率随着料液比的增加而逐渐增加,当料液比为1∶40 (g/mL)时,多糖得率达到一个相对稳定的数值,分析其原因可能是原料中多糖已经基本溶解出来,再增加液体的体积也对多糖得率没有显著的影响,考虑到后续浓缩处理及成本经济效益考虑,选取1∶40 (g/mL)的料液为宜。

图3 液料比对多糖提取效果的影响Fig.3 Effect of liquid-solid ratio on the extraction rate of Polysaccharides
2.2响应面法优化提取多糖
2.2.1 响应面实验设计与结果 基于单因素实验结果确定的最佳条件,以温度、时间、液料比三个因素为自变量,以多糖得率为响应值,共计17个实验点的回归旋转实验,实验设计与结果见表2。
2.2.2 回归方程方差分析及显著性检验 为了检验回归方程的有效性及各因素对多糖提取率的影响程度,对本数据的回归方程进行方差分析,结果如表3所示。
拟合回归方程为:
多糖得率(%)=-305.03125+6.41780X1+17.40250X2+0.28642X3+2.50000E-003X1X2+2.52500E-003X1X3-2.000000E-003X2X3-0.036285X12-3.58400X22-6.66000E-003X32

2.2.3 响应面影响因素的交互作用 提取温度(X1)和提取时间(X2)、提取温度(X1)和液料比(X3)、提取时间(X2)和液料比(X3)的交互作用的响应面和等高线分别如图4、图5和图6所示。

表3 实验结果方差分析表Table 3 Varianceanalysisof experimentation results

图4 提取温度和提取时间对多糖得率交互作用影响的响应面和等高线图Fig.4 Response surface plot and contour plot of extraction temperature and extraction time and their interactions on polysaccharide content

图5 提取温度和液料比对多糖得率交互作用影响的响应面和等高线图Fig.5 Response surface plot and contour plot of extraction temperature and liquid-solid ratio and their interactions on polysaccharide content

图6 提取时间和液料比对多糖得率交互作用影响的响应面和等高线图Fig.6 Response surface plot and contour plot of extraction time and liquid-solid ratio and their interactions on polysaccharide content
注:**表示p<0.01,极显著。
响应面坡度相对平缓表示两因素交互作用不显著,坡度相对较陡表示两因素交互作用显著;等高线的形状可反映出交互效应的强弱大小,等高线越密集,说明二者交互作用越显著,等高线越疏则相反,椭圆形表示两因素交互作用显著,而圆形则相反[11-13]。
图4可以看出,提取温度(X1)和提取时间(X2)的交互作用不显著,表现为曲面较为平缓,多糖得率的变化随着提取时间的变化小于提取温度的变化,说明在提取时间和提取温度两个因素中受提取温度的影响较大。由图5可以看出,提取温度和液料比之间的交互作用对多糖得率的影响不显著,表现为曲面较为光滑,多糖得率的变化随着提取料液比的变化小于提取温度的变化,说明在提取液料比和提取温度两个因素中受提取温度的影响较大。由图6可以看出,在提取时间和液料比之间的交互作用对多糖得率的影响不显著,表现为曲面较为光滑,多糖得率的变化随着提取液料比的变化小于提取时间的变化,说明在提取液料比和提取时间两个因素中受提取时间的影响较大。
综合以上分析,提取时间、提取温度和料液比三个因素之间交互作用不显著,这与表3结果相一致,所以实验结果是准确的。
2.2.4 最佳工艺参数确定及验证性实验 经过模型预测,最佳提取条件为提取温度89.85 ℃,提取时间为2.45 h,提取液料比为38.17∶1,多糖得率为10.0542%。为了检验响应面优化模型的准确性,在方便操作的基础上,调整验证工艺参数为提取温度90 ℃,提取时间为2.5 h,提取液料比为38∶1,提取残菇中的多糖以对本模型的验证,实验平行三次,多糖得率的平均值为10.01%±0.87%,该预测值与实际值差异0.40%,二者非常接近,说明回归模型建立的准确可靠,具有较好的实用价值。
3 结论
本文采用热水浸提法提取残菇中多糖,考察提取温度、提取时间及液料比3个因素对多糖得率的影响。通过单因素实验和响应面实验设计,影响多糖得率的主次因素排序为液料比>提取时间>提取温度。最终确定最佳提取工艺条件为提取温度90 ℃,提取时间为2.5 h,提取液料比为38∶1,多糖得率为10.01%。
[1]Chen P,Yong Y,Gu Y,et al. Comparison of antioxidant and antiproliferation activities of polysaccharides from eight species of medicinal mushrooms[J]. International Journal of Medicinal Mushrooms,2015,17(3):287-295.
[2]Tsai P F,Ma C Y,Wu J S. A novel glycoprotein from mushroom Hypsizygusmarmoreus(Peck)Bigelow with growth inhibitory effect against human leukemic U937 cells[J]. Food Chemistry,2013,141(2):1252-1258.
[3]Bolormaa Z,Kang M G,Seo G S,et al. Analysis of nutritional characteristics and physiological functionality of Hypsizygusmarmoreus(Brown cultivar)[J]. The Korean Journal of Mycology,2012,40(2):104-108.
[4]聂莹,李淑英,丁洋,等.真姬菇子实体多糖结构特性及抗氧化活性研究[J].中国食品学报,2016,16(11):55-61.
[5]贺江,向球,蔡翠玲,等.真姬菇多糖超声波辅助提取工艺及抗氧化活性研究[J].江苏农业科学,2014,42(4):232-234.
[6]覃逸明. 微波法提取真姬菇多糖工艺研究[J].中成药,2009,31(7):1134-1136.
[7]石堃,王再明,潘玲玲,等. 榆黄蘑多糖的提取及其抗氧化活性研究[J].林业科技,2015,40(3):34-36.
[8]梁涛,张静,张力妮,等.碱提杏鲍菇多糖PEAP-1的结构初探及形貌观察[J].食品与生物技术学报,2013,32(9):51-56.
[9]邹东恢,郭建华.多酶法提取平菇多糖工艺及光谱研究[J].江苏农业科学,2013,41(12):293-295.
[10]郭天力,严晓娟,胡先望,等.真菌多糖研究进展[J].现代生物医学进展,2013,13(18):3578-3583.
[11]Doblado-Maldonado A F,Janssen F,Gomand S V,et al. A response surface analysis of the aqueous leaching of amylose from maize starch[J]. Food Hydrocolloids,2017,63:265-272.
[12]Manwar J V ,Vispute S S,Kumbhar D D,et al. Response surface based optimization of system variables for liquid chromatographic analysis of candesartan cilexetil[J]. Journal of Taibah University for Science,2017,11:159-172.
[13]Derrien M,Badr A,Gosselin A,et al. Optimization of a green process for the extraction of lutein and chlorophyll from spinach by-products response surface methodology(RSM)[J]. LWT-Food Science and Technology,2017,79:170-177.
