气相色谱-质谱法测定陈皮及其制品中的三氯杀螨醇和拟除虫菊酯残留量
2018-01-22彭晓俊伍长春梁伟华梁优珍
彭晓俊,伍长春,梁伟华,梁优珍
(新会出入境检验检疫局,江门529100)
陈皮为芸香科植物橘及其栽培变种的干燥成熟果皮,陈皮有广陈皮、川陈皮、福建陈皮等,以广陈皮为上品,广陈皮中以新会陈皮为正品。陈皮为柑橘的果皮,入药已有700多年历史,而经年陈藏的陈皮更是珍品,因此有“百年陈皮胜黄金”和“千年人参,百年陈皮”的说法。植食性螨类是危害柑橘的主要害虫之一,使用杀螨剂是防治螨害的主要手段[1],而三氯杀螨醇是目前柑橘种植中使用最普遍的杀螨剂。拟除虫菊酯类农药与天然除虫菊酯的化学结构相似,具有高效、广谱、低毒、低残留等特点,拟除虫菊酯类农药在我国使用广泛[2-3]。因此,制定陈皮及其制品中三氯杀螨醇和拟除虫菊酯类农药残留的分析方法,具有积极的作用。
目前,农产品中杀螨剂和拟除虫菊酯农药残留的测定方法常用气相色谱-电子捕获检测器(GCECD)或气相色谱-质谱法(GC-MS)[4-10]。电子捕获检测器(ECD)为高灵敏度检测器,对电负性物质响应灵敏,而陈皮中含有挥发油、黄酮化合物、有机酸等化学成分和大量色素、脂肪、糖等生化成分,而且样品前处理方法操作繁琐,GC-ECD干扰较大,定性定量不准确。多壁碳纳米管(MWNTs)准一维中空管结构加之很高的比表面积,使其在吸附方面具有优异的性能[11]。文献[12-13]报道多壁碳纳米管用于痕量组分样品前处理中的富集与净化,但未处理的MWNTs会团聚成致密的网络,并且由于表面缺少官能基团,影响其应用。
本工作通过对MWNTs进行衍生化化学修饰,用强氧化性酸对MWNTs进行酸处理,使其表面产生一定量的羟基、羧基等活性官能基团,利用改性MWNTs为净化剂,建立了测定陈皮及其制品中三氯杀螨醇和拟除虫菊酯类农药残留量的气相色谱-质谱法,可为陈皮及其制品的食品安全监督提供可靠的检测手段。
1 试验部分
1.1 仪器与试剂
QP 2010Ultar型气相色谱-质谱联用仪,配AOC-20si自动进样系统;H-800-1型透射电子显微镜;Nexus 670型傅里叶变换红外光谱扫描仪;KQ 2200DB型超声振荡器;DZF-6050型真空干燥机;2-16型通用台式高速离心机;LAB DANCER型涡旋混合器;DN-12W型氮吹仪;Milli-Q型超纯水系统;0.22μm聚四氟乙烯微孔滤膜。
三氯杀螨醇、联苯菊酯、甲氰菊酯、三氟氯氰菊酯、氯菊酯、氯氰菊酯、氟氰戊菊酯、氰戊菊酯、溴氰菊酯等9种农药标准储备溶液:100mg·L-1。
MWNTs净化剂(纯度大于95%,直径10~20nm,长度300~800nm),Florisil净化剂(0.15~0.18mm),N-丙基乙二胺(PSA)净化剂(平均粒度45μm,孔 体 积 0.8m3·g-1),硅 胶 (0.15~0.25mm)。
正己烷、乙腈、乙酸乙酯为色谱纯;硫酸、硝酸为分析纯;试验用水为超纯水。
1.2 仪器工作条件
1)色谱条件 Rtx-1701毛细管色谱柱(30m×0.25mm,0.25μm);载气为高纯氦气(纯度大于99.999%);进样口温度275℃;进样量1μL;流量1.0mL·mL-1;不分流进样。柱升温程序:初始温度50℃,保持1min;以15℃·mL-1速率升温至200℃,保持8min;再以5℃·mL-1速率升温至275℃,保持12min。
2)质谱条件 接口温度275℃;电子轰击离子源,离子源温度200℃;电子轰击能70eV;溶剂延迟15.5min;采集方式为选择离子监测(SIM)模式;扫描间隔时间0.3s。其他质谱参数见表1。

表1 质谱参数Tab.1 MS parameters
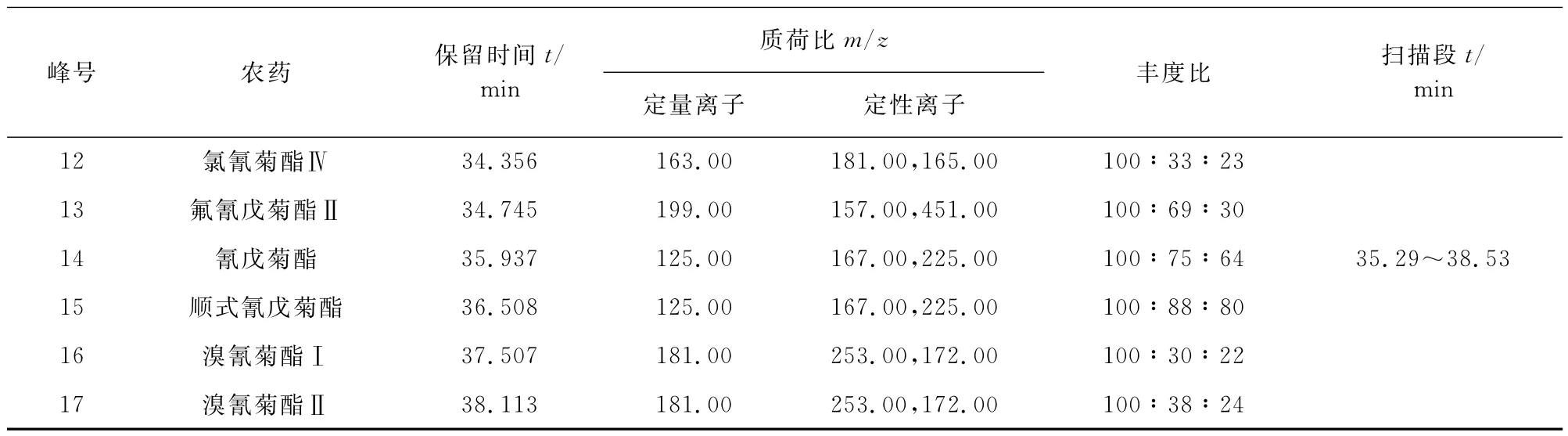
表1(续)
1.3 试验方法
1.3.1 MWNTs改性
称取MWNTs 50g置于500mL烧瓶中,加入硫酸50mL,超声30min,再向烧瓶中加入硝酸30mL,超声30min,静置,用吸管吸除上层混酸清液,然后加入水1L稀释,稀释液过0.22μm聚四氟乙烯微孔滤膜,水洗至滤液为中性(pH 7),所得黑色固体经真空烘箱50℃干燥,即得被氧化的改性MWNTs。
1.3.2 样品提取
称取粉碎的柑、陈皮酱、陈皮梅、陈皮或陈皮普洱茶试样各2.000 0g置于50mL具塞离心管中,加入水2mL(陈皮、陈皮普洱茶加入水4mL),振荡1min,超声5min,加入乙酸乙酯-正己烷(1+1)混合液5mL,超声5min,以3 000r·min-1转速离心5min,吸取上层清液,再加入乙酸乙酯-正己烷(1+1)混合液3mL重复提取[陈皮、陈皮普洱茶再加入乙酸乙酯-正己烷(1+1)混合液5mL],合并上清液,混匀。
1.3.3 提取液净化
将上清液吹干,残留物用乙酸乙酯-正己烷(1+1)混合液2mL溶解,将其转移至装有0.2g改性的MWNTs的离心管中,振荡1min,以3 000r·min-1转速离心5min,净化后的上清液过0.22μm聚四氟乙烯微孔滤膜后,按仪器工作条件进行测定。
2 结果与讨论
2.1 MWNTs表面改性
试验将MWNTs与硫酸混合,超声,除去其表面加工过程中吸附的金属催化剂微粒,之后加入硝酸超声,通过混酸的强烈氧化反应,提高反应效率,最后加入水终止氧化反应,氧化改性流程见图1。
氧化改性前后MWNTs的透射电子显微镜图(TEM)见图2。
图1 MWNTs改性示意图Fig.1 Scheme diagram of modification of MWNTs

图2 未经氧化及混酸氧化后所得MWNTs的TEM图Fig.2 TEM images of MWNTs untreated and treated with a mixture acid by oxidation
由图2可知:氧化改性后所得MWNTs分散均匀,有一定的长径比,长度分布均匀,说明试验所采用的氧化改性方法效果较好。
氧化前后MWNTs的红外光谱图见图3。
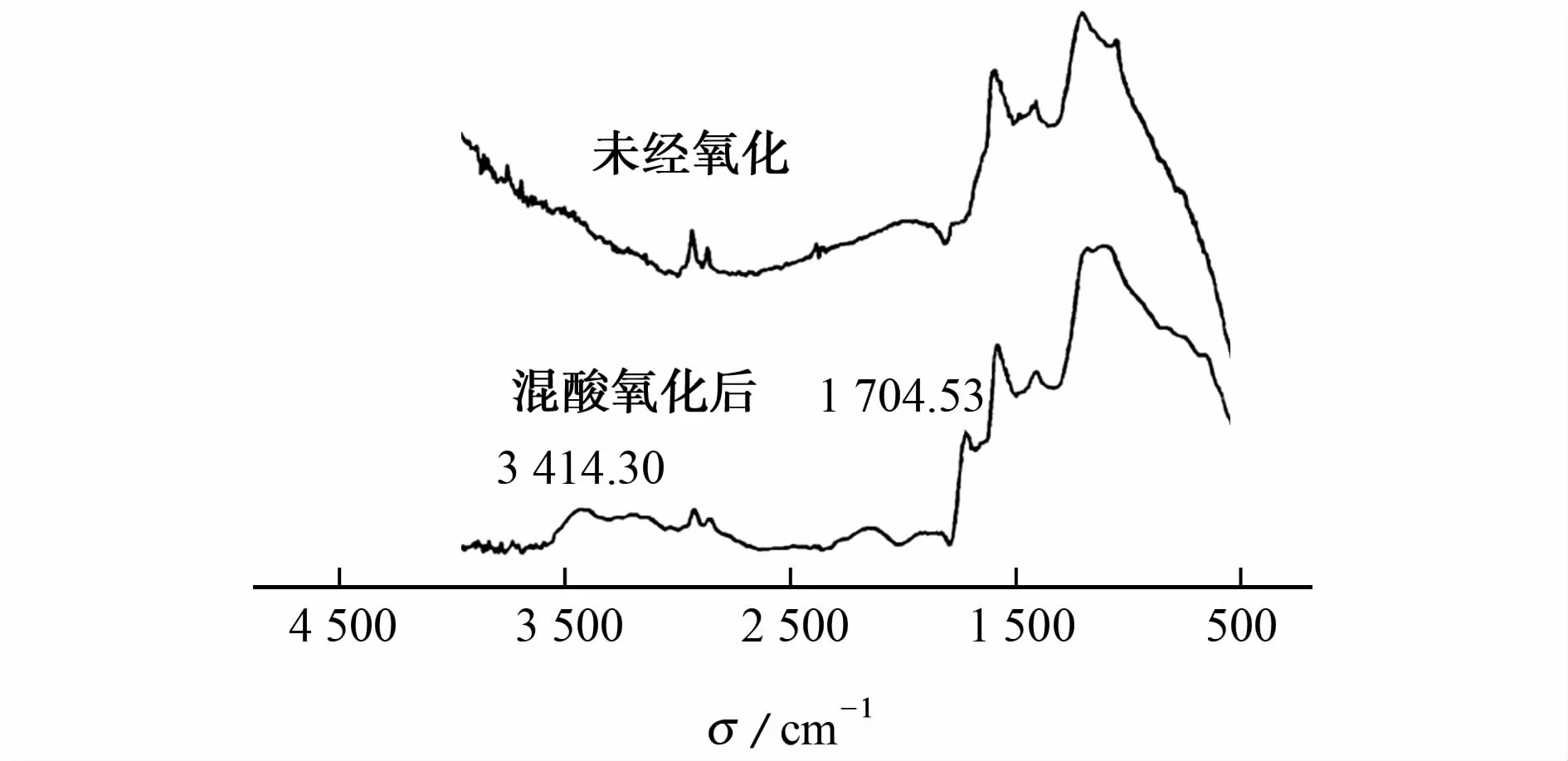
图3 未经氧化及混酸氧化后所得MWNTs的红外光谱图Fig.3 Infrared spectrum of MWNTs untreated and treated with a mixture acid by oxidation
由图3可知:氧化后的 MWNTs在3 414cm-1波数处出现较宽的吸收峰,该吸收峰是由羟基伸缩振动所引起的,在1 704cm-1处的吸收峰是羧基中的羰基伸缩振动引起的。说明强酸氧化后MWNTs的表面产生了羟基和羧基的官能基团。
2.2 提取剂的选择
三氯杀螨醇和拟除虫菊酯农药化学结构和理化性质差异较大,将目标物从样品中有效提取是多残留分析必须解决的首要问题。试验在用有机溶剂提取前,先以水浸泡以提高样品的浸润性和减少极性干扰杂质,样品浸湿后细胞壁胀破农药易溶出,便于有机溶剂的渗入和提取,从而提高对目标化合物的提取效率。三氯杀螨醇和拟除虫菊酯农药极性与溶解性存在差异,依据“相似相溶”原则,在陈皮空白样品中添加25μg·kg-1的三氯杀螨醇、甲氰菊酯和顺式氰戊菊酯混合标准溶液(每种溶剂重复6次),考察了乙腈、乙酸乙酯、正己烷和不同体积比的乙酸乙酯-正己烷混合液等提取体系对3种农药回收率的影响,见图4。

图4 提取剂对3种农药回收率的影响Fig.4 Effect of extraction solvents on recovery of 3pesticides
结果表明:乙腈作为提取剂时,亲脂性化合物如蜡质物、脂肪等不被提取,但其毒性较强且沸点高,浓缩耗时长;正己烷极性小,亲脂性杂质干扰大,提取效率差;乙酸乙酯极性较大,三氯杀螨醇回收率较低并且提取液中杂质干扰较大;乙酸乙酯-正己烷混合液对所有目标物均有较好的提取效果,乙酸乙酯-正己烷体系毒性较小,提取液便于浓缩。通过比较回收率,试验选用乙酸乙酯-正己烷(1+1)混合液作为提取剂。
2.3 超声时间的选择
超声可加速三氯杀螨醇和拟除虫菊酯农药在样品和提取剂之间平衡的过程。试验考察了超声时间分别为2,5,10,15min时对三氯杀螨醇、甲氰菊酯和氰戊菊酯回收率的影响,结果见图5。

图5 超声时间对3种农药回收率的影响Fig.5 Effect of ultrasonic time on recovery of 3pesticides
由图5可知:随着超声时间的延长,目标物的回收率提高;超声5min时,目标化合物回收率达到最高;继续延长超声时间,目标物的回收率降低,可能是由于超声提取过程中产生热量造成农药分解。试验选择超声时间为5min。
2.4 净化剂的选择
陈皮及其制品基质复杂,为了消除杂质干扰,在空白陈皮中添加100μg·kg-1的三氯杀螨醇、甲氰菊酯和顺式氰戊菊酯混合标准溶液,考察了Florisil、PSA、硅胶和改性MWNTs等4种净化剂对三氯杀螨醇、甲氰菊酯和顺式氰戊菊酯回收率的影响。试验结果表明:Florisil虽能有效地吸附极性化合物,但净化液呈浅黄色、浅绿色或绿色,3种农药的回收率为55.7%~72.1%;PSA可以有效去除提取液中的有机酸、脂肪酸、糖类,但不能有效去除生物碱、色素、维生素、黄酮化合物等,3种农药的回收率为48.0%~62.5%;硅胶对蛋白质、脂肪、维生素等杂质有较高的吸附量,但也能牢固吸附目标物,3种农药回收率为27.3%~55.3%;改性MWNTs可有效除去样品中的水溶性和脂溶性杂质,净化液几乎无色,杂质背景对目标物检测无影响,且回收率为84.9%~102%。此外,改性 MWNTs能在广泛的pH范围内保持稳定[14],保证了净化效果及方法的通用性。试验选择以改性MWNTs为净化剂。
试验进一步考察了改性MWNTs净化剂用量分别为0.1,0.2,0.4,0.8g时对三氯杀螨醇和拟除虫菊酯农药回收率的影响。结果表明:相对于其他化合物,三氯杀螨醇和拟除虫菊酯农药含π电子少,随着净化剂用量增加,杂质与净化剂能形成更强的π-π吸附而减少了对目标化合物的干扰,农残回收率增大;当净化剂用量为0.2g时回收率最高;继续增加净化剂用量,目标化合物回收率没有明显变化。试验选择改性MWNTs净化剂用量为0.2g。
2.5 质谱条件的选择
试验首先配制9种农药的混合标准溶液,通过全扫描方式得到总离子流图见图6,再根据每种农药在PESTEI、NIST谱库中的碎片离子质荷比和丰度比信息,对每一种农药标准物质进行质谱解析确认。通过试验选择6个时间段进行选择离子监测,每种农药分别选择1个定量离子用外标法定量,2个定性离子和丰度比为定性依据,质谱参数见表1,部分目标化合物的提取离子流图见图7(a)和图7(b)。

图6 混合标准溶液的总离子流图Fig.6 TIC chromatogram of mixed standard solution
2.6 基质效应
基质效应指样品中被分析物以外的组分,对分析过程及结果准确性的影响和干扰。不同农药在同一基质中具有不同的基质效应,同一农药在不同基质中基质效应也不同,同时基质效应与质量浓度具有一定的关系,随着质量浓度增加,基质效应逐渐减弱。试验对柑、陈皮梅、陈皮和陈皮普洱茶的基质效应进行了研究。分别用纯有机溶剂、基质空白提取液配制成两组质量浓度分别为0.010,0.020,0.050,0.10,0.40,1.0mg·L-1的混合标准溶液系列,按仪器工作条件进行测定,分别绘制有机溶剂标准曲线和基质匹配标准曲线。采用基质匹配标准曲线斜率和有机溶剂标准曲线斜率之比(K)来评价基质效应[15]。当K小于0.9时,为基质抑制效应;当K在0.9~1.1之间时,基质效应不明显;当K大于1.1时,为基质增强效应。结果表明:柑、陈皮梅、陈皮和陈皮普洱茶作为基质,计算得出9种农药的K在0.923 6~1.086 6之间,表明基质效应对定量结果的影响可以忽略。试验可避免使用基质标准曲线,定量方法更简便。
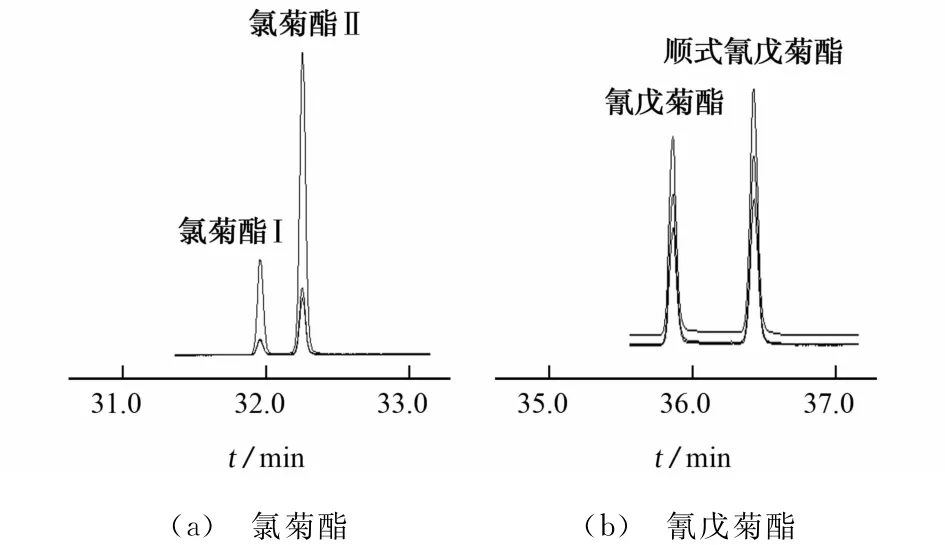
图7 氯菊酯及氰戊菊酯的提取离子流图Fig.7 EIC chromatograms of permethrin and fenvalerate
2.7 线性范围与检出限
分别配制0.010,0.020,0.050,0.10,0.40,1.0mg·L-1的混合标准溶液系列,按仪器工作条件进行测定,以农药的质量浓度为横坐标,对应的定量离子色谱峰面积为纵坐标绘制标准曲线。结果表明:9种农药在0.010~1.0mg·L-1内呈线性关系,其线性回归方程和相关系数见表2。其中“*”代表有异构体的拟除虫菊酯,定量以各异构体的峰面积之和计算。以3倍信噪比计算方法的检出限(3S/N),结果见表2。

表2 线性参数和检出限Tab.2 linearity parameters and detection limits
2.8 精密度和回收试验
在阴性柑、陈皮、陈皮普洱茶样品中分别添加0.010,0.020,0.10mg·kg-1等3种浓度水平的混合标准溶液,按试验方法对每个浓度水平重复测定6次,其结果见表3。其中“*”代表有异构体的拟除虫菊酯,定量以各异构体的峰面积之和计算。
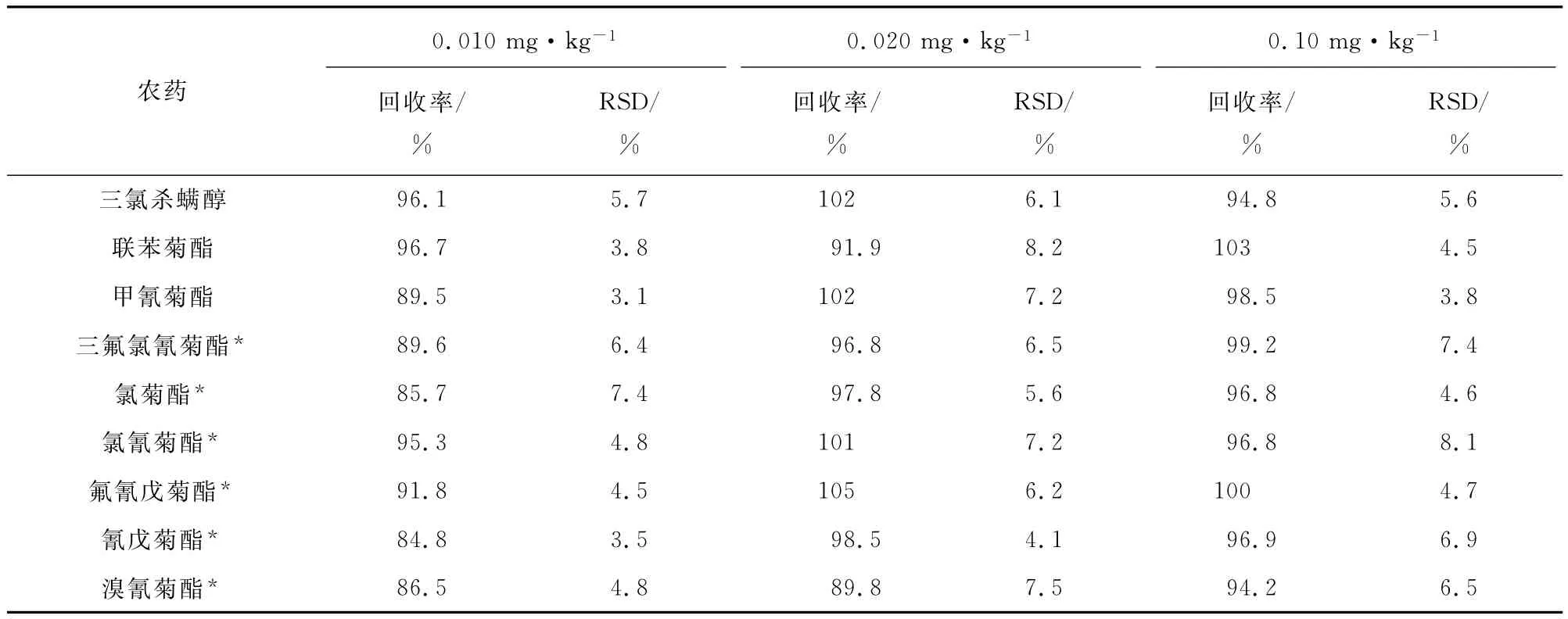
表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
由表3可知:农药的加标回收率在84.8%~105%之间,相对标准偏差(RSD)在3.1%~8.2%之间。说明方法的准确度高、稳定性好,满足痕量分析的要求。
2.9 样品分析
按试验方法对柑、陈皮酱、陈皮梅、陈皮、陈皮普洱茶等100批次送检样品进行测定,采用实验室空白、空白加标和平行样进行质量控制,其中2份陈皮普洱茶中检出三氯杀螨醇,质量分数分别为0.048,0.027mg·kg-1,其余样品均未检出三氯杀螨醇和拟除虫菊酯农药。
本工作以改性MWNTs为净化剂,采用气相色谱-质谱法测定陈皮及其制品中三氯杀螨醇和拟除虫菊酯农药的残留量。方法应用于实际样品的检测,得到满意的结果,符合农药残留分析从繁琐的传统方法向快速、简便方法的发展趋势,能够满足国内外的残留限量要求,具有一定的应用价值。
[1] 占绣萍,陈建波,马琳,等.高效液相色谱法测定糙米和土壤中6种杀虫剂的残留[J].农药学学报,2013,15(5):541-545.
[2] 高越,张润祥,王振,等.不同农药单剂及混配微乳剂的环境毒性研究[J].中国农学通报,2011,27(12):295-300.
[3] 秦文秀,颜冬云,王春光,等.拟除虫菊酯在底泥中的归趋及其生物效应[J].土壤,2011,43(5):703-709.
[4] 王祥云,章虎,何红梅,等.气相色谱法测定葱中百菌清和三唑酮残留量[J].理化检验-化学分册,2009,45(8):919-921.
[5] 纪淑娟,刘长江,佐藤元昭,等.用气-质联用技术检测葱、蒜、韭菜中多种农药残留量时试样预处理方法[J].理化检验-化学分册,2006,42(11):914-917.
[6] 刘腾飞,杨代凤,董明辉,等.分散固相萃取-气相色谱法测定茶鲜叶中7种拟除虫菊酯类农药残留[J].农药学学报,2015,17(5):571-578.
[7] 王丽婷,王波,周围,等.超高效合相色谱及气相色谱-质谱联用测定茶叶中联苯菊酯[J].分析化学,2015,43(7):1047-1052.
[8] 崔艳华,姚伟宣,张素玲,等.石墨烯/聚二甲基硅氧烷涂层顶空固相微萃取与气相色谱联用测定环境水和果汁中菊酯农药残留[J].分析测试学报,2015,35(4):375-380.
[9] ZHAO W J,SUN X K,DENG X N,et al.Cloud point extraction coupled with ultrasonic-assisted backextraction for the determination of organophosphorus pesticides in concentrated fruit juice by gas chromatography with flame photometric detection[J].Food Chemistry,2011,127(2):683-688.
[10] WU L J,SONG Y,HU M Z,et al.Integrated microwave processing system for the extraction of organophosphorus pesticides in fresh vegetables[J].Talanta,2015,134:366-372.
[11] IIJIMA S.Helical microtubules of graphitic carbon[J].Nature,1991,354:56-58.
[12] VALCRCEL M,CRDENAS S,SIMONET B M,et al.Carbon nanostructures as sorbent materials in analytical processes[J].TrAC Trends in Analytical Chemistry,2008,27(1):34-43.
[13] RAO W,CAI R,YIN Y L,et al.Magnetic dummy molecularly imprinted polymers based on multi-walled carbon nanotubes for rapid selective solid-phase extraction of 4-nonylphenol in aqueous samples[J].Ta-lanta,2014,128:170-176.
[14] 毛胜春,牛建华,徐友龙,等.不同pH值条件下多壁碳纳米管悬浮液光限幅特性的研究[J].材料导报,2009,23(20):20-22.
[15] STAHNKE H,REEMTSMA T,ALDER L.Compensation of matrix effects by postcolumn infusion of a monitor substance in multiresidue analysis with LCMS/MS[J].Analytical Chemistry,2009,81(6):2185-2192.
