硫酸铵存在下碘化物-结晶紫-丙醇双水相体系萃取-原子吸收光谱法测定铅
2018-01-22左国强苏小莉李全民
左国强,苏小莉,李全民
(1.济源职业技术学院 冶金化工系,济源454600; 2.河南师范大学 化学与环境科学学院,新乡453007)
传统的萃取分离法主要采用与水互不相溶的异相进行萃取,多数萃取溶剂有毒、易燃、易挥发,对分析工作者的身体健康造成影响,因此在应用上受到一定程度的限制[1]。双水相萃取是指被分离物质进入双水相体系后由于表面性质、电荷间作用和各种作用力(如增水键、氢键和离子键)等因素的影响,在两相间的分配系数(K)不同,导致其在上下两相的浓度不同,从而达到分离的目的[2]。文献[3-6]把小分子醇-盐-双水相体系应用到铅、镉、铬、汞等环境中持久性污染物的分离富集中。文献[4]以1-(2-吡啶偶氮)-2-萘酚(聚苯胺)作为显色剂,用丙醇、硫酸铵形成的双水相体系萃取铅-碘化钾-聚苯胺离子缔合物,取得了较好的效果。
本工作提出以结晶紫为显色剂,利用丙醇、硫酸铵形成的双水相体系萃取分离铅。结果表明:被萃取物质PbI42-络离子既能够与质子化丙醇生成离子缔合物PbI42-·2CH3CH2CH2OH2+,也可以与结晶紫阳离子(CV+)生成离子缔合物PbI42-·2CV+,这两种缔合物具有较强的疏水性,被直接萃取到上层丙醇相。本工作采用火焰原子吸收光谱法(AAS)测定萃取后丙醇相中铅的含量,与传统萃取方法比较,本法避免使用毒性较大的有机溶剂,并具有干扰小、快速、操作简便和分相清晰等特点,这对研究持久性污染物铅的分离富集及测定具有一定的参考价值。
1 试验部分
1.1 仪器与试剂
TAS-990型原子吸收分光光度计;FA-2004型电子天平。
Pb2+标准储备溶液:1 000mg·L-1。
Pb2+标准溶液:100mg·L-1,由1 000mg·L-1Pb2+标准储备溶液稀释而来。
结晶紫乙醇溶液:5.0×10-3mol·L-1。
所用试剂均为分析纯,试验用水为超纯水。
1.2 仪器工作条件
测定波长283.3nm,灯电流2.0mA,光谱通带宽度0.4nm,乙炔流量1 300mL·min-1,燃烧器高度6mm,燃烧器位置-1mm,空气压力0.25MPa。
1.3 试验方法
1.3.1 Pb2+的萃取分离
在15mL玻璃螺口试管中,分别加入一定量的铅标准溶液,300g·L-1碘化钾溶液1mL,5.0×10-3mol·L-1结 晶 紫 溶 液 0.2mL,pH 5 的KHC8H4O4-NaOH缓冲溶液1mL,丙醇3mL,用水稀释至10mL,再加入硫酸铵1.5g,振荡约1min,静置10min,溶液分为丙醇-水两相,丙醇相位于上层,记录上层液的体积。
1.3.2 Pb2+的测定
上层丙醇溶液直接用火焰原子吸收光谱法测定吸光度,利用回归分析法,通过仪器软件读出溶液中Pb2+的含量,根据上层液的体积,计算Pb2+的萃取率(%)。
2 结果与讨论
2.1 分相条件的选择
双水相体系中,丙醇相和水分相可以认为是盐与丙醇争夺水分子的结果,试验选择硫酸铵作为盐析剂,固定丙醇的体积分数为30%,总体积为10mL,考察硫酸铵用量对丙醇-水双水相体系分相的影响。结果表明:硫酸铵的用量依次为0.5,1.0,1.2,1.4,1.6,1.8,2.0g时,分相上层体积依次为不分层 ,2.0,2.6,3.1,2.9,2.8,3.2mL。 可 以 看 出:增加硫酸铵的用量,分相后上层体积不断增加,这说明由于盐的作用,丙醇从水中不断析出,当硫酸铵的用量达到1.4g以上时,上层相体积近似等于初始体积3mL,为确保分相完全,试验选择硫酸铵的用量为1.5g。
2.2 反应条件的选择
2.2.1 碘化钾的用量
试验考察了300g·L-1碘化钾溶液的用量对Pb2+萃取率的影响。结果表明:不使用络合剂碘化钾,萃取率为0,这说明丙醇不能单独萃取Pb2+;不断增加碘化钾溶液的用量,萃取率逐渐加大,这是由于Pb2+能与I-络合生成PbI42-,络离子能够进一步与结晶紫阳离子生成离子缔合物,该缔合物难溶于水易溶于有机溶剂,进而萃取进入上层丙醇相;当碘化钾溶液的用量为1mL时,吸光度达到最大;进一步增加碘化钾溶液的用量,吸光度稍有下降,这可能是由于离子强度的增加,离子缔合物在下层水溶液中的溶解度增加,上层丙醇相中铅含量相应减少。为确保萃取完全,同时为获得较高的灵敏度,试验选择300g·L-1碘化钾溶液的用量为1mL。
2.2.2 结晶紫的用量
试验考察了5.0×10-3mol·L-1结晶紫溶液的用量对Pb2+萃取率的影响。结果表明:体系中不加入结晶紫,上层溶液的吸光度只有0.036,这说明水溶液中只有少量的Pb2+萃取进入丙醇相,这是由于Pb2+与I-生成的PbI42-络离子能够与质子化丙醇络合生成离子缔合物 PbI42-·2CH3CH2CH2OH2+,但由于PbI42-的离子缔合能力有限,因此,只有少量的PbI42-参与反应。当加入结晶紫溶液后,吸光度急剧增加,这可能是由于PbI42-与结晶紫阳离子生成了离子缔合物PbI42-·2CV+,该缔合物难溶于水易溶于有机溶剂,进而萃取进入上层丙醇相,这说明丙醇不仅能够萃取PbI42-与结晶紫阳离子生成的离子缔合物PbI42-·2CV+,也可以萃取PbI42-与丙醇阳离子生成的缔合物PbI42-·2CH3CH2CH2OH2+。结晶紫溶液的用量为0.2mL时,体系的吸光度达到最大,继续增加结晶紫溶液的用量,吸光度略有降低,这可能是由于离子强度的增加引起的。为获得较高的信号值,试验选择5.0×10-3mol·L-1结晶紫溶液的用量为0.2mL。
2.2.3 体系的酸度
试验考察了缓冲溶液的pH对Pb2+萃取率的影响,结果表明:在pH为1~5时,Pb2+的萃取率几乎没有变化,这说明酸度对Pb2+的萃取影响较小,这可能是Pb2+与I-生成PbI42-络离子与介质的酸度关系不大,即在pH为1~5时,Pb2+与I-均能生成稳定的PbI42-络离子,进而与结晶紫阳离子生成离子缔合物,萃取至上层丙醇相。试验中加入pH 5的KHC8H4O4-NaOH缓冲溶液1mL。
2.3 干扰离子的影响
根据Pb2+与其他离子在相同条件下萃取率的差异,合成了一系列的二元体系。按试验方法对上述二元体系萃取分离,测定上层溶液的吸光度,计算萃取率,有Fe3+存在时,体系中加入了抗环血酸,结果见表1。
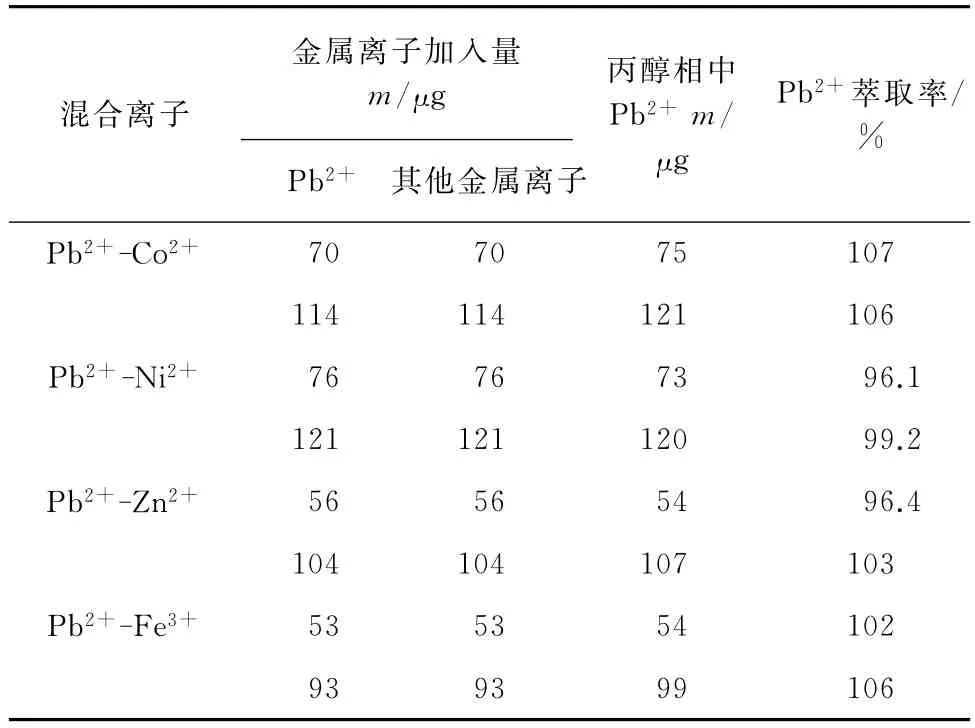
表1 干扰离子的影响Tab.1 Effect of interfering ions
由表1可知:在硫酸铵存在下,碘化钾-结晶紫-丙醇体系能使 Pb2+与 Fe3+、Zn2+、Ni2+、Co2+得到较好的分离。
2.4 标准曲线和检出限
分别移取100mg·L-1铅标准溶液0.20,0.40,0.60,0.80,1.00mL于5个比色管中,按试验方法萃取分离,测定上层溶液的吸光度,并绘制标准曲线。结果表明:Pb2+的质量浓度在2~10mg·L-1内与其对应的吸光度呈线性关系,线性回归方程为y=0.017 8x+0.002 5,相关系数为0.999 2。
对10份空白溶液进行平行测定,以测定值的3倍标准偏差除以标准曲线的斜率计算方法的检出限(3s/k)为0.3mg·L-1。
2.5 回收试验
按试验方法对4份模拟样品进行测定,并进行加标回收试验,结果见表2。

表2 回收试验结果Tab.2 Results of test for recovery
由表2可知:加标回收率为98.2%~107%,可以满足微量元素的测定要求。
2.6 样品分析
称取冶金废渣试样0.200 0g于250mL烧杯中,用水润湿,加入盐酸15mL,盖上表面皿,于电热板上加热溶解20min,加入硝酸5mL,继续加热溶解,待试样溶解后,用少量水洗去表面皿,蒸发至5mL,取下冷却后转移至100mL容量瓶中,定容,摇匀,作为待测液。
移取待测液2.00mL于玻璃螺口试管中,按试验方法萃取分离并进行测定,同时做空白试验,结果见表3。
本工作探索了在硫酸铵存在下利用碘化物-结晶紫-丙醇双水相体系萃取分离持久性污染物铅,采用火焰原子吸收光谱法进行测定。方法应用于冶炼废渣中铅的分离与测定,结果满意。

表3 样品分析结果(n=5)Tab.3 Analytical results of the samples(n=5)
[1] 马万山,钟黎,高素英,等.硫酸铵-溴化钾-乙醇体系萃取分离金[J].分析化学,2004,32(1):56-59.
[2] 李伟,柴金玲,谷学新.新型的萃取技术-双水相萃取[J].化学教育,2005,3(2):7-9.
[3] 曾云,覃事栋,陈腾,等.乙醇-硫酸铵双水相萃取镉-碘化钾-丁基罗丹明B离子缔合物[J].光谱实验室,2012,29(5):2963-2966.
[4] 董红敏,沈亮亮,李雪,等.乙醇-硫酸铵-1-(2-吡啶偶氮)-2-萘酚双水相萃取铅(Ⅱ)[J].分析试验室,2013,32(11):104-107.
[5] 张树贵.双水相萃取分光光度法测定镍钼矿中的镍[D].吉首:吉首大学,2015.
[6] 孙赛兰,盛小娅,祖力甫哈尔·亚科甫,等.正丙醇-氯化钠-4-(2-吡啶偶氮)-间苯二酚双水相萃取光度法测定工业废水中的Zn2+[J].分析科学学报,2016,32(4):545-548.
