基于四氧化三钴-石墨烯纳米复合材料的电化学DNA传感器
2018-01-22牛学良沈青凤蒙泽慧闫丽君何博琳门永玲
甄 超,牛学良,沈青凤,蒙泽慧,闫丽君,何博琳,门永玲,孙 伟,2*
(1.海南师范大学 化学与化工学院,海南 海口,571158;2.海口市功能材料与光电化学重点实验室,海南 海口,571158)
电化学DNA生物传感器是将DNA杂交反应与电化学分析相偶合的一种新方法,具有灵敏度高、选择性好、操作快速、样品用量少等特点,并且可以对特定目标序列进行快速检测,在临床检测、食品分析等很多领域有着广泛的应用前景[1-4].
石墨烯是一种只有一个碳原子厚度的二维纳米材料,表现出独特的光学、热学、电子和机械性能等理化性质,使其成为各领域的研究热点[5-8].石墨烯因其具有电化学窗口宽、比表面积大和导电性好等优点,在电化学分析和纳米传感方向表现出重要的应用前景[9].利用石墨烯及其复合材料构建电化学DNA生物传感器,可以充分发挥石墨烯复合材料的表面积大、稳定性好、导电性高等优点,有效增加界面的导电性以及探针ssDNA在材料表面的负载量,达到提高灵敏度的目的[10].
本文将四氧化三钴-石墨烯(Co3O4-GR)纳米复合材料固定于工作电极表面得到相应的石墨烯纳米复合材料修饰电极,优化修饰材料的浓度,进一步将探针ssDNA固定在电极表面制备电化学DNA生物传感器.以铁氰化钾为电化学探针,通过杂交前后电化学信号的差异来检测目标ssDNA序列,并对副溶血弧菌tlh特征序列进行电化学检测,获得了满意的结果.
1 材料与方法
1.1 仪器与试剂
电化学实验如循环伏安(CV)、差分脉冲伏安(DPV)和交流阻抗(EIS)均在CHI 660E型电化学工作站(上海辰华仪器公司)上完成.采用常规三电极系统,以修饰电极为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝为辅助电极.JSM-7100F扫描电子显微镜(SEM,日本电子公司).
石墨粉(上海胶体化学厂,颗粒度≤ 30 μm);1-己基吡啶六氟磷酸盐(HPPF6,兰州雨陆精细化工有限公司);铁氰化钾(天津市瑞金特化学品有限公司);壳聚糖(0.5% CTS);Co3O4-GR纳米复合材料(南京先丰纳米材料有限公司);其他试剂均为分析纯,实验用水均为二次蒸馏水.
由上海生工生物技术有限公司提供的与副溶血弧菌tlh基因相关的23个碱基序列如下:
探针序列:5′-GAT GAC ACT GCC AGA TGC GAC GA-3′;目标序列:5′-TCG TCG CAT CTG GCA GTG TCA TC-3′;单碱基错配序列:5′-TCG TCG CAT CTA GCA GTG TCA TC-3′;三碱基错配序列:5′-TAG TCG CAT CTA GCA GTG TCA GC-3′;非互补序列:5′-ATC CTT TGC AAT TGC CCA GTC GG-3′.
1.2 CTS/Co3O4-GR/CILE的制备
按照质量比为2:1分别称取石墨粉和离子液体于研钵中,充分混合研磨后装入玻璃电极管中,压实后内插铜线作为电极导线,即制得离子液体碳糊电极(CILE),使用前在称量纸上打磨至镜面[11].
将8 μL 1.0 mg/mL的Co3O4-GR溶液均匀涂布在CILE表面,室温晾干后再滴涂6 μL 0.5% CTS,自然晾干后即制得所需的工作电极(CTS/Co3O4-GR/CILE).
1.3 电化学DNA传感器的制备
在CTS/Co3O4-GR/CILE表面均匀滴涂10.0 μL含有1.0×10-6mol/L探针ssDNA序列的PBS溶液,自然干燥后为了除去未吸附的探针ssDNA,用水冲洗修饰电极即得到ssDNA/CTS/Co3O4-GR/CILE.带正电性的CTS聚阳离子膜可以静电吸附带负电性DNA磷酸骨架,进而将探针ssDNA固定在修饰电极表面.
利用滴涂法完成DNA杂交反应[12],将10.0 μL含有目标ssDNA序列的PBS缓冲溶液滴涂在ssDNA/CTS/Co3O4-GR/CILE表面,晾干后用水洗涤,即得到dsDNA/CTS/Co3O4-GR/CILE.
1.4 电化学检测
DPV实验在10.0 mmol/L K3[Fe(CN)6]和0.1 mol/L KCl混合溶液中进行,实验参数为电位增量0.008 mV,脉冲宽度0.05 s,脉冲周期0.2 s.CV实验在1.0 mmol/L K3[Fe(CN)6]和0.5 mol/L KCl混合溶液中进行,扫速为0.1 V/s;EIS实验在10.0 mmol/L K3[Fe(CN)6]和0.1 mol/L KCl混合溶液中进行,频率范围为0.1~105Hz.
2 结果与分析
2.1 修饰电极的制备优化
以1.0 mmol/L铁氰化钾溶液研究电极表面Co3O4-GR用量对修饰电极性能的影响,结果如图1所示.不同浓度Co3O4-GR纳米复合材料的存在对电极表面电子的传导具有不同的影响,当其浓度从0.3 mg/mL增加到1.0 mg/mL时,峰电流逐渐增大,而浓度继续增大时峰电流却逐渐减小,在1.0 mg/mL时峰电流最大,所以选择1.0 mg/mL为Co3O4-GR修饰电极的最佳浓度.电极表面纳米材料的浓度太大会使修饰层过厚而阻碍电子的转移.

图1 Co3O4-GR纳米复合材料浓度与峰电流的关系曲线,溶液为1.0 mmol/L K3[Fe(CN)6]和0.5 mol/L KCl的混合液,扫速100 mV/s
Fig. 1 Relationship of Co3O4-GR concentration and the peak current in 1.0 mmol/L K3[Fe(CN)6] and 0.5 mol/L KCl mixture solution with scan rate as 100 mV/s
图2 Co3O4-GR/CILE的扫描电镜图
Fig. 2 SEM image of Co3O4-GR/CILE
2.2 SEM结果分析
Co3O4-GR/CILE的SEM结果如图2所示.从图2中可以看出Co3O4纳米颗粒均匀的分散在GR表面.Co3O4-GR复合材料的存在增大了电极的有效面积,进而可以增加探针ssDNA在电极表面的负载量,同时Co3O4-GR复合材料较高的导电性有利于电极表面电子的传输.
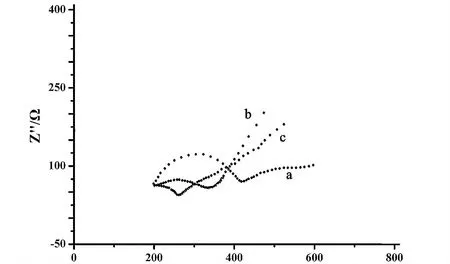
图3 不同电极在10.0 mmol/L K3[Fe(CN)6]和0.1 mol/L KCl混合溶液中的EIS图(电极从a到c依次为CILE,CTS/Co3O4-GR/CILE和Co3O4-GR/CILE)Fig. 3 EIS results of (a) CILE, (b) CTS/Co3O4-GR/CILE, (c)Co3O4-GR/CILE in 10.0 mmol/L K3[Fe(CN)6]and 0.1 mol/L KCl mixture solution
2.3 交流阻抗分析
图3为不同修饰电极的交流阻抗图,电解质溶液为10.0 mmol/L K3[Fe(CN)6]和0.1 mol/L KCl的混合溶液.由图可知Co3O4-GR/CILE(曲线c)的阻抗值小于裸电极CILE(曲线a)的阻抗值,说明高导电性的Co3O4-GR降低了界面电阻.而在CTS/Co3O4-GR/CILE(曲线b)上阻抗值增大,是因为CTS为非导电高分子材料,会阻碍电极表面的电子传递.
2.4 选择性研究
对所制备的电化学DNA传感器的选择性进行了研究,图4是ssDNA修饰电极与1.0×10-6mol/L不同错配序列杂交后的DPV曲线.从图4可以看出在ssDNA/CTS/Co3O4-GR/CILE上的电流响应最大(曲线e).当与完全互补的目标序列DNA杂交后电流降低最大(曲线a),这是因为电极表面上探针ssDNA与目标ssDNA序列杂交后的碱基配对作用会在电极表面形成dsDNA,使电极表面的负电荷量最大,对铁氰化钾的阻碍作用最大,导致电流最小.非互补序列(曲线d),三碱基错配序列(曲线c)和单碱基错配序列(曲线b)与探针序列发生分子杂交反应后,峰电流值低于杂交前而高于完全杂交的峰电流值.这是由于杂交反应会使电极表面部分形成dsDNA,导致电极表面的带电荷量有差异,因此电流会发生变化.实验结果说明构建的电化学DNA传感器对不同序列的检测具有良好的选择性.

图4 ssDNA/CTS/Co3O4-GR/CILE与不同目标序列杂交后在10.0 mmol/L K3[Fe(CN)6]和0.1 mol/L KCl混合溶液中的差分脉冲伏安曲线.(a)与目标序列杂交后;(b)与单碱基错配序列杂交后;(c)与三碱基错配序列杂交后;(d)与非互补碱基序列杂交后;(e)杂交前Fig. 4 Differential pulse voltammograms of ssDNA/CTS/Co3O4-GR/CILE hybridizated with the complementary ssDNA sequence (a), one-base mismatched sequence (b), three-base mismatched sequence (c), the noncomplementary sequence (d) and before hybridization (e) in 10.0 mmol/L K3[Fe(CN)6] and 0.1 mol/L KCl
2.5 工作曲线
在优化的条件下,将电化学DNA传感器用于不同浓度的目标基因tlh序列的检测,在10.0 mol/L K3[Fe(CN)6]和0.1 mol/L的KCl溶液中进行DPV测试.如图5A所示,随着目标序列浓度的增加,峰电流的值逐渐减小.这是因为目标ssDNA浓度的增加使电极表面形成的dsDNA数量增加,所带电荷量也增大,所以铁氰化钾的峰电流逐渐减小.如图5B所示,还原峰电流(Ip)与目标序列浓度的对数在1.0×10-14~1.0×10-6mol/L浓度范围内表现出线性关系,线性回归方程为Ipa(μA) = 134.31-5.78 logC (mol/L) (γ = 0.981),检测限为3.3×10-15mol/L (3σ).表1汇总了对一些文献报道的电化学DNA传感器的分析参数,从表1中可以看出,本方法具有较宽的线性范围和较低的检测限.

图5 (A)与不同浓度的目标序列杂交后的DPV曲线(从a到j浓度依次为1.0×10-6, 1.0×10-7, 1.0×10-8,1.0×10-9,1.0×10-10,1.0×10-11,1.0×10-12,1.0×10-13,1.0×10-14,0 mol/L),(B)目标ssDNA序列浓度的对数与峰电流值的线性关系曲线Fig. 5 (A) Differential pulse voltammograms of probe ssDNA modified electrode reacted with different concentrations target ssDNA sequence (From a to j: 1.0×10-6, 1.0×10-7, 1.0×10-8, 1.0×10-9, 1.0×10-10, 1.0×10-11, 1.0×10-12, 1.0×10-13, 1.0×10-14, 0 mol/L), (B) Linear relationship of I versus log C

电极线性范围/(mol/L)检测限/(mol/L)参考文献rGO/SPE7.5×10-12~2.5×10-91.5×10-1213CS/TiO2/ERGO/CILE1.0×10-12~1.0×10-63.17×10-1314DNA-nsZnO/ITO/GP1.0×10-12~1.0×10-61.0×10-1315ACNTS/probel1/targetDNA/CdTe-ssDNA1.0×10-12~1.0×10-84.0×10-1316CTS/Co3O4-GR/CILE1.0×10-14~1.0×10-63.33×10-15本文
注:rGO,还原氧化石墨烯;SPE,丝网印刷电极;ERGO,电化学还原氧化石墨烯;CS,壳聚糖;CILE,离子液体碳糊电极;ITO,铟锡氧化物导电玻璃;nsZnO,纳米氧化锌;CdTe-ssDNA,CdTe量子点修饰的DNA探针;ACNTS,直立碳纳米管列阵;GR,石墨烯
3 结论
制备了Co3O4-GR纳米复合材料修饰的离子液体碳糊电极,并通过滴涂法固定探针ssDNA序列构建无指示剂的电化学DNA传感器.GR和Co3O4两者之间存在良好的协同作用,能够加快电子的转移速率.同时Co3O4-GR纳米复合材料增加了电极界面的有效面积,进而增加了探针DNA序列的负载量.将构建的电化学DNA生物传感器用于副溶血弧菌tlh特征序列的检测,可以实现单碱基和三碱基错配DNA序列的识别测定,提高了所构建的电化学DNA传感器的灵敏度,具有较好的应用前景.
[1] Chen M, Hou C J, Huo D Q, et al. A sensitive electrochemical DNA biosensor based on three-dimensional nitrogen-doped graphene and Fe3O4nanoparticles [J]. Sensors and Actuators B Chemical, 2017, 239: 421-429.
[2] Raveendran M, Andrade A F B, Gonzalez-Rodriguez J.Selective and sensitive electrochemical DNA biosensor for the detection of Bacillus anthracis [J]. International Journal of Electrochemical Science, 2016, 11: 763-776.
[3] Yan L J, Wang X L, Li G J, et al. Electrochemical DNA sensor for adh 1 gene sequence from corn endogenous with carbon microsphere modified electrode [J]. International Journal of Electrochemical Science, 2016, 11: 9790-9799.
[4] Li B, Zheng L, Wang Q, et al. Progress of electrochemical DNA biosensor and application in medical laboratory [J]. Journal of Molecular Diagnostics and Therapy, 2011, 3: 46-50.
[5] Liu Y X, Dong X C, Chen P, Biological and chemical sensors based on graphene materials [J]. Chemical Society Reviews, 2012, 41 (6): 2283-2307.
[6] Brownson D A C, Kampouris D K, Banks C E.ChemInform abstract: graphene electrochemistry: fundamental concepts through to prominent applications [J]. Chemical Society Reviews, 2013, 44 (2): 6944-6976.
[7] Rozhkow A V, Giavaras G, Bliokh Y P.Electronic properties of mesoscopic graphene structures: charge confinement and control of spin and charge transport [J]. Physics Reports, 2011, 503 (2-3): 77-114.
[8] Hayashi M, Yoshioka H, Kanda A.Theoretical study of superconducting proximity effect in single and mutli-layered graphene [J]. Physica C: Superconductivity and its Application, 2010, 470 (22): s846-s847.
[9] Bahadir E B, Sezgintürk M K. Applications of graphene in electrochemical sensing and biosensing [J]. Trends in Analytical Chemistry, 2016, 76: 1-14.
[10] Qi X, Gao H, Zhang Y, et al. Electrochemical DNA biosensor with chitosan-Co3O4nanorod-graphene composite for the sensitive detection of Staphylococcus aureus nuc gene sequence [J]. Bioelectrochemistry, 2012, 88 (12): 42-47.
[11]谢慧,闫丽君,张国平,等.基于石墨烯-TiO2复合材料的蛋白质电化学传感器的研究[J],海南师范大学学报(自然科学版),2017, 30(1):28-33.
[12] Sun W, Wang X L, Lu Y X, et al. Electrochemical deoxyribonucleic acid biosensor based on electrodeposited graphene and nickel oxide nanoparticle modified electrode for the detection of salmonella enteritis gene sequence[J].Materials Science and Engineering C, 2015, 49: 34-39.
[13] Ensafi A A, Farfani N K, Amini M, et al. Developing a sensitive DNA biosensor for the detection of flutamide using electrochemical method [J]. Journal of the Iranian Chemical Society, 2017, 14 (6): 1-10.
[14] Wang X L, Li G J, Liu L H, et al. Application of titanium dioxide nanowires and electroreduced graphene oxide modified electrodes for the electrochemical detection of specific tlh gene sequence from vibrio parahaemolyticus [J]. Analytical Methods, 2017, 7 (6): 2623-2629.
[15] Das M, Sumana G, Nagarajan R, et al. Application of nanostructured ZnO films for electrochemical DNA biosensor [J]. Thin Solid Films, 2010, 519 (3): 1196-1201.
[16] 杨丽珠,朱婧,章仁毅,等. 基于直立碳纳米管大面积金粒子的DNA生物传感器用于早幼粒白血病/维甲酸受体α融合基因检测[J]. 分析化学,2016,44(3):391-395.
