大黄鱼(Pseudosciaena crocea)致病性维氏气单胞菌的分离鉴定与药敏特性研究*
2018-01-22李忠琴赖晓健江兴龙
李忠琴 张 坤 林 茂 赖晓健 江兴龙
(1. 集美大学水产学院 厦门 361021; 2. 鳗鲡现代产业技术教育部工程研究中心 厦门 361021;3. 厦门市渔用药物工程技术研究中心 厦门 361021)
气单胞菌于自然环境中广泛分布, 具有宿主范围广、致病性强等特点, 是造成水产养殖鱼类细菌性疾病的主要病原菌之一。其中维氏气单胞菌(Aeromonas veronii)为气单胞菌属中常见致病菌。其感染鱼体主要症状表现为: 体表、鳍条有出血现象、肠道有黄色黏液、严重时充血, 解剖后肝脏出现糜烂等现象(简灯, 2015)。已有研究报道称维氏气单胞菌能引起不同水产养殖动物如西伯利亚鲟(Acipenser baerii) (马志宏等, 2009)、日本鳗鲡(Anguilla japonica)(杨求华等, 2012)、乌鳢(Channa argus) (康元环等,2014)、黄颡鱼(Pelteobagrus fulvidraco) (朱成科等,2013)、中华绒螯蟹(Eriocheir sinensis) (房海等, 2008)等大量死亡。而感染大黄鱼发病的报道较少。
目前水产养殖中主要采用抗生素、生物制品、微生态制剂、环境改良剂、中草药等药物防治细菌性疾病(李辉华等, 2001)。抗生素对水产动物疾病防治, 促进生长等方面有明显作用, 但大量频繁的使用不仅导致耐药菌株的产生, 而且易造成药物残留、抑制鱼体免疫系统、破坏微生态平衡等现象(胡梦红, 2006)。因此, 合理适宜的对症下药、及时检测重分离菌株耐药性、研发替代绿色药物(中草药)显得尤为关键。中药具有生物活性, 并且对热相对稳定、易溶于水和不污染环境等特点, 可以解决抗菌化学类药物引起的耐药性和养殖鱼类药残超标等问题, 符合无公害水产业、生产绿色水产品的病害防治原则。因此, 越来越被水产养殖业所接受和重视, 可作为代替抗菌药物应用于水产养殖防治细菌性疾病。
大黄鱼(Pseudosciaena crocea)是我国海水养殖产品中的重要经济鱼类。近十多年来, 随着人工繁育、网箱养殖等难关的突破, 大黄鱼人工养殖得以迅速发展, 据统计, 2014年我国年产大黄鱼 12.79万吨,为海水养殖鱼类之最(农业部渔业渔政管理局, 2015)。然而随着养殖规模与密度的不断扩大, 造成的养殖环境污染以及病害问题也相继出现, 已成为阻碍大黄鱼产量提高, 养殖业稳定发展的主要因素。每年由各类病害造成的经济损失达数亿元人民币, 其中尤以细菌性疾病的危害最大, 不同细菌引起的大黄鱼疾病主要包括溃疡病、内脏结节(白点病)、鳃炎、肠炎等(黄志斌, 1999; 沈锦玉等, 2008; 王程程等,2014), 该病害传播速度快, 致死率极高。因此相关的大黄鱼疾病防治研究工作亟需展开, 首要任务就是研究大黄鱼在养殖阶段出现的病害, 了解其病害的种类和发生规律, 从而为有效防治大黄鱼疾病提供科学依据。2014年7月, 养殖大黄鱼于厦门集美大学海水试验场出现病情。本研究从现场取回患病大黄鱼并进行病原菌的分离、鉴定及相关抗生素药物试验, 旨在弄清大黄鱼致病菌, 并为此病防治提供参考依据。
1 材料与方法
1.1 主要材料与仪器
患病大黄鱼(Pseudosciaena crocea)取自厦门集美海水养殖场, 其典型症状表现为体表皮肤出现点状出血, 表皮鳞片脱落, 严重时出现溃疡, 背、尾鳍出血, 解剖鱼体发现部分肠道有黄色黏液, 肝脏有白色结节。人工感染试验所用吉富罗非鱼(Oreochromis niloticus)购自漳州某罗非鱼养殖场, 体长(13±2)cm,体重(30±2)g。共计70尾。
2216E琼脂培养基、TSA培养基(BR, 山东青海高科园海博生物技术有限公司); GYZ-15eV发酵型革兰氏阴型杆菌生化编码鉴定管、药敏纸片购自杭州天和微生物试剂有限公司; Biolog专用培养基(BUG Agar, Biolog universal Growth Agar); 细菌基因组提取试剂盒、DNA Marker (2000bp)、16S rRNA扩增引物(27F/1492R)、Taq酶(上海捷瑞生物工程有限公司)。
生化培养箱(LRH-250, 上海一恒科技有限公司);Biolog自动微生物鉴定系统(Gen Ⅲ Microstation , 美国 Biolog公司); 酶标仪(1510-00669C, Thermo Scientific); PCR热循环仪(TCA0096, Thermo Scientific); 电泳仪(EPS300, Tanon)。
1.2 试验方法
1.2.1 病原菌的分离 无菌操作解剖鱼体, 取皮肤、鳃、肾脏、肝脏等病变部位于2216E琼脂培养基上划线接种, 28℃培养24h后挑取优势菌于TSA培养基(含1% NaCl)上划线纯化, 并将纯化后的单菌落划线至新鲜TSA斜面上, 28℃恒温培养箱培养24h, 用20%甘油洗下并分装于–80℃超低温冰箱保存备用。
1.2.2 传统表型特征鉴定 将纯化后菌株于 TSA培养基上接种激活, 经革兰氏染色后镜检, 观察菌落大小、形态等。采用GYZ-15eV发酵型生化试剂盒对菌株常规生理生化特征进行鉴定, 并通过 Biolog自动鉴定系统检测菌株对碳源利用的特异性。具体操作参照产品使用说明书。
1.2.3 16S rRNA基因序列分析及系统发育树构建将待测菌株接种于LB肉汤中, 28℃过夜振荡培养24h,置于4℃冰箱保存备用。按照 DNA抽提试剂盒方法提取细菌DNA作为模板。参考已有文献资料(郭松林,2006)的引物及反应条件进行 16S rRNA基因序列扩增。50μL的PCR反应体系为: 10×PCR buffer (with Mg2+15mmol/L) 5μL; 10mmol/μL 的 dNTP 酶 1μL;2.5U/μL 的 Taq DNA 酶 1μL; 12.5μmol/L 正反向引物各1μL; DNA模板 2μL; 加双蒸水至50μL。扩增产物经 1%琼脂糖凝胶电泳验证后, 送至上海生工生物工程有限公司测序。登录NCBI将获得的16S rRNA序列与 GenBank中的已知核酸序列进行同源性比对,用 ClustalX(1.81)软件对与该菌株同源性较高的同属其他菌株序列进行多重序列匹配排列, 之后使用MEGA 5.0软件进行系统发育树的构建, 置信度检测通过自举分析, 自举数据集为1000次。
1.2.4 人工回归感染试验 取70尾体重为(30±2)g健康罗非鱼, 平均分成7组, 每组设置2个平行, 各5尾鱼。其中设置一组为注射生理盐水对照组, 另外 6组为注射不同浓度菌液试验组。将菌株于 TSA琼脂斜面划线纯化培养 8—24h后, 用 0.85%生理盐水冲下制成菌悬液。结合比浊法与平板计数法, 稀释菌液并调至1.33×109CFU/mL, 经10倍梯度稀释后(100、101、102、103、104、105)对各组罗非鱼进行腹腔注射,每尾100μL。连续观察7d, 记录试验鱼的发病及死亡情况, 同时对濒临死亡或刚死亡的鱼进行病原菌的重分离并鉴定。按照Spearman-Karber法(Hamilton et al, 1977)计算菌株对罗非鱼的半致死量(LD50)。
1.2.5 抗生素纸片药敏试验 采用纸片扩散法,用移液枪吸取100μL浓度为108CFU/mL的菌悬液无菌涂布于TSA琼脂平板上, 将镊子灼烧后夹取24种抗生素纸片轻轻贴至平板表面, 倒扣于 28℃恒温培养 24h后测定抑菌圈直径。根据抑菌圈直径的大小,以及《抗菌药物敏感试验执行标准第十九版信息增刊》(CLSI, 2009)说明, 判定菌株对不同抗生素敏感性差异。
1.2.6 中药体外抑菌试验 采用琼脂稀释法, 将搅碎后不同质量的中药超微粉加至经 121℃、20min高压灭菌后的 TSA琼脂培养基中, 配置成不同浓度梯度的含药培养基。每个药物浓度梯度做两组平行试验, 对照组为不加中药的 TSA 琼脂培养基。取 2μL浓度为108CFU/mL菌悬液点种于含药培养基后倒置于28℃恒温箱培养, 分别于24h、48h后记录培养基上菌落的生长情况, 并计算最低抑菌浓度(minimum inhibitory concentration, MIC)及计算最低杀菌浓度(minimum bactericidal concentration, MBC)值。
2 结果
2.1 菌株的分离与鉴定
2.1.1 菌株分离与形态 分离自患病大黄鱼肝脏处菌株9L2置于28℃培养24h后, 在TSA培养基上形成表面隆起, 半透明光滑、圆形、湿润呈液滴状、边缘整齐的灰白色菌落, 直径为1—2mm。
2.1.2 生理生化鉴定结果 菌株 9L2为发酵型革兰氏阴性短杆菌, 具有运动性, 氧化酶、V-P、ONPG试验呈阳性, 能产生吲哚, 利用赖氨酸、枸橼酸盐;不能利用苯丙氨酸、鸟氨酸、尿素酶等。根据菌株9L2与维氏气单胞菌标准株(CECT4199)的GYZ-15eV系统鉴定结果(表 1)可知, 两株菌的常规生理生化特征高度一致。查阅鉴定手册表明, 9L2为维氏气单胞菌, 可信度达到92.46%。
2.1.3 Biolog系统自动鉴定结果 Biolog系统根据不同微生物对碳源利用的特异性及利用碳源过程中发生的氧化-还原反应产生浊度变化模式图, 从而依据“代谢指纹”建立与物种相对应的数据库。因其快速、简便、准确率高等特点, 极大简化了鉴定细菌的步骤以及避免了对未知菌生理生化指标测定时人工操作造成检测误差。本试验 Biolog自动系统鉴定结果表明(表 2), 菌株 9L2为维氏气单胞菌(Aeromonas veronii), 相似性为0.617, 可信度为100%。
2.1.4 16S rRNA基因序列分析 采用PCR扩增出菌株9L2的16S rRNA基因, 经1%琼脂糖凝胶电泳检测结果显示(图 1), 目的条带长度约为 1500bp。经测序获得菌株16S rRNA基因序列登录号(KU525083),通过与NCBI上已知标准基因序列同源性比对后, 发现菌株 9L2与维氏气单胞菌(EU488698)同源性高于99.7%。构建系统发育树(图2)后显示菌株9L2与维氏气单胞菌聚为一支。综上所述, 确定分离菌9L2为维氏气单胞菌(Aeromonas veronii)。
2.2 人工感染试验
菌株 9L2人工感染罗非鱼结果显示(表 3): 攻毒1d后未出现死亡; 第二天开始随着细菌注射量的升高, 死亡数增多。其中注射量为4.43×106CFU/g组罗非鱼在四天内全部死亡, 4.43×105CFU/g与4.43×104CFU/g组罗非鱼在感染 1d后开始死亡, 累计死亡率达到90%。其余三组死亡数随着注射量的梯度降低而减少。对照组的罗非鱼未见异常。对濒死的罗非鱼病原菌进行重分离后发现其生理生化鉴定结果与菌株9L2相同。患病鱼体表现为不进食, 反应迟钝, 体表、尾鳍呈点状出血, 严重时产生溃疡, 解剖后发现肠道有黄色黏液, 肝脏出现白色结节等, 与自然发病大黄鱼的疾病症状相似(图3), 通过Spearman-Karber法计算出菌株 9L2对罗非鱼的半致死剂量(LD50)1.08×103CFU/g。
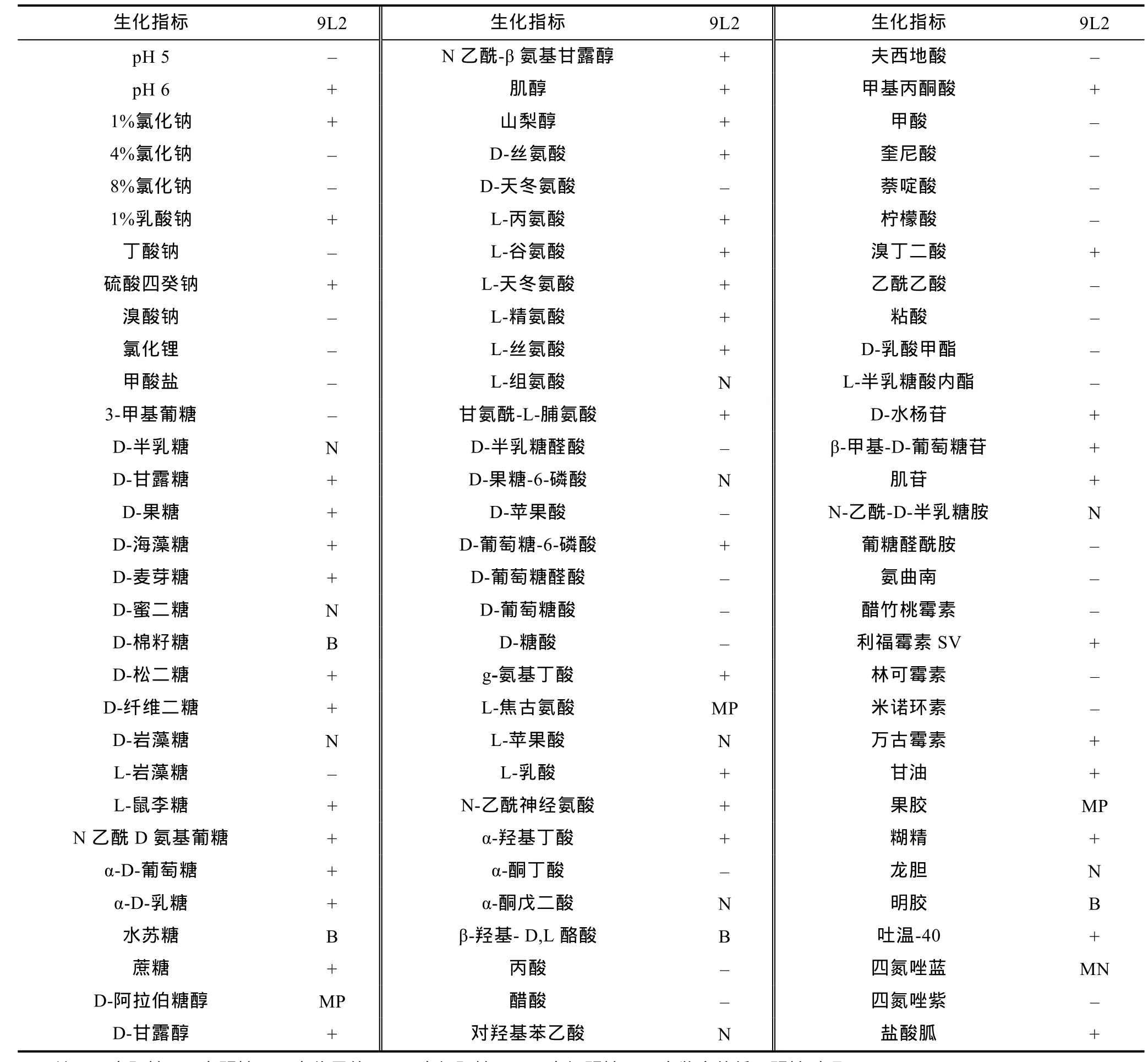
表2 大黄鱼病原菌的Biolog系统鉴定指标结果Tab.2 The result of Biolog system indexes to the strains
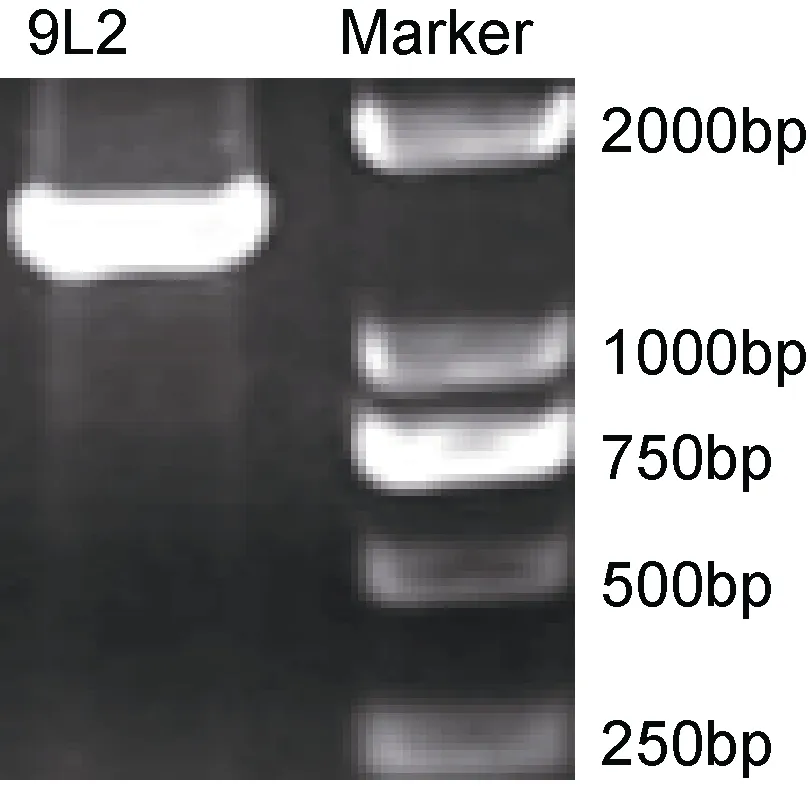
图1 分离菌株16S rRNA基因扩增产物电泳结果Fig.1 Agarose electrophoresis results of 16S rRNA gene fragments of pathogen strains
2.3 药敏试验
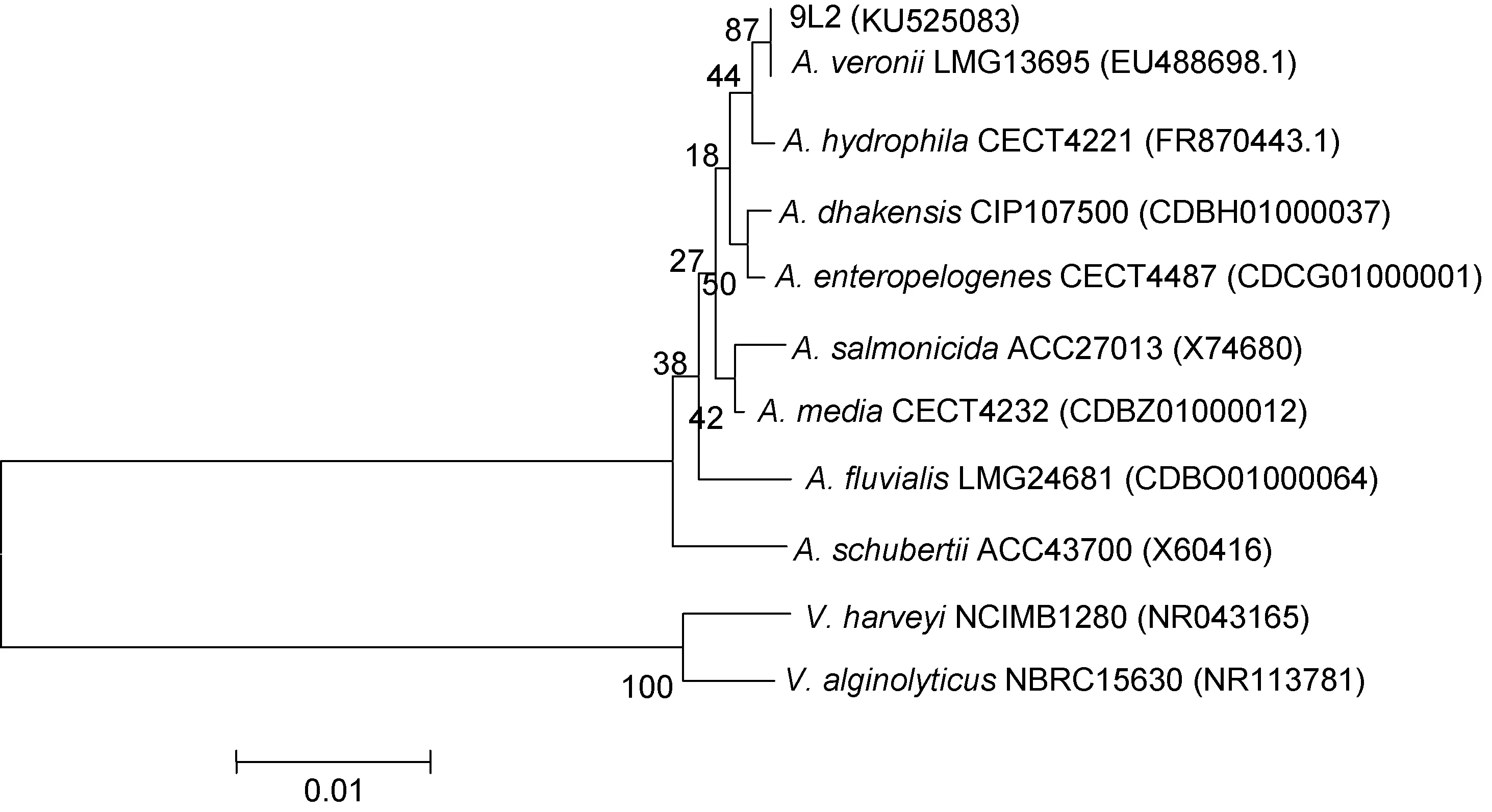
图2 基于气单胞菌的16S rRNA基因的系统发育树Fig.2 Phylogenetic tree of Aeromonas based on 16S rRNA gene注: 括号内为序列登录号

表3 菌株9L2人工感染罗非鱼试验Tab.3 Artificial infection of pathogenic strain 9L2 in healthy O. niloticus
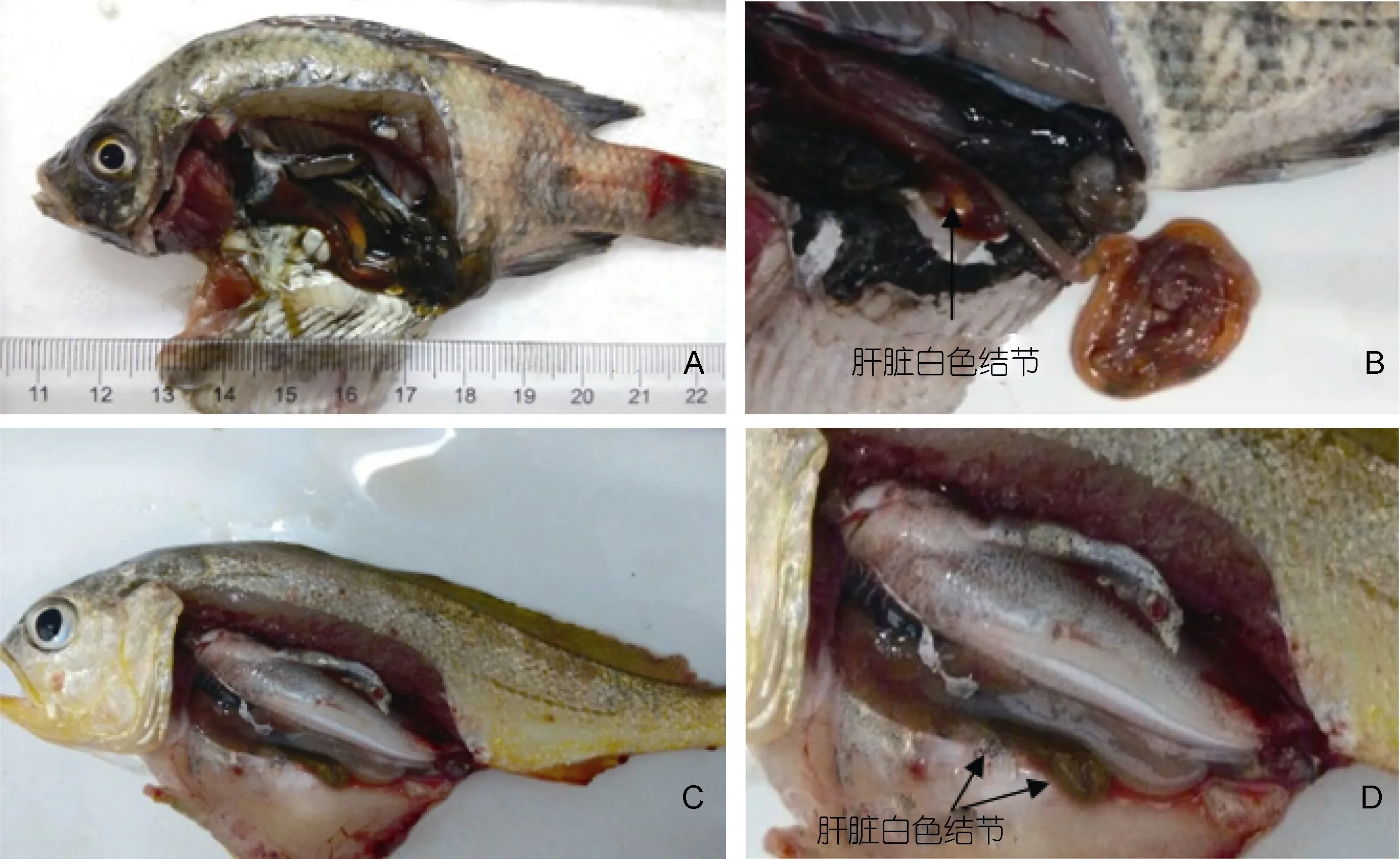
图3 回归感染罗非鱼与患病大黄鱼病症对比Fig.3 Comparison in symptom caused by pathogenic bacteria between O. niloticus and P. crocea注: A. 菌株9L2感染罗非鱼后的解剖图; B. 菌株9L2感染罗非鱼后肝脏出现白色结节; C. 菌株9L2感染大黄鱼后的解剖图; D. 菌株9L2感染大黄鱼后肝脏出现白色结节

表4 致病菌9L2对24种抗生素药物的抑菌试验结果Tab.4 Sensitive results of pathogen bacteria 9L2 to 24 antibiotics
菌株9L2对诺氟沙星、阿莫西林、链霉素、庆大霉素、复方新诺明、四环素、万古霉素、强力霉素、新生霉素、萘啶酸、头孢曲松、呋喃妥等12种药物高度敏感, 占总数的50%; 对洛美沙星、头孢拉定、乙酰螺旋霉素、卡那霉素、头孢他啶等5种药物中度敏感, 占总数的 20.8%; 对利福平、氨苄西林、青霉素、头孢噻吩、头孢唑林、阿米卡星、哌拉西林等7种药物产生耐药性, 占总数的29.2%(表4)。
2.4 中药体外抑菌试验
不同中药对致病菌 9L2的体外抑菌试验结果表明(表5): 20种中药中有11种对致病菌的体外抑菌及杀菌作用效果较好, 最低抑菌浓度范围为 0.11—7.20mg/mL, 最低杀菌浓度为0.11—7.20mg/mL。其中五倍子、黄芩及地榆针对致病菌的抑菌效果最佳,其平均抑菌浓度、平均杀菌浓度均低于1mg/mL, 分别为0.11、0.90、0.90mg/mL; 黄连、丁香、石榴皮、大黄、虎杖、诃子等 6种中药对致病菌的抑菌效果较好, 最低抑菌浓度范围在 1.80—3.60mg/mL之间;另外 2种中药苦楝及鱼腥草效果次之, 最低抑菌浓度、最低杀菌浓度均为7.20mg/mL。其余10种中药效果较差, 平均抑菌浓度及平均杀菌浓度均大于10mg/mL。
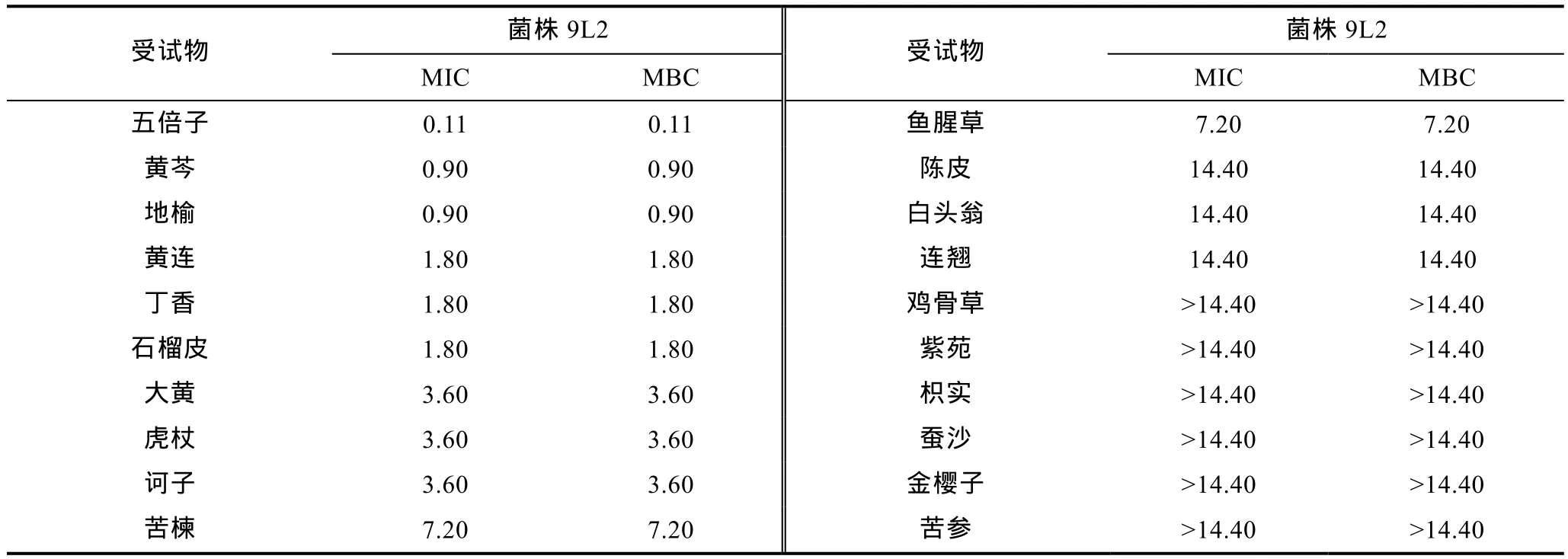
表5 20种中药对致病菌9L2的体外抑菌效果(mg/mL)Tab.5 The inhibitory effect of 20 Chinese herbs on pathogen strain 9L2 (mg/mL)
3 讨论
3.1 分离菌株的鉴定
表型鉴定法和分子遗传学鉴定法作为细菌鉴定的两大类被广泛应用于食品安全、医疗卫生以及科学研究等领域。本研究自患病大黄鱼肝脏处分离得到一株致病菌, 经传统表型特征及16S rRNA基因序列分析, 确定该菌株为维氏气单胞菌。
目前针对传统生理生化特征鉴定, 国际上普遍采用的是《伯杰氏细菌系统分类学手册》。该书作为分类鉴定法的基本依据, 提供了已报道菌株的种属描述, DNA相关性等分类学特性。但由于细菌的生理生化特征有近百种, 且表型的表达不稳定, 敏感性不高, 导致需测试的指标多, 费时费力。因此基于计算机数理统计的自动化鉴定系统应运而生。例如Biolog自动化系统鉴定是基于碳源利用图谱开发的一套微生物鉴定系统。因其数据库全面、鉴定范围广、标准自动化程度高等优势, 已成为鉴定细菌等领域中的常用技术手段(冯瑞华等, 2000; 张朝正等, 2009)而被广泛应用。Sellami等(2011)对108株临床医学上对人类产生致病性的气单胞菌属进行 Biolog系统鉴定,通过与API20E试剂盒鉴定结果、功能基因RpoB鉴定结果相比较, 表明 Biolog鉴定结果具有快速可靠等优点; 王荣华等(2015)通过对水产动物斑点叉尾肠套叠病病原菌进行鉴定, 比较了 Biolog系统鉴定及16S rRNA基因序列分析鉴定结果具有高度一致性;然而由于细菌鉴定的可靠性受多方面的影响, 利用Biolog系统鉴定细菌时仍需注意其对不常见分离菌的鉴定效果较差, 易受到不利因素的影响(如细胞受损), 系统数据库覆盖范围需不断更新以保证鉴定菌种的准确性(吴会桃等, 2010)。同时由于国内尚未开发专门应用于水产动物细菌鉴定的自动化鉴定系统,导致Biolog成本高, 不利于基层应用推广。
鉴于传统表型特征鉴定法耗时、准确性易受多方面因素影响的缺陷。利用分子遗传学鉴定法从核酸水平出发, 极大地为传统分类学鉴定起到补充作用。16S rRNA基因存在于所有生物中, 在结构与功能上具有高度的保守性, 物种间的差异体现在高变序列区域。其序列特征为近缘种的分类奠定了分子生物学基础, 因而广泛应用于菌种鉴定和系统发生学研究。研究表明16S rRNA基因能准确鉴定菌株的属, 不过在种间由于基因的高度保守性而受到限制(Martin-Carnahan A et al, 2005)。因此在鉴定细菌的过程中,仅靠一种方法是不够的, 必须综合几种方法才能准确对菌株进行判定。
3.2 维氏气单胞菌毒力分析
人工回归感染试验证实菌株 9L2对罗非鱼具有强致病力, 感染后的罗非鱼主要症状与与自然患病的大黄鱼临床表现大体一致, 根据科赫法则可证实菌株9L2为患病大黄鱼的致病菌。半致死剂量的大小是衡量微生物毒力强弱的重要指标, 但影响半致死剂量的因素有很多。比如微生物自身毒力, 受试动物的个体、种类、健康状况等。本研究虽然测定出分离自大黄鱼病灶处致病菌的半致死剂量, 但因受条件限制, 选择了罗非鱼作为代替鱼。因此不能认为这些菌株对大黄鱼的半致死剂量与罗非鱼相同, 且菌株的致病机理还有待进一步研究。
3.3 分离菌的药物敏感性分析
抗生素是水产养殖过程中重要的防治细菌性疾病药物, 主要包括氨基糖苷类、青霉素类、喹诺酮类、头孢类等。抗生素在抑制叶酸代谢、细菌细胞壁合成等方面有显著效果。但随着长期低剂量的使用, 导致菌株耐药性的产生。本研究中24种抗生素对致病菌9L2的药敏试验表明, 该菌对诺氟沙星、阿莫西林、链霉素等 12种药物高度敏感; 对洛美沙星、头孢拉定、乙酰螺旋霉素等5种药物中度敏感; 对利福平、氨苄西林、青霉素等7种药物产生耐药性。这与夏飞等(2012)、黎炯等(2011)研究结果有所差异, 可能是由于菌株在分裂繁殖及针对药物不断选择性进化的过程中, 已对大部分抗生素产生耐药性, 另外不同宿主来源、区域分布及菌株数量极大影响着细菌对抗生素的耐药性。因此在实际生产中应充分考虑菌株耐药机制, 科学合理用药, 避免诱导致病菌产生对抗菌药物的广泛耐药性, 同时需在国家渔业用药准则(中华人民共和国农业部, 2002)许可的条件下, 有针对性地选择大黄鱼细菌性疾病防治药物。另外, 为确保水产养殖业的可持续发展, 应加强无耐药性、无残留的替代品的研发以取代抗生素。
中药具有低毒、无残留、不易产生抗药性等特点,所含有效成分包括生物碱、鞣质、糖类、甙类、氨基酸、蛋白质等。这些成分具有明显抑菌作用, 且对机体免疫状态的改善, 自身抗菌能力的提高有积极作用, 可作为代替抗菌药物应用于水产养殖防治细菌性疾病。本试验通过研究20种中药对大黄鱼致病维氏气单胞菌的体外抑制作用, 表明 11种中药的体外抑菌及杀菌效果较好, 平均抑菌浓度为 0.11—7.20mg/mL。这与马志宏等(2011)研究结果有所差异,分析原因可能是因为中药加工方式不同。该试验所用中药为经水提取浓缩后的浸膏物, 有利于中药的有效成分充分融入水中。其次菌株的血清型及分离源、中药的采集地及药用部位、提取方法等多种因素也可能对药敏试验结果产生影响。另外, 在实际生产中,常利用不同中药间的相互协同作用, 将具有抑菌作用的中药组合成复方, 更有效地发挥中药的抑菌作用, 从而达到防治维氏气单胞菌等引起的细菌性疾病目的。马志宏, 李铁梁, 姜 娜等, 2011. 中草药对致病性维氏气单胞菌体外抑菌活性及最优组方研究. 中国畜牧兽医, 38(6):155—159
马志宏, 杨 慧, 李铁梁等, 2009. 西伯利亚鲟(Acipenser baerii)致病性维氏气单胞菌的分离鉴定. 微生物学报,49(10): 1289—1294
王荣华, 刘 佩, 刘小燕等, 2015. 斑点叉尾致病性鲁氏耶尔森氏菌的分离鉴定. 科学养鱼, (12): 55—56
王程程, 鄢庆枇, 黄伟卿等, 2014. 福建三沙湾养殖大黄鱼肠道菌群研究. 集美大学学报(自然科学版), 19(1): 1—6
中华人民共和国农业部, 2002. NY5071-2002. 无公害食品渔用药物使用准则. 北京: 中国标准出版社
冯瑞华, 樊 蕙, 李 力等, 2000. Biolog细菌自动鉴定系统应用初探. 微生物学杂志, 20(2): 36—38
朱成科, 向 桢, 叶 华等, 2013. 黄颡鱼致病性维氏气单胞菌
的分离鉴定. 西南大学学报(自然科学版), 35(5): 37—42农业部渔业渔政管理局, 2015. 2014年中国渔业统计年鉴. 北京: 中国农业出版社
李辉华, 王广军, 2001. 常用渔业的种类、使用现状及规范化管理. 河北渔业, 1: 21—23
杨求华, 郭松林, 关瑞章等, 2012. 鳗鲡病原性维氏气单胞菌的分离与鉴定. 生物技术通报, (7): 134—139
吴会桃, 蔡芷荷, 吴清平等, 2010. 细菌鉴定系统的应用研究进. 见: 2010第二届中国食品安全高峰论坛论文集. 广州:广东省微生物研究所, 199—204
沈锦玉, 余旭平, 潘晓艺等, 2008. 网箱养殖大黄鱼假单胞菌病病原的分离与鉴定. 海洋水产研究, 29(1): 1—6
张朝正, 郭兰珍, 黎 明等, 2009. Biolog微生物鉴定系统中接种液的替代. 生物技术通讯, 20(6): 836—838
房 海, 陈翠珍, 张晓君等, 2008. 中华绒螯蟹病原维氏气单胞菌的检验. 中国人兽共患病学报, 24(1): 45—49
胡梦红, 2006. 抗生素在水产养殖中的应用、存在的问题及对策. 水产科技情报, 33(5): 217—221
夏 飞, 梁利国, 谢 骏, 2012. 异育银鲫病原维氏气单胞菌的分离鉴定及药敏试验. 淡水渔业, 42(5): 22—26
郭松林, 2006. 鳗鲡病原菌的分类鉴定及相关免疫基础研究.武汉: 中国科学院水生生物研究所博士学位论文
黄志斌, 蔡其良, 余德光等, 1999. 大黄鱼几种暴发性疾病及防治方法新探. 福建水产, (4): 66—70
康元环, 孟庆峰, 夏京津等, 2014. 乌鳢致病性维氏气单胞菌的分离鉴定及生物学特性研究. 动物医学进展, 35(5):40—43
简 灯, 2015. 维氏气单胞菌分离鉴定及其灭活疫苗免疫效应的研究. 重庆: 西南大学硕士学位论文
黎 炯, 叶 星, 卢迈新等, 2011. 罗非鱼维氏气单胞菌的分离鉴定和药敏试验. 水生态学杂志, 32(3): 132—136
CLSI, 2009. CLSI document M100-S19 Performance standards for antimicrobial susceptibility testing: nineteenth informational supplement. Wayne, PA: Clinical and Laboratory Standards Institute, 34—38
Hamilton M A, Russo R C, Thurston R V, 1977. Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays. Environmental Science& Technology, 11(7): 714—719
Martin-Carnahan, Joseph S W, Genus I, 2005. Aeromonas stanier 1943, 213 Bergey’s Manual of Systematic Bacteriology.New York: Springer, 557—578
Sellami N L, Chernine S, Counoyer B et al, 2011. The Biolog system and the gallery api20e in identifying Aeromonas Original Clinic. Annals of Biological Research, 2(3): 4—6
