一株许氏平鲉(Sebastes schlegelii)肠道乳酸菌的分离鉴定及特性分析*
2018-01-22王腾腾韦秀梅韩慧宗姜海滨
王腾腾 韦秀梅 常 城 韩慧宗 姜海滨①
(1. 上海海洋大学水产与生命学院 上海 201306; 2. 山东省海洋资源与环境研究院山东省海洋生态修复重点实验室烟台 264006)
乳酸菌(Lactic acid bacteria)是一类不运动、无芽孢、能利用碳水化合物发酵并产生大量乳酸的革兰氏阳性细菌的统称(张刚, 2007)。因其具有绿色安全、无毒副作用、无残留的特点, 在海水鱼养殖业中具有广阔的应用前景。章蔚(2012)发现用分离获得的明串珠菌属乳酸菌投喂黑鲷幼鱼, 可以提高幼鱼肠道菌群多样性、促进幼体肠道的生长发育; Gatesoupe等(1994)以乳杆菌强化的活体轮虫作为大菱鲆幼体的食物, 证实了乳酸菌的使用可以提高幼鱼成活率; 王福强(2005)用鼠李糖乳杆菌P15投喂牙鲆稚鱼, 达到了降低水中和牙鲆消化道中弧菌数量、提高成活率、促进生长的效果。以上研究证明, 乳酸菌可以促进海水鱼类生长、提高成活率, 在海水鱼养殖业的应用有望减少抗生素使用, 促进海水鱼养殖业健康和可持续发展。
许氏平 鲉 (Sebastes schlegelii)是我国黄渤海区域习见的鱼类之一, 因其肉质鲜美、营养丰富、抗逆性强、生长迅速, 已成为北方沿海网箱养殖和人工放流的重要经济鱼类。随着养殖规模的扩大, 病害问题日益突出, 许氏平鲉养殖业的发展受到制约。从许氏平鲉肠道中分离乳酸菌等益生菌, 对于研制有效的微生态添加剂, 提 高许氏平 鲉 抗病能力具有重要的现实意义。目前国内外对许氏平 鲉 的研究主要集中在繁殖生物学(冯东岳等, 2003)、发育生物学(杨艳萍等,2012; 蔺玉珍等, 2014; 马丽曼, 2014)等方面, 对其肠道微生物的研究非常有限, 肠道乳酸菌分离鉴定和特性分析的研究更未见报道。本研究首次从野生许氏平 鲉 肠道内分离获得了一株乳酸菌, 采用 16S rDNA基因序列分析法对其进行了分类鉴定, 并对其生长特性、抑菌特性及动物安全性进行了研究, 旨在为筛选能够提高许氏平 鲉 免疫力和抗病能力、促进其生长的乳酸菌提供理论依据, 从而为研发适用于许氏平 鲉 养殖业的微生态制剂奠定基础。
1 材料与方法
1.1 实验动物
海捕野生许氏平 鲉 体长 17.51cm, 购于烟台市迟家农贸市场, 用 于乳酸菌的分离。健康许氏平 鲉 体长9.87±1.73cm, 由烟台泰华海珍品有限公司提供, 用于乳酸菌的安全性检测实验。
1.2 细菌分离纯化
用 70%的酒精擦拭鱼体腹部表面, 在无菌条件下解剖, 剪下中肠段; 去除肠道内容物, 以无菌生理盐水冲洗2次后, 用解剖刀刮取肠道内壁的黏液, 加入到无菌生理盐水中, 涡旋振荡摇匀后均匀涂布于MRS固体培养基。30°C无氧条件下培养至出现菌落,再重复平板划线分离出单菌落。挑取单菌落 30°C扩繁后保种于甘油中。
1.3 细菌鉴定
1.3.1 菌落形态观察及生理生化特征鉴定 将保种的菌株接种于 MRS培养基中, 培养24h后观察菌落形态、颜色等。挑取菌落进行革兰氏染色和脱脂乳试管凝固试验。将培养到指数期的菌株经戊二醛(2.5%)固定、磷酸缓冲液(pH7.4)漂洗、酒精梯度脱水和叔丁醇重悬后制作玻片, 通过扫描电镜观察其形态特征; 以梅里埃 API 50CHL试剂条进行生理生化测试, 对分离获得的细菌进行初步鉴定。
1.3.2 细菌 16S rDNA基因序列分析 采用 16S rDNA基因序列分析的方法对初步鉴定的细菌进行分子鉴定。扩增引物序列为: 8F-5′AGAGTTTGATCCTG GCTCAG3′, 1492R-5′GGCTACCTTGTTACGACTT3′。反应体系为 50μL, 其中包括: 正、反向引物(10mmol/L)各 2μL, 2μL 分离菌菌液, 0.4μL Taq 酶,5μL 10×PCR Buffer (Mg2+), 4μL dNTPs, 34.6μL ddH2O。序列扩增反应条件为: 94°C 5min; 94°C 30s,55°C 30s, 72°C 2min, 30 个循环; 72°C 10min。PCR 产物经 10g/L琼脂糖凝胶电泳检测后, 送至英潍捷基(上海)贸易有限公司北京测序实验室进行测序。测序结果用BLAST软件与GenBank核酸数据库中所收集的相关种属的16S rDNA序列进行同源性分析。
1.4 生长特性分析
1.4.1 pH对生长的影响 取100μL培养至指数期的菌悬液接种于终pH值分别为3.2、4.2、4.9、5.7、6.5、7.2、8.4、8.8、9.1、9.4、9.6、10.3 的 MRS 培养基中, 30°C培养24h后检测600nm的光密度, 并测定培养基的最终pH值。每个实验组设三个平行。采用SPSS软件包单因素方差分析法(one-way ANOVA)中的 Duncan多重比较检验法进行数据分析, 再利用Origin 8.0软件作图。
1.4.2 温度对生长的影响 取 100μL培养至指数期的菌悬液接种到MRS培养基中, 分别置于5、10、15、20、25、30、35、40、45和 50°C 下培养 24h, 检测 600nm的光密度。每个实验组设三个平行。数据分析和作图方法同上。
1.4.3 NaCl含量对生长的影响 取100μL培养至指数期的菌悬液接种于NaCl含量(w/v%)为0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9、10的MRS培养基中, 30°C培养24h后检测600nm的光密度。每个实验组设三个平行。数据分析和作图方法同上。
1.5 抑菌作用分析
采用平板扩散法检测乳酸菌产物的抑菌作用。选取金黄色葡萄球菌、嗜水气单胞菌、大肠杆菌、溶藻弧菌、副溶血弧菌、迟钝爱德华氏菌、鳗弧菌、假交替单胞菌和哈维氏弧菌作为指示菌。指示菌培养至指数期后加入到未冷凝的固体培养基中, 待培养基凝固后制作直径 5mm的加样孔。乳酸菌置于37°C、200r/min振荡培养12h至指数期后, 10000r/min离心5min, 取200μL上清液加入指示菌平板的加样孔中, 对照组加等量的MRS液体培养基, 30°C培养24—48h后观察和测量抑菌圈大小。每种指示菌设三个平行。
1.6 安全性检测
安全性检测实验参照El-Rhman等(2009)、Aly等(2008)的 方法设计。选取健康许氏平 鲉 40尾, 分4组,每组 10尾, 暂养于 70L玻璃缸内, 水温 15±1°C。日换水1次, 每次换水1/5; 连续充气, 不投喂食物, 及时清理粪便; 暂养一周后用于实验。乳酸菌在 37°C,200r/min条件下振荡培养 12h至指数期后,10000r/min离心5min, 用0.65%的无菌生理盐水重悬至108CFU/mL。
第1 组 许氏平 鲉 每尾肌肉注射100μL菌悬液, 第2组每尾肌肉注射100μL0.65%无菌生理盐水为对照;第3组每尾腹腔注射1000μL菌悬液, 第4组每尾腹腔注射相同剂量的0.65%无菌生理盐水为对照。每组设三个平行。注射后连续观察 10天, 统计各组许氏平 鲉 的生长和死亡状况。
2 结果与分析
2.1 细菌的鉴定结果
2.1.1 初步鉴定结果 实验共分离纯化出35株肠道菌, 通过细菌生化测试实验, 选取革兰氏染色呈阳性, 脱脂乳试管凝固试验中牛乳出现凝固、无气泡、呈酸性现象的一株细菌初步鉴定为乳酸菌, 命名为YH1。该菌株的菌落呈白色、圆形、表面光滑、边缘圆润。扫描电镜结果如图 1所示, 乳酸菌 YH1细胞形状规则, 呈杆状, 无鞭毛, 表面较光滑, 长度约为1.87μm、宽度约为0.69μm。菌株YH1的生理生化特征描述如表1所示。
2.1.2 16S rDNA序列分析结果 采用PCR仪扩增细菌YH1的16S rDNA基因获得大小为1456bp的片段, 将该序列提交到GenBank核苷酸序列数据库, 登陆号为KX440974.1。16S rDNA序列比对结果显示:菌株 YH1与食窦魏斯氏菌(Weissella cibaria)CH2(CP012873.1)的相识度为 99%, 与食窦魏斯氏菌JCM7777(AB911503.1)的相识度为 99%, 与食窦魏斯氏菌 CAG13(AB572036.1)的相识度为 99%, 属魏斯氏菌属成员; 结合其形态学和生理生化特征, 确定菌株YH1为食窦魏斯氏菌YH1。
2.2 YH1的生长特性研究结果
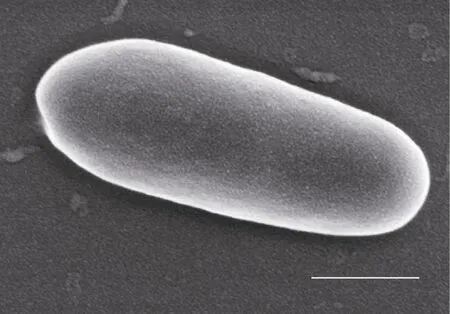
图1 YH1的扫描电镜图(标尺=500nm)Fig.1 Scanning electron micrograph of Strain YH1

表1 YH1的生理生化特征鉴定结果表Tab.1 Physiological and biochemical characteristics of strainYH1
2.2.1 不同pH值下 YH1的生长情况 食窦魏斯氏菌YH1在初始pH为4.2—8.8的培养基下均能生长,但生长情况存在明显差异。在初始pH为4.2—8.4的培养基中, 随着初始 pH的升高, 培养液在实验终止与初始时的 OD600差值不断增加, 在初始 pH为7.2—8.4处达到最大, 说明在该pH范围下YH1生长情况最好; 在 8.4—8.8内, 培养液的 OD600差值有所下降。当培养基初始 pH过低(pH=3.2)或者过高(pH=9.1、9.4、9.6、10.3), YH1几乎不生长(图 2)。不同pH条件下YH1生长24h后, 培养基pH的变化结果如图3所示, 初始pH4.9—8.8的培养液发酵24h后的 pH均发生了明显变化, 且随着初始 pH的不断增大, 24h后的pH降幅越大; 初始pH过低(pH=3.2)或者过高(pH=9.1、9.4、9.6、10.3), 培养基的 pH无变化(图 3)。
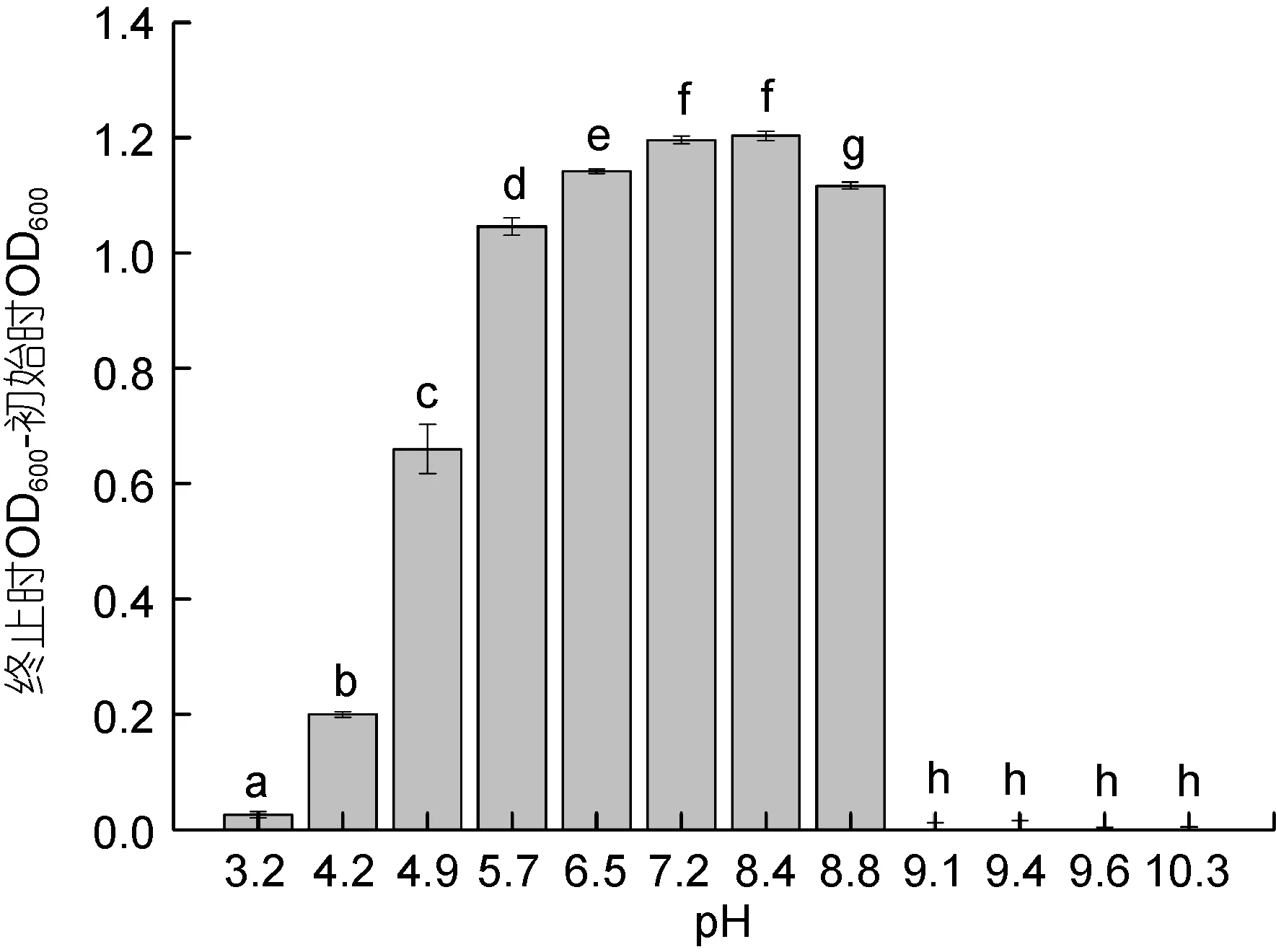
图2 不同pH条件下YH1的生长情况Fig.2 The growth of YH1 in various pH注: 所有数据按照平均值±标准差(n=3)表示。不同字母表示两组间YH1生长情况差异显著(P<0.05)。
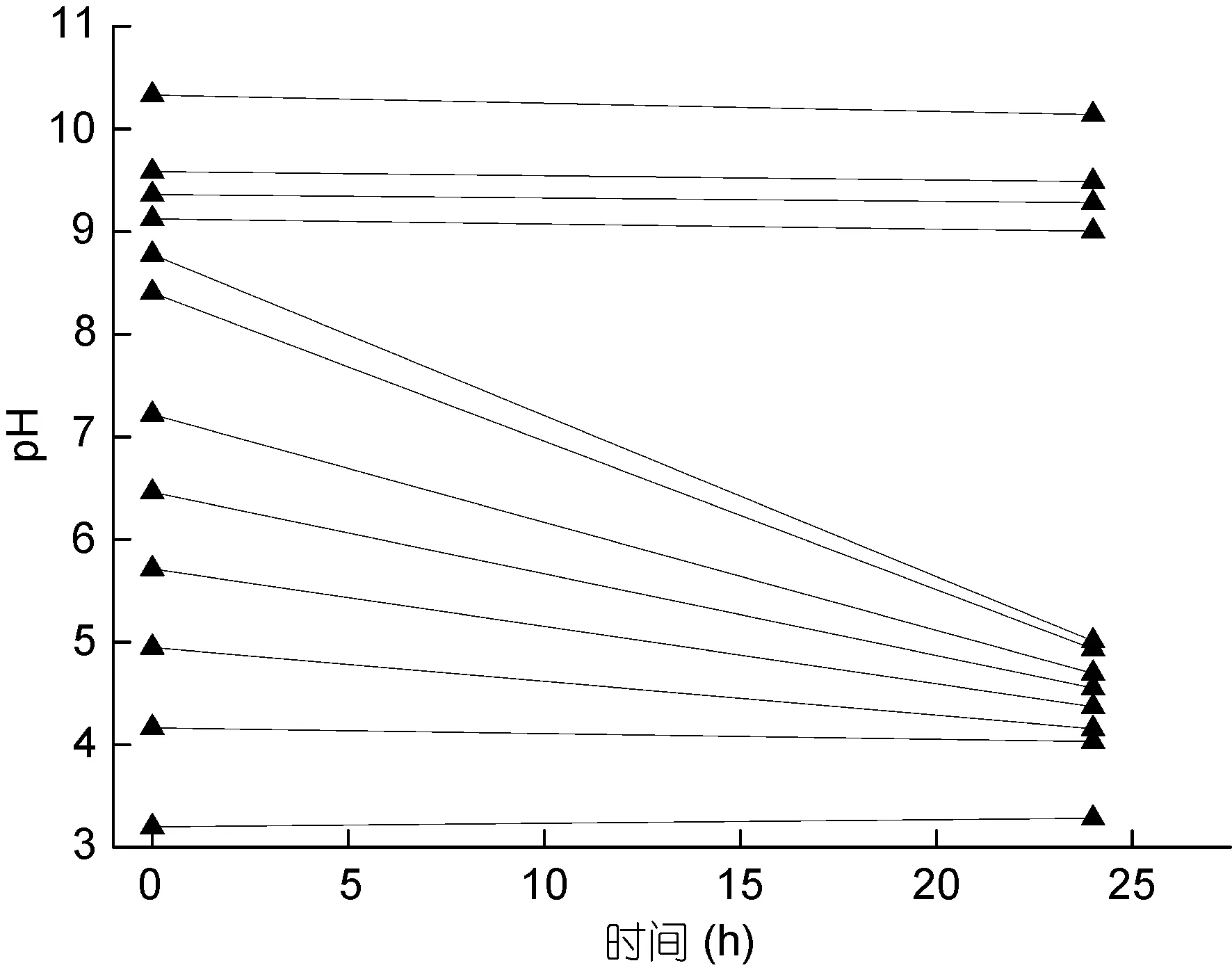
图3 不同pH条件下YH1生长24h培养基pH的变化Fig.3 The variations of medium pH after 24h culture under different initial pH
2.2.2 不同温度下YH1的生长情况 食窦魏斯氏菌 YH1在 15—45°C 均能生长, 其中最适生长温度35°C, 且各温度下YH1的生长情况存在显著差异。在15—35°C, 随着培养温度的升高, YH1培养液在实验终止与初始时的OD600差值逐渐增大, 在35°C时达到最大值, 为0.979。当培养温度大于35°C时, YH1培养液在实验终止与初始时的OD600差值逐渐降低。当培养温度过低(T=5°C、10°C)或温度过高(50°C)时,YH1培养液在实验终止与初始时的 OD600差值最低,YH1几乎不生长(图4)。
2.2.3 不同NaCl含量下YH1的生长情况 食窦魏斯氏菌YH1在NaCl含量(w/v%)为0—10的MRS培养基中均能生长。随着NaCl含量的升高, YH1培养液在实验终止与初始时的OD600差值逐渐降低, 说明向MRS培养基中添加NaCl会抑制YH1的生长。不同NaCl含量条件下YH1生长情况的差异性如图5所示。
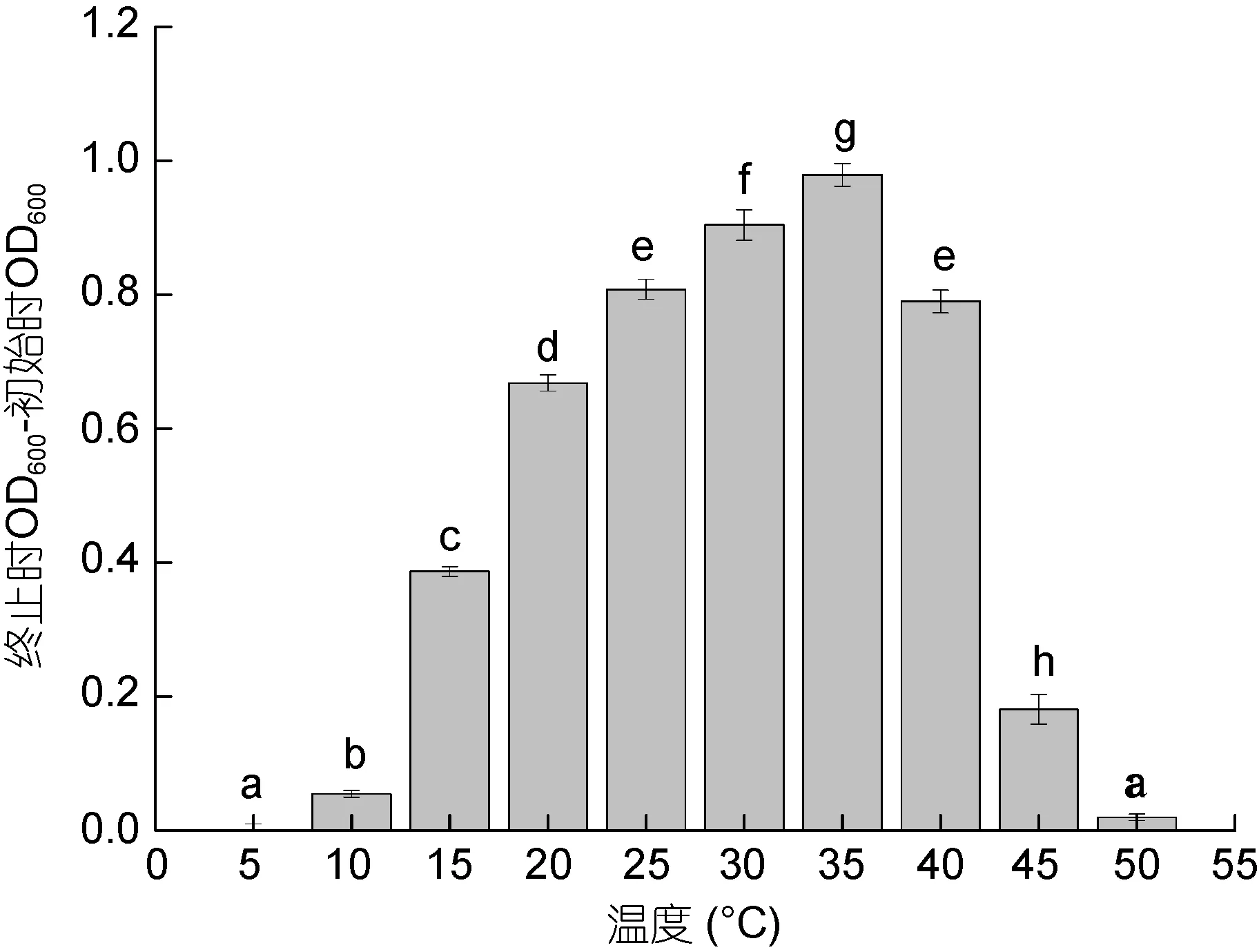
图4 不同温度下YH1的生长情况Fig.4 The growth of YH1 in various temperatures注: 所有数据按照平均值±标准差(n=3)表示。不同字母表示两组间YH1生长情况差异显著(P<0.05)。
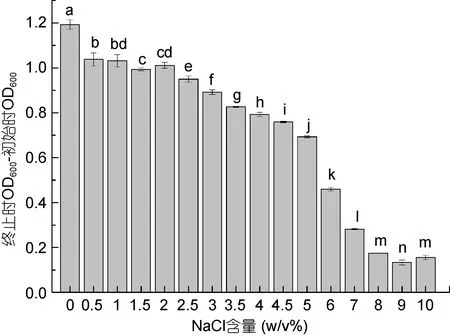
图5 不同NaCl含量下YH1的生长情况Fig.5 The growth of YH1 vs. concentration of NaCl注: 所有数据按照平均值±标准差(n=3)表示。不同字母表示两组间YH1生长情况差异显著(P<0.05)。
2.3 YH1产物的抑菌活性
分析 YH1产物的抑菌活性发现, 该产物对金黄色葡萄球菌、嗜水气单胞菌、溶藻弧菌、副溶血弧菌、迟钝爱德华氏菌、鳗弧菌、假交替单胞菌、哈维氏弧菌等指示菌均有抑制作用, 可形成直径为 11—21mm的抑菌圈(表2)。其中YH1的产物对假交替单胞菌和鳗弧菌的抑菌效果如图6所示。YH1的产物具有广谱抑菌性。。
2.4 YH1对许氏平鲉的安全性
以108CFU/mL 浓 度向许氏平 鲉 体内注射YH1并未引发鱼体发病或死亡, 表明YH1在108CFU/mL及以下浓度对 许 氏平 鲉 是相对安全的(表3)。
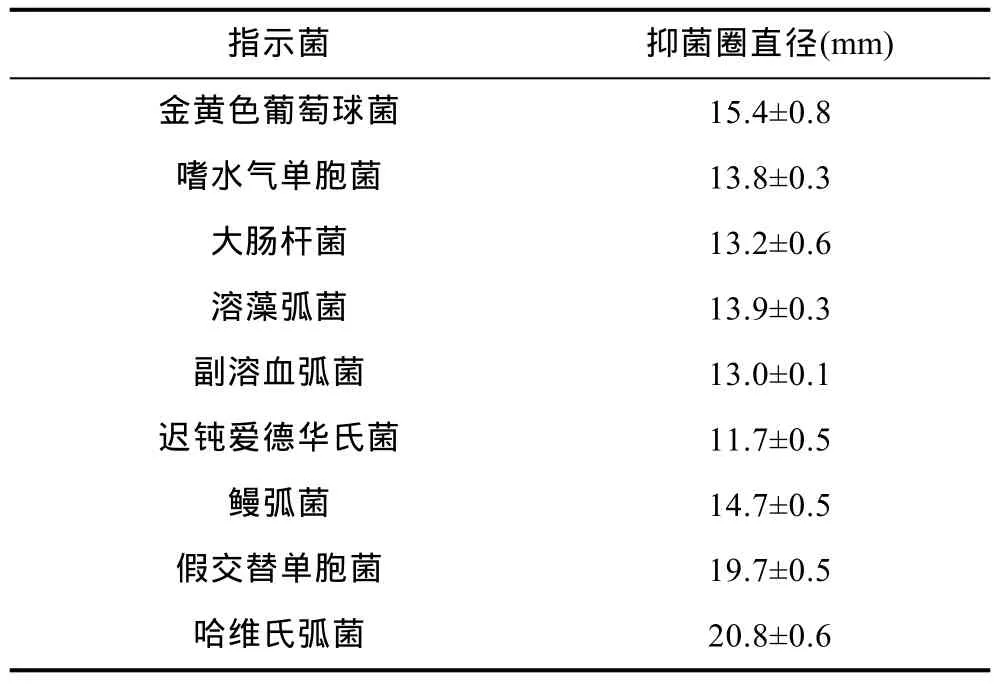
表2 YH1产物对指示菌的抑菌活性Tab.2 Antimicrobial activity of YH1's supernatant on indicatorbacteria

表3 YH1对许氏平鲉的安全性Tab.3 Safety test on YH1 to S. schlegelii
3 讨论
近年来, 对于鼠李糖乳杆菌(王福强, 2005)、明串珠球菌(章蔚, 2012)等常见乳酸菌的研究发现, 乳酸菌可以改善养殖水域环境、提高养殖鱼类免疫力。这些研究为从海水鱼类肠道分离的乳酸菌进一步应用于海水鱼类养殖奠定了基础。魏斯氏菌作为一种不常见乳酸菌, 对其的研究相对较少。本研究从野生海捕的许氏平 鲉 肠道内分离获得了一株特征明显的乳酸菌菌株。通过革兰氏染色、形态观察、脱脂乳试管凝固试验、生理生化指标检测和16S rDNA基因序列分析, 发现该株细菌为魏斯氏菌属成员, 确定为食窦魏斯氏菌YH1。
pH、温度和NaCl含量是影响细菌生长的重要因素, 探究细菌的生长特性对掌握其最适培养条件具有重要意义。食窦魏斯氏菌 YH1的生长特性研究表明, 其最适培养条件为: pH 7.2—8.4、温度35°C。向MRS培养基中添加 NaCl, YH1的生长受到抑制, 这一结果与王福强(2005)对于鼠李糖乳杆菌P15的研究结论相同。在探究不同pH值条件下生长情况的实验中, 食窦魏斯氏菌YH1在初始pH值为4.6—8.8条件下均能生长, 在7.2—8.4条件下生长最好, 且通过测定培养24h后各培养基的酸碱度发现, YH1生长使培养基的pH值明显下降, 并趋于4.0。YH1在碱性条件下生长的过程中产酸降低了培养基的pH值, 形成了有利的生长环境, 从而促进了自身的生长; 同时YH1生长的产物又降低了环境的 pH值, 形成了良性循环。因此在不同初始pH环境下, YH1的生长情况趋向一致。
乳酸菌通过竞争营养、附着位点或分泌细菌素等毒素的方式杀死或抑制病原微生物, 有效调节鱼类胃肠中的菌群平衡, 增强鱼体抗感染能力, 提高免疫力和存活率(张艳婷等, 2012)。杨莺莺等(2005)以溶藻弧菌和鲨鱼弧菌为指示菌探究了乳酸杆菌的抑菌性,结果表明乳酸杆菌及其代谢物质对弧菌具有协同抑制作用。本研究结果显示, 食窦魏斯氏菌 YH1的产物不仅能抑制溶藻弧菌、副溶血弧菌、鳗弧菌、哈维氏弧菌、假交替单胞菌、迟钝爱德华氏菌、嗜水气单胞菌等革兰氏阴性病原菌的生长, 也对金黄色葡萄球菌等革兰氏阳性病原菌的生长有抑制效果。YH1表现出广谱抑菌活性, 暗 示其能在许氏平 鲉 抵御多种病原菌的过程中发挥作用, 作为益生菌添加可能提高许氏平 鲉 对抗病原菌侵染的能力。乳酸菌YH1的广谱抑菌作用为其在海水养殖中的应用提供了前提。
乳酸菌的抑菌作用机理一直都是研究热点。杨勇(2006)探究了抑制鳗弧菌生长的乳酸菌产物, 推测乳酸菌代谢产物对鳗弧菌的抑制作用是由其中的乳酸或乙酸等有机酸造成的, 而不是乳酸菌素类物质。陈营等(2002)的研究认为乳酸菌的抑菌机制主要是分解糖类产生乳酸, 降低环境中的 pH值, 抑制其他细菌的生长。本研究在分析食窦魏斯氏菌YH1在不同pH环境下的生长情况时发现, YH1可显著降低环境 pH值, 推测YH1产酸降低环境pH值可能是其抑制病原指示菌生长的方式之一, 但其抑菌机制还需要进一步的研究。
益生菌是一类对机体健康有益且无致病性的微生物。益生菌的安全性检测是其投入生产应用前确保其对机体无致病性的必要测试。El-Rhman等(2009)在探究藤黄微球菌和假单胞菌对尼罗罗非鱼生长性能和健康的促进作用前先验证了这两株细菌在罗非鱼机体内的安全性。吕利群等(2010)在检测解淀粉芽孢杆菌 Sh1的动物安全性试验中指出, 腹腔注射1×108CFU/mL的 Shl对草鱼的生长没有任何不良影响。Kim 等(2006)将从虹鳟肠道分离出的Carnobacterium maltaromaticum B26菌株和广布肉杆菌Carnobacterium divergens B33菌株腹腔或肌肉注射鱼体或者投喂含二菌株的饲料均无毒性。本研究中动物安全性检测实验表明, 腹腔或肌肉注射1×108CFU/mL的食窦魏斯氏菌YH1 对许氏平 鲉 无毒性。本研究为下一步探究食窦魏斯氏菌 YH1对许氏平 鲉 生长和免疫的影响提供了理论依据, 为其应用于生产提供了可能性。
4 结论
本研究分析了食窦魏斯氏菌 YH1的生长条件,证实了其广谱抑菌性和动物安全性, 显示了该菌作为有益菌用于水产养殖的潜力, 为乳酸菌微生态制剂的开发及其在许氏平 鲉 养殖业的应用奠定了理论基础。
马丽曼, 2014. 许 氏平 鲉 性别相关基因 Sox3、Sox9和 Dmrt1的研究. 青岛: 中国海洋大学博士学位论文
王福强, 2005. 牙鲆肠道益生菌的分离鉴定及其应用研究. 北京: 中国农业大学博士学位论文
冯东岳, 2003. 许氏平(鲉)繁殖生物学及人工养殖技术的研究.青岛: 中国海洋大学硕士学位论文
吕利群, 刘丽玲, 刘 浩等, 2010. 一株芽孢杆菌用作水霉病防治的研究. 渔业现代化, 37(4): 31—34
杨 勇, 2006. 乳酸菌及其代谢产物对鳗弧菌生长的抑制作用.中国水产, (10): 73—75
杨 艳 萍, 温 海 深, 史 丹 等, 2012. 许 氏 平 鲉 (Sebastes schlegeli)CYP19B基因cDNA克隆及在生殖周期中的表达分析. 海洋与湖沼, 43(2): 370—375
杨莺莺, 李卓佳, 陈永青等, 2005. 乳酸杆菌L1对致病弧菌的抑制作用. 南方水产, 1(1): 62—65
张 刚, 2007. 乳酸细菌: 基础、技术和应用. 北京: 化学工业出版
张艳婷, 任同军, 孙永欣, 2012. 乳酸菌在水产养殖中的应用及其应用于海参养殖的可行性. 中国饲料, (3): 31—35
陈 营, 王福强, 蒲红宇等, 2002. 牙鲆肠道乳酸菌的分离和鉴定. 中国微生物杂志, 14(2): 70—72
章 蔚, 2012. 一株益生乳酸菌的分离鉴定、生物学特性及其对黑鲷肠道、血清的影响. 杭州: 中国计量学院硕士学位论文
蔺玉珍, 于道德, 温海深等, 2014. 卵 胎生许氏平 鲉 仔鱼与稚鱼发育形态学特征观察. 海洋湖沼通报, (2): 51—58
Aly S M, El-Rahman A M A, John G et al, 2008. Characterization of Some Bacteria Isolated from Oreochromis niloticus and their Potential Use as Probiotics. Aquaculture, 2008,277(1—2): 1—6
El-Rhman A M A, Khattab Y A E, Shalaby A M E, 2009.Micrococcus luteus and Pseudomonas species as probiotics for promoting the growth performance and health of Nile tilapia, Oreochromis niloticus. Fish & Shellfish Immunology,27(2): 175—180
Gatesoupe F J, 1994. Lactic acid bacteria increase the resistance of turbot larvae, Scophthalmus maximus, against pathogenic Vibrio. Aquatic Living Resources, 7(4): 277—282
Kim D H, Austin B, 2006. Innate immune responses in rainbow trout (Oncorhynchus mykiss, Walbaum) induced by probiotics. Fish & Shellfish Immunology, 21(5): 513—524
