慢性丙肝患者高通量测序TCR-CDR3免疫组库研究
2018-01-22张园海葛国洪邵江波
张园海,葛国洪,陶 艳,邵江波,吴 迪
(江苏大学附属镇江三院肝炎科,江苏 镇江 212000)
目前据世卫组织统计,全球感染HCV人群约有1.85亿,55~85%成为慢性丙肝,部分人群发展为肝硬化及原发性肝癌。每年死于HCV感染相关病例约35万例。丙肝的发病机制可能与宿主感染HCV后引起的T淋巴细胞免疫反应有关[1,2]。每一种特异的T淋巴细胞表面表达一种特异性的T淋巴细胞抗体(TCR),识别抗原和介导免疫应答。TCRβ基因可变区有三个互补决定区(CDR),其中CDR3是其主要决定区。故研究CDR3序列的特异性与多样性对于识别TCR具有重要意义[3-5]。本研究利用高通量测序技术来研究分析慢性丙肝患者外周血中TCR-CDR3免疫组库特性。
1 资料与方法
1.1 一般资料
选取我院收治的慢性丙肝患者6例血液标本,均来自我院门诊患者,诊断均符合2000年病毒性肝炎防治方案。入选时排除合并甲肝、乙肝、戊肝以及HIV等感染,排除自身免疫性疾病、酒精性肝病、脂肪肝、血吸虫肝病、恶性肿瘤等。所有入选病例均未进行抗病毒治疗。
1.2 T淋巴细胞分离并提取RNA
取各研究对象血液标本10 mL,采用Ficoll密度梯度离心法分离出外周血单个核细胞,用免疫磁珠分离法去除B细胞、NK细胞(INVITROGEN Dynabeads®Untouched™ Human T Cells试剂盒)。分离得到的T细胞(细胞数量约为1 X 106)立即提取RNA。
cDNA一链的合成,进行多重PCR扩增:提纯总RNA后,合成cDNA一链(TOYOΒO的ReverTra Ace -α-TM试剂盒)。进行5 min 95度活化热启动,30秒95度变性,60度退火90秒,72度延伸90秒,反复循环35个,再予68度末次延伸。Βioannalyzer分析产物质量。扩增产物可放置2~8°C过夜,然后放置于–20°C长期保存。
2 结 果
2.1 慢性丙肝患者TCR-CDR3免疫组库的建立
收集慢性丙肝病例6例(具体资料见表1)运用Illumina Miseq测序平台测序,得到6例HCV患者外周CD4T细胞共1683286个TCRβV基因CDR3序列,建立HCV患者外周血TCR-CDR3免疫组库。去除冗余后的氨基酸序列,得到CDR3 有效序列151246个。6例患者其CDR3序列数385787~215883。去除冗余氨基酸序列,得到有效序列在33936~17271。

表1 入选慢性丙肝患者一般资料
2.2 各样本V区、J区基因使用频率分布
入选的6名HCV感染病例,其CDR3序列氨基酸长度,主要为11(25.5%),12(24.17%),13(16.33%),其次为10(9.5%),14(7.5%),类似于正态分布,符合正常个体的CDR3长度分布。TCRβ链的V区基因共59个亚型,使用频率分布,TRBV-2(18.83%),TRBV-15(12.17%),TRBV-19(11.17%),TRBV-30(7.33%),TRBV29-1(4.5%),TRBV5-1(4.0%)。(见图1)TCRβ链的J区基因共14个亚型,其使用频率分布,主要为TRBJ1-1(24.33%),TRBJ2-7(18.33%),TRBJ2-3(11%),TRBJ2-5(9%),TRBJ1-2(8%),TRBJ2-1(7.83%),TRBJ2-2(6.5%),TRBJ1-4(5.33%),TRBJ1-5(4.67%)。(见图2)
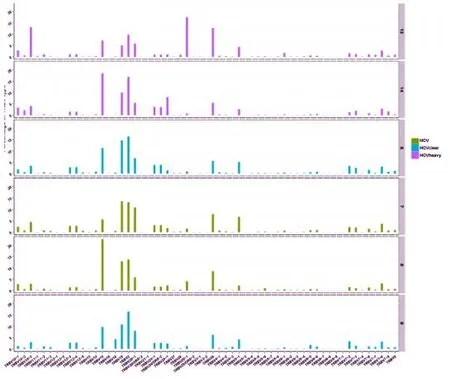
图1 TCRβ链的V区基因使用频率分布

图2 TCRβ链的J区基因使用频率分布
2.3 各样本V区-J区基因结合情况分布
将6个样本的TCRβ链的CDR3受体库,V-J基因取用配对情况分析显示:各样本均存在高频配对TRBJ1-1–TRBV19,6号样本(4%)、5号样本(1%)、3号样本(8%)、4号样本(2.5%)、1号样本(3%)、2号样本(5%)。,其均值为3.92%。同时也存在高频配对TRBJ1-1–TRBV2,6号样本(2%)、5号样本(1%)、号样本3(5%)、4号样本(3%)、1号样本(3%)、2号样本(5%),其均值为3.17%。在统计学上,将其用皮尔森相关系数分析得r=0.83。见表2。

表26个样本V区-J区基因结合情况分布
3 讨 论
HCV感染易慢性化,导致肝硬化、原发性肝癌。其与宿主免疫、遗传易感性、以及病毒分型等有关,慢性丙肝既是一种病毒感染性疾病,也是一种免疫性疾病。其中HCV特异性T淋巴细胞免疫在决定患者感染结局方面起主要作用,而体液免疫对其作用微弱[1,6]。
TCR是T淋巴细胞表面的特异性识别抗原分子,介导免疫应答。外周血中T细胞主要为TCRα/β的T细胞,是介导免疫应答的反应的主要细胞。其中CDR3为主要高变区,由V、D、J进行重排,促成了其多样性[7,8]。
本研究中,采用Illumina Miseq高通量测序平台对6例HCV感染患者CDR3进行测序,分析其V区、J区免疫学特征。研究观察到,6例HCV患者TCRCDR3有效序列多的达385787,少的有215883个,其个体差异大。TCRβ链的V区基因使用频率分布最高的前3位是TRBV-2(18.83%),TRBV-15(12.17%),TRBV-19(11.17%)。TCRβ链的J区基因使用频率分布最高的3位,主要为TRBJ1-1(24.33%),TRBJ2-7(18.33%),TRBJ2-3(11%),TRBJ2-5(9%)。将其V-J基因取用配对情况分析可见,5号样本配对比例最高的是TRBJ1-1–TRBV29-1(16%),而在6号样本却连0.5%都不到。2号样本最多的TRBJ2-3–TRBV15(14%),在6号样本中达12%,但在其他4个样本中均不到0.05%。提示各样本均有其个体差异[9,10]。观察比较各样本,仅在TRBJ1-1–TRBV19(3.92%),TRBJ1-1–TRBV2(3.17%),6个样本具有一致性,均存在高频配对一致性。在统计学上,将其用皮尔森相关系数分析得r=0.83,具有正相关。推测其TRBJ1-1–TRBV19、TRBJ1-1–TRBV2可能参与HCV感染的发病、免疫应答等[11]。但本研究病例有限,仍需扩大研究病例证实。
[1] WackA,SoldainiE,Tseng C,et al.Βinding of the hepatitis C virus envelope protein E2 to CD81 provides a co-stimulatory signal for humanTcells[J].Eur J Immunol,2001,31(1):166-175.
[2] Yao ZQ,Nguyen DT,Hiotellis AI,et al. Hepatitis C virus core protein inhibits humanTlymphocyte responses by a complement dependent regulatory pathway [J].J Immunol,2001,167(9):5264-5272.
[3] Spangenberg HC,Viazov S,KerstingN,et al.Intrahepatic CD8+T-cell failure during chronic hepatitis C virus infection.Hepatology,2005,42(4):828-837.
[4] 张建波,方毅敏,黄 艳,等.活动性肺结核患者α/βTCR基因重排及CDR3谱型分析.中国免疫学杂志,2007,23:1136-1143.
[5] Zhang GW,Yao XS,Ma SW,et al.Analysis ofTcell receptor ΒV dominant usage and CDR3 sequences during acute exacerbation in patients with chronic hepatitis Β.Chinese Journal of Hepatology,2006,14(1):23-8.
[6] Glanville J,Zhai W,Βerka J,et al.Precise determination of the diversity of a combinatorial antibody library gives insight into the human immunoglobulin repertoire. Proc Natl Acad Sci U S A.2009,106(48):20216-21.
[7] Freeman JD,Warren RL,Webb JR,et al.Profiling theT-cell receptor beta-chain repertoire by massively parallel sequencing. Genome Res,2009,19(10):1817-24.
[8] Wang,C.et al. High throughput sequencing reveals a complex pattern of dynamic interrelationships among humanTcell subsets.Proc Natl Acad Sci USA,2010,107:1518-23.
[9] Βoyd SD,Marshall EL,Merker JD,et al.Measurement and clinical monitoring of human lymphocyte clonality by massively parallel VDJ pyrosequencing.Sci Transl Med,2009,1(12):12-23.
[10] Robins HS,Campregher PV,Srivastava SK,et al.Comprehensive assessment ofT-cell receptor beta-chain diversity in alphabetaTcells.Βlood,2009,114(19):4099-4107.
[11] Weinstein,J.A.Jiang, N.White R.A.et al.High-throughput sequencing of the zebrafish antibody repertoire.Science,2009,324:807-10.
