金钻蔓绿绒的组培苗繁殖生产技术研究
2018-01-22夏红梅贾永钊徐叶挺韩宏伟王志明廖志立
周 霞,夏红梅,贾永钊,徐叶挺,韩宏伟,王志明,廖志立
(1.新疆沃尔曼种业科技有限责任公司,新疆昌吉 8311002;2.新疆农业科学院园艺作物研究所,乌鲁木齐 830091)
0 引 言
【研究意义】金钻蔓绿绒(Philodendroncon-go)[1-3]又名金钻原产南美洲,为热带和亚热带常见观赏植物。属多年生常绿草本阴生植物,观赏期长栽培容易生命力极强,又具有净化空气的作用,在我国各地得到广泛栽培。目前新疆金钻蔓绿绒种苗一直是靠外地调运,其种苗质量参差不齐价格不稳定,叶片大远途运输易造成伤痕降低种苗的商品性。金钻蔓绿绒种苗生产在新疆进行规模化生产,既能解决当前面临的问题,又能不断地推动新疆种苗生产的技术提升,保证市场的有序发展。【前人研究进展】目前国内对金钻蔓绿绒的种苗组培研究较少[4,5],结论也不尽相同,如陈丽文等[6]报道不定芽适宜增殖培养基为MS+6-BA 6.0 mg/L+NAA 0.2 mg/L,申雯靖等[7]报道增殖培养基为MS+3.0 mg/L 6-BA+0.2 mg/L NAA较好。这些方法都是先通过诱导愈伤,再由愈伤诱导不定芽来建立快繁体系的,用这种方法建立快繁体系较慢,而且组培苗生长及质量也会受到一定的影响,从而对组培苗的快繁生产也就不会很理想。【本研究切入点】研究最佳外植体取材部位,直接诱导不定芽,快速建立快繁体系;并根据金钻蔓绿绒气生根发达的生物特性,研究简化培养程序的方法。【拟解决的关键问题】研究建立金钻蔓绿绒快繁体系及简化培养程序的方法,为金钻蔓绿绒组培苗工厂化生产提供可靠的技术支撑。
1 材料与方法
1.1 材 料
在新疆沃尔曼种业科技有限责任公司温室内金钻蔓绿绒植株上,取一年生无病虫害的健壮的茎段、叶柄作为外植体。
1.2 方 法
1.2.1 金钻蔓绿绒外植体消毒
采回来的外植体,剪取茎段和叶柄,将气生根处理干净,放到洗洁精水中用小刷子刷洗干净,放在流动的自来水中冲洗1 h。再进行灭菌处理,用75%的酒精和0.1%的升汞按1∶3的比例混合对外植体进行消毒,消毒时间设5、7、10 min三个处理,各接5瓶,每瓶接4个外植体,接种在MS+BA1.0 mg/L+NAA0.1 mg/L诱导培养基中,每天光照12 h,光照强度为1 600~2 000 lx,培养温度25~30℃,接种15 d后进行污染率统计。
1.2.2 诱导萌发金钻蔓绿绒外植体
不同部位的外植体,接种于MS+NAA0.1 mg/L添加不同水平BA(0、0.5、1.0、1.5、2.0 mg/L)的培养基中,各接10瓶,每瓶接1个外植体。每天光照12 h,光照强度为1 600~2 000 lx,培养温度25~30℃,接种30 d后统计诱导率。
1.2.3 金钻蔓绿绒增殖培养基
诱导出的无菌苗,接种于MS+NAA0.1 mg/L添加不同水平BA(0、0.1、0.3、0.5、1.0 mg/L)的培养基中,各接5瓶,每瓶接1株(丛)。每天光照12 h,光照强度为3 000~5 000 lx,培养温度24~28℃,接种30 d后统计增殖率。
1.2.4 金钻蔓绿绒移栽基质
当增殖培养的瓶苗长到1.5~2 cm时,把1.5 cm及以上的带气生根的苗子切下来,然后用水洗净根部的培养基,移栽到装有不同基质(草炭、草炭与珍珠岩6∶1混合、蛭石、珍珠岩)的穴盘中,每种处理100株。前期置于空气湿度80%以上,温度控制在27~30℃。后期湿度可降低到60%左右,每3~4 d喷施一次多菌灵1 000倍液(50%可湿性粉剂)。待驯化20~25 d后逐渐撤去薄膜,进行种苗正常管理并统计成活率。
2 结果与分析
2.1 金钻蔓绿绒外植体的灭菌效果
研究表明,外植体的不定芽诱导15 d后,不同灭菌时间对不同部位的灭菌效果有一定的差异,叶柄灭菌7 min与灭菌10 min比较差异极显著,与灭菌5 min比较差异显著,叶柄灭菌7 min,污染率为25%;而茎段灭菌时间7与5 min比较差异极显著,与灭菌10 min比较差异显著,茎段灭菌7 min,污染率仅为35%,所以叶柄、茎段灭菌时间以7 min为宜。表1
表1 不同消毒时间对不同部位外植体的灭菌效果
Table 1 Effect of sterilizing on Different parts of the explants

部位Position灭菌时间(min)Sterilizationtime接种数(个)Explantnumber污染数(个)Contaminationnumber污染率(%)Contaminationrate叶柄Petiole571020202010b5c18a(褐化)50b25c90a茎段Stem571020202013a7c9b65a35c45b
注:同一列中不同字母表示LSD测验下在P<0.05水平下差异显著,下同
Note: Different letters in array indicate that the values are significantly different at the 0.05 level with by LSD test, the same as below
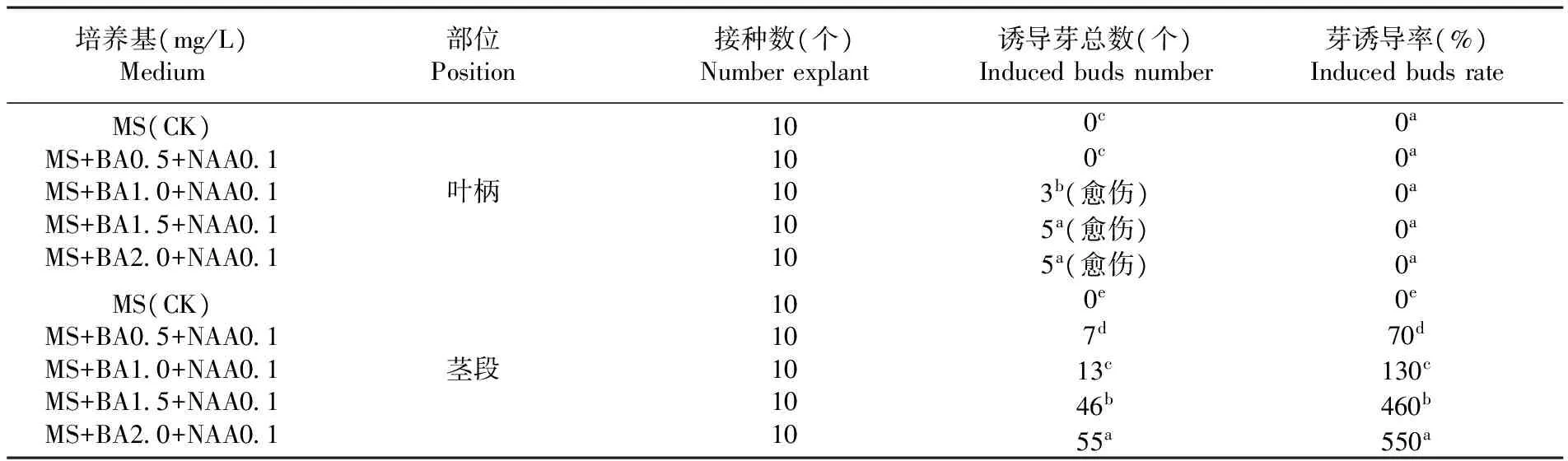
2.2 不同激素浓度配比对不同部位外植体诱导不定芽的影响
研究表明,将不同部位的外植体,接种于含有不同激素浓度MS培养基中,培养30 d后,诱导出的总芽数及不定芽的诱导率是不同的。添加不同浓度的BA对不同部位的外植体诱导不定芽有明显的差异。叶柄只能诱导出愈伤组织,而不能直接诱导出不定芽;而茎段可直接诱导出不定芽。添加BA2.0 mg/L时,与BA0.5 mg/L时差异极显著。但在实际工作中,诱导率太高会影响下一步的增殖培养时组培苗的质量,因而以添加6-BA1.5 mg/L的激素浓度较为适宜。表2
表2 不同激素梯度配比对不同部位外植体诱导不定芽的效果
Table 2 Effects of adventitious buds induction on different hormone gradient ratios in different explants positions
培养基(mg/L)Medium部位Position接种数(个)Numberexplant诱导芽总数(个)Inducedbudsnumber芽诱导率(%)InducedbudsrateMS(CK)MS+BA05+NAA01MS+BA10+NAA01MS+BA15+NAA01MS+BA20+NAA01叶柄10101010100c0c3b(愈伤)5a(愈伤)5a(愈伤)0a0a0a0a0aMS(CK)MS+BA05+NAA01MS+BA10+NAA01MS+BA15+NAA01MS+BA20+NAA01茎段10101010100e7d13c46b55a0e70d130c460b550a
2.3 不同激素浓度梯度对不定芽增殖的影响
研究表明,将诱导出的不定芽丛,接种于附加有不同激素浓度梯度的培养基中,添加不同浓度的BA对不定芽增殖有明显的差异。当添加BA1.0与0.5 mg/L时,不定芽的增殖率分别为4.58%与4.25%,两者平均为4.12%,但均会产生玻璃苗。BA0.1与0.3 mg/L时,不定芽的增殖率分别为3.58%与3.92%,两者平均为3.75%,均无玻璃苗产生。在生产中玻璃苗会影响到增殖培养时组培苗的质量,从产生玻璃苗和不产生玻璃苗添加的BA含量的产生不定芽相比,仅高12.6%诱导不定芽率。因而增殖培养以添加BA0.1~0.3 mg/L的激素浓度较为适宜。表3
表3 不同激素浓度配比下不定芽增殖的变化
Table 3 Effect of different hormone concentration ratio on adventitious bud proliferation

培养基(mg/l)Medium接种数(丛)Numberexplant分化总芽数(个)Differentiatedbudnumber分化苗状态Differentiatedbudstate不定芽的增殖率(%)proliferationrateMS(CK)5(12个芽)12e苗健壮,无分化,叶片大0eMS+BA01+NAA015(12个芽)43d苗健壮,分化叶片较小358dMS+BA03+NAA015(12个芽)47c苗健康,分化叶小392cMS+BA05+NAA015(12个芽)51b苗健康,分化芽较多,但有少量玻璃苗425bMS+BA10+NAA015(12个芽)55a苗健康,分化芽多,产生大量玻璃苗458a
2.4 不同基质对试管苗移栽成活率的影响
研究表明,在蛭石中试管移栽苗绿生长正常成活率为81%,但易烂根。在珍珠岩中能正常生长,但苗黄且生长速度较慢移栽成活率为87%。在草炭土中试管苗移栽成活率为90%。在草炭土+珍珠岩中试管苗移栽苗生长速度快成活率为98%,比纯草炭土移栽成活率高8.8%。表4
表4 不同基质下试管苗移栽成活率
Table 4 The survival rate of in vitro transplanting plantlets on different base material

基质Basematerial移栽数(株)Plantlets生长状况Growingstatus成活率(%)Survivalrate草炭土Peatsoil草炭土+珍珠岩Peatpluspearlite蛭石Vermiculite珍珠岩Perlite100100100100苗绿、生长正常苗绿、生长正常且速度快苗绿、生长正常、易烂根苗黄、生长正常、速度慢90988187
3 讨 论
3.1 在选择外植体诱导时,取植株的什么部位进行诱导是诱导快慢、成否的决定因素之一,通过对金钻蔓绿绒不同部位的外植体诱导试验,发现添加不同浓度的BA对不同部位的外植体诱导不定芽有明显的差异[8]。用叶柄只能诱导出愈伤组织,而不能直接诱导出不定芽;而茎段可直接诱导出不定芽。当添BA2.0 mg/L时,芽的诱导率为550%,但在实际工作中,诱导激素太高,激素的富集作用会影响下一代增殖培养时瓶苗的质量,会产生不同程度的玻璃苗,因而诱导不定芽的激素不宜太高,以添加BA1.5 mg/L的激素浓度较为适宜。
3.2 在增殖培养中,培养基中添加的BA水平不同,芽的增殖率与长势存在显著差异。增殖率与BA浓度密切相关[9,10],在试验浓度范围内,增殖率随BA浓度的升高呈升高趋势。添加不同浓度的BA对不定芽增殖有明显的差异。当添加BA1.0 mg/L时,不定芽的增殖率为4.58%,但同时会产生大量的玻璃苗,而在生产中,玻璃苗的出现,会严重影响到增殖培养时增殖率及组培苗的成苗质量,因而增殖培养以添加BA0.1~0.3 mg/L的激素浓度较为适宜。
3.3 根据金钻蔓绿绒气生根发达的生物特性,在增殖过程中,可直接把1.5 cm以上的带气生根的小植株剪切下来进行移栽,简化了生根程序。研究将带有气生根的植株直接移栽到草炭与珍珠岩6∶1混合的穴盘中,其成活率为98%,待苗生长到10 cm左右时就可以进行移栽上盆。该简化生根移栽方法,操作简单,有效地提高了金钻蔓绿绒组培苗成苗生产的速度。
4 结 论
以金钻蔓绿绒一年生茎段为试材,筛选其诱导、增殖的最佳培养基,简化生根、移栽方法,快速组培生产优质种苗为研究对象。金钻蔓绿绒的诱导培养基为MS+BA1.5 mg/L+NAA0.1 mg/L,增殖培养基为MS+BA0.2 mg/L+NAA0.1 mg/L,气生根苗在炼苗成活率达98%,草炭和珍珠岩混合基质最适于移栽。通过对金钻蔓绿绒的组培繁殖生产技术研究,建立金钻蔓绿绒的组培快繁体系,为金钻蔓绿绒优质种苗工厂化生产提供可靠的技术支撑。
)
[1] Gibernau, M., & Barabé, D. (2002). Pollination ecology of philodendron squamiferum (araceae).CanadianJournalofBotany, 80(3): 316-320.
[2] Zhu, G. (2003). Tissue culture and macro propagation of philodendron.ChineseBulletinofBotany, 20(3): 342-345.
[3] 朱根发,张远能,邹春萍.绿帝王蔓绿绒组织培养和快速繁殖技术研究[J].广东农业科学, 1998,(6): 25-26.
ZHU Gen-fa, ZHANG Yuan-neng, ZHOU Chun-ping. (1998). Green imperial philodendron tissue culture and rapid propagation technology research [J].GuangdongAgriculturalSciences, (6): 25-26. (in Chinese)
[4] 周俊辉, 刘花全, 罗慧君, 等. 玛丽安万年青茎段培养的污染防止[J].仲恺农业技术学院学报, 2002,15(4): 43-48.
ZHOU Jun-hui, LIU Hua-quang, LUO Hui-jun, et al. (2002). Pollution prevention in the cultivation of marianne wanyoung stem [J].JournalofZhongkaiAgrotechnicalCollege, 15(4): 43-48. (in Chinese)
[5] Safwat, G., Elsayed, Y., Hammad, G., Elsharabasy, S. F., & Amin, A. (2014). Assessment level for complex additives in the tissue culture media of philodendron red emelard plants.InternationalJournalofAgriculturalScience&Research, 4(3): 155-164.
[6] 陈丽文, 荣薏, 何贵整. 金钻蔓绿绒组培再生体系的建立[J].北方园艺, 2012,(1): 120-121.
Chen L.W., Rong Y., and He G.Z. (2012). Establishment of tissueculture regeneration system for Philodendron congo,Beifang Yuanyi[J].NorthernHorticulture, (1): 120-121.
[7] 申雯靖, 李娜, 张黎. 金钻蔓绿绒的离体培养研究[J].分子植物育种, 2016, 14(10):2 769-2 776.
Shen W.J., Li N., Zhang L. (2016). Study on culture in vitro of Philodendron 'con-go'[J].Molecular Plant Breeding, 14 (10):2,769-2,776.
[8] 朱根发. 蔓绿绒属观赏植物的组织培养快速繁殖技术研究[J].植物学通报,2003, 20(3): 342-345.
Zhu G.F., (2003). Issue culture and macro propagation of philodendron, Zhiwuxue Tongbao[J]. Chinese Bulletin of Botany, 20(3): 342-345.
[9] Croat T B. (1997). A Revision of Philodendron Subgenus Philodendron (Araceae) for Mexico and Central America[J]. Annals of the Missouri Botanical Garden, 84(3):311-704.
[10] Silva J A T D. (2004). Ornamental Chrysanthemums: Improvement by Biotechnology[J]. Plant Cell Tissue & Organ Culture, 79(1):1-18.
