胡杨休眠茎尖的包埋玻璃化法冷冻保存研究
2018-01-22田洪涛刘锦涛刘艳萍
张 玲,田洪涛,刘锦涛,刘艳萍
(塔里木大学生命科学学院/新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆阿拉尔 843300)
0 引 言
【研究意义】胡杨(Populuseuphratica)是国家3级珍稀濒危植物,具有较强的抗干旱、抗盐碱能力,是荒漠绿洲地区的主要造林树种。对荒漠绿洲地区的防风固沙及水土保持有着重要作用。胡杨林种群自然更新能力低,应采取合适的措施对胡杨种质资源进行保存[1-3]。建立适合胡杨休眠茎尖的冷冻保存方法,对保存珍稀濒危植物胡杨种质资源具有重要意义。【前人研究进展】液氮冷冻保存植物种质操作简单,不需要复杂的设备,且保存时间较长,保存后的材料遗传稳定性不受影响[4-7]。胡杨种子在常温常湿条件下,7 d种子活力即大幅下降,15 d即失去萌发能力[8],因此实验尝试对胡杨休眠芽进行液氮冷冻保存的研究。包埋玻璃化液氮冷冻法兼具包埋脱水法和玻璃化法的优点,保存后的材料有较高的存活率,且可以直接成苗[9-12]。【本研究切入点】目前采用该法保存了多种植物[7,13-18],但是采用包埋玻璃化法冷冻保存胡杨休眠茎尖的研究尚未见报道。研究适合胡杨休眠茎尖的冷冻保存方法。【拟解决的关键问题】研究采用包埋玻璃化法对胡杨深冬休眠茎尖进行了液氮冷冻保存的研究,确定预培养过程中蔗糖浓度、预培养时间及不同玻璃化保护液及处理时间对胡杨休眠茎尖存活率的影响,在优化的条件下,研究建立适合胡杨休眠茎尖的冷冻保存方法。对保存后的茎尖采用相关序列扩增多态性(Sequence—related amplified polymorphism,SRAP)进行遗传稳定性检测。
1 材料与方法
1.1 材 料
取深冬胡杨休眠枝条,自来水浸泡24 h后,自来水冲洗1 h,然后用10%NaClO浸泡10 min后,75%酒精浸泡20 min,用无菌水冲洗2~3遍。超净工作台上剥取2~3 mm茎尖进行包埋。
1.2 方 法
1.2.1 制胶
用50 mL烧杯,量取10 mL纯净水,置于磁力搅拌器上,慢速旋转。称取0.3 g褐藻酸钠粉末缓慢倒入烧杯中,持续搅拌约4 h,直至胶体均匀无气泡。
1.2.2 包埋
将胡杨茎尖与制好的褐藻酸钠混匀,用不带针头的注射器将茎尖滴入0.1 mol/L CaCl2溶液中固定,30 min后即成直径约为4 mm的褐藻酸钙胶球。
1.2.3 蔗糖预培养
将胶球投入灭菌的0、0.2、0.4、0.6、0.8、1.0、1.2 mol/L的蔗糖溶液中振荡培养(120 r/min,25℃),培养时间为6、12、24、48和60 h。
1.2.4 玻璃化溶液处理
用不同配方的玻璃化保护液进行保护剂毒性实验,选取最优配方:
A:PVS2保护液[30%甘油+15%乙二醇(EG)+15%二甲基亚砜(DMSO)+0.5 mol/L蔗糖]。
B:40%甘油+ 45%(0.4 mol/L)蔗糖+10%聚乙二醇(分子量4 000)(PEG)+5%二甲基亚砜。
C:聚乙二醇(4 000)+葡萄糖+二甲基亚砜(10∶8∶10, V/V)。
D:15%(0.4 mol/L)蔗糖+25%甘油+15%乙二醇+13%二甲基亚砜+2%聚乙二醇(分子量4 000)(V/V)。
E: 50%甘油+50%蔗糖。
1.2.5 化冻
在超净工作台上,将冻存管从液氮中取出拧开,将胶球倒入30℃无菌水中,快速震荡,直至冰晶消失。
1.2.6 胡杨茎尖的培养条件[19,20]
培养基配方为MS+0.3 mg/L BA+ 1.0 mg/L ZT+ 0.1 mg/L NAA。
1.2.7 存活率及遗传变异的检测1.2.7.1 存活率测定
胶球化冻后接种于适合胡杨茎尖的培养基上,暗处培养24 h后移入光下培养(光强2 000 lx,光周期12∶12),15 d后统计其存活率。
1.2.7.2 遗传变异的检测
(1)植物基因组DNA的获得
采用CTAB法提取保存后胡杨茎尖单株DNA,提取的DNA用RNase进行消化RNA,检测纯度后,调至20 ng/μL备用。
(2)SRAP体系的建立
优化Li等已发表的SRAP反应体系[21],扩增程序为94℃ 3 min,94℃ 1 min,37℃ 1 min,72℃ 2 min,5个循环;94℃ 1 min,50℃ 1 min,72℃ 2 min,35个循环;72℃ 5 min[15]。扩增后的产物用聚丙烯酰胺凝胶电泳法进行分离(电泳条件:恒定功率85 W,预电泳30 min,电泳时间2 h),银染。
(3)遗传稳定性
合成30对SRAP引物,对保存前后胡杨茎尖的DNA进行扩增,分析其遗传稳定性。
2 结果与分析
2.1 蔗糖浓度和预培养时间对胡杨茎尖存活率的影响
研究表明,未经蔗糖预培养的胡杨茎尖冰冻后存活率为0。随着蔗糖浓度的升高,冰冻后茎尖存活率逐渐升高,当蔗糖浓度为0.8 mol/L时,茎尖存活率最高,当蔗糖浓度升高至1 mol/L时,胡杨茎尖冰冻前后存活率均开始下降。图1
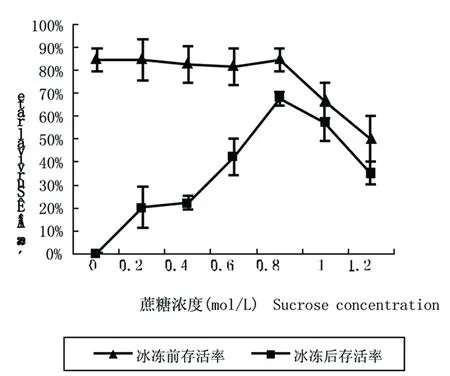
注:包埋后茎尖预培养时间为24 h,经玻璃化保护液A处理20 min
Note: The dormant shoot tips was precultured for 24 h, and was treated by vitrification solution A for 20 min
图1 预培养中不同蔗糖浓度下胡杨休眠茎尖存活率变化
Fig.1 Effect of sucrose concentration on the survival rate of dormant shoot tips in preculture
研究表明,未经冰冻的茎尖预培养48 h后,存活率大幅下降。冰冻后的茎尖,随着培养时间的延长,茎尖存活率逐渐升高,预培养24 h后,茎尖存活率最高为67%。预培养时间延长至48 h,茎尖冰冻后存活率则开始下降。图2
2.2 不同玻璃化保护液处理不同时间对胡杨茎尖存活率的影响
研究表明,玻璃化保护液处理是保证冰冻茎尖存活的关键因素。未经玻璃化保护液处理的茎尖冰冻后全部死亡。不同的玻璃化保护液对茎尖的毒性也不相同。因此,不同的玻璃化保护液处理的时间也有较大差别。玻璃化保护液A和玻璃化保护液B随着处理时间的延长,茎尖存活率逐渐升高,处理30 min后茎尖存活率最高,分别为68%和77%。而玻璃化保护液C和玻璃化保护液E在处理20 min存活率达到最高分别为43%和17%。玻璃化保护液D在处理40 min后才达到最高存活率35%。无论是那种玻璃化保护剂,随着处理时间的延长,存活率都开始下降。图3

注:蔗糖浓度为0.8 mol/L,经玻璃化保护液A处理20 min
Note: The concentration of sucrose was 0.8 mol/L, and was treated by vitrification solution A 20 min
图2 不同预培养时间下胡杨休眠茎尖存活率变化
Fig.2 Effect of preculture time on the survival rate of dormant shoot tips

注:0.8 mol/L蔗糖预培养24 h
Note: 0.8 mol/L sucrose preculture 24 h
图3 不同玻璃化保护液处理时间下胡杨休眠茎尖存活率变化
Fig.3 Effect of different vitrification solution and treatment time on survival rate of dormant shoot-tips
2.3 冷冻保存后胡杨茎尖存活率的计算及遗传稳定性评估
2.3.1保存后胡杨茎尖存活率的计算
将胡杨茎尖化冻经暗恢复24 h后于光下进行培养,前6 d内未见有形态颜色的变化7 d时部分变为褐色,一部分未见变化,15 d后存活茎尖转变为绿色,即可计算其存活率。30 d即可见到的形成,即可进行遗传稳定性检测。冰冻前后胡杨茎尖的在形态上完全没有差别。图4
2.3.2 遗传变异的检测
实验利用30条SRAP引物对超低温保存后胡杨茎尖进行了遗传稳定性分析,各SRAP 引物的扩增结果,可以看出,遗传稳定性未发生变异。图5

注:(a)冰冻前;(b)冰冻后
Note: (a) before freezing; (b) after freezing
图4 冰冻前和冰冻后的休眠茎尖
Fig.4 The dormant shoot tip of Populus euphratica before and after freezing was cultured 30 d

图5 不同SRAP引物的扩增结果
Fig.5 The results of different SRAP primers amplification map
3 讨 论
低温锻炼和蔗糖预培养是决定超低温保存后材料存活率的关键步骤。选取深冬休眠芽作为保存对象,因为材料已经适应室外寒冷的气候,因此,可以省去低温锻炼。蔗糖预处理可以减少自由水含量,避免冰冻时产生冰晶。蔗糖预培养时蔗糖浓度和预培养时间是决定保存后存活率的关键因素。不同植物对蔗糖浓度和预培养时间的耐受力不同。对高等植物茎尖一般选用0.3~0.8 mol/L的蔗糖浓度,培养时间为24 h或者高于24 h[6,10,22]。对灰杨(PopuluspruinosaSchrenk)茎尖采用包埋玻璃化法进行液氮保存时,用0.8 mol/L蔗糖溶液预培养24 h获得了较好的存活率[13]。而采用玻璃化保存白杨(PopulusalbaL.)茎尖时则采用0.09%的蔗糖MS培养基,在5℃条件下预培养48 h,保存效果较好[23]。实验结果表明,胡杨与灰杨茎尖的处理条件相似,即用0.8 mol/L蔗糖溶液预培养24 h获得了较好的存活率。包埋玻璃化法处理植物茎尖时应采用比玻璃化法稍高的蔗糖溶液,培养时间则可以稍短。
玻璃化保护液的选择是提高茎尖存活率的关键因素。玻璃化保护液可以使材料脱水,并使材料发生玻璃化转变,进入玻璃化状态,避免产生冰晶对材料造成伤害。玻璃化保护液分为两种:一种为低分子中性物质,可以进入细胞使溶液粘性增加,为渗透性保护剂,例如甘油、二甲基亚砜等;一种为大分子物质,溶于水后不能进入细胞,为非渗透性保护剂例如蔗糖、聚乙二醇等[4,8,9,10]。已有的研究结果表明,不同的玻璃化保护液的保护作用具有协同和累加效应,但是其毒性不累加[4,9]。实验结果表明,非渗透性保护剂与渗透性保护剂搭配使用效果较好。在五种玻璃化保护液配方中,B配方处理后的茎尖冰冻后存活率最高为77%。同其它保护液相比,B配方中渗透性保护液含量较少,可能对材料的毒害作用较少。对灰杨的研究结果亦表明经B配方处理的茎尖冰冻后存活率较高。五种保护液配方中,E保护液配方简单,只有甘油和蔗糖组成,用玻璃化保护液E处理的材料存活率较低,只有17%,该结果进一步表明,玻璃化保护液混合使用效果较好。
保存植物种质资源时,保持DNA的遗传稳定性是十分重要的。因此对保存后的材料需要进行遗传稳定性检测。目前对保存后材料的遗传稳定性评价一般采用分子标记的方法,例如ISSR、RAPD 和AFLP 等。研究结果表明,超低温保存同其它植物种质保存方法相比有较好的遗传稳定性[6,17,18]。相关序列扩增多态性(Sequence-related amplified polymorphism,SRAP)是一种显性分子标记技术,具有简便高效、高共显性等特点[21]。实验采用SRAP对保存前后的材料进行了遗传稳定性分析,未发现变异。
4 结 论
采用包埋玻璃化法在液氮中保存珍稀濒危植物胡杨的深冬休眠芽是可行的。深冬休眠芽已经经过抗寒锻炼,因此可以不经低温驯化直接保存。保存前对材料的处理是十分必要的,蔗糖预培养时采用0.8 mol/L的蔗糖溶液预培养24 h可以获得较好的效果。玻璃化保护液应混合使用,同时应适量增加非渗透性玻璃化保护液的比例。冰冻后的材料未经愈伤组织,直接成芽。对保存后的材料进行遗传稳定性分析,未发现变异。该方法是保存胡杨种质资源的较好方法。
)
[1] 傅立国. 中国珍稀濒危植物[M]. 上海:上海教育出版社,1989.
FU Li-guo. (1989).Chineserareandendangeredplants[M]. Shanghai: Shanghai Education Press. (in Chinese)
[2]樊自立,马英杰,季方,等.塔里木河流域生态环境演变及整治途径[J].干旱区资源与环境,2001,15(1) :13-17.
FAN Zi-li, MA Ying-jie, JI Fang, et al. (2001). The ecological environment succession and the realignment of Tarim river watershed [J].JournalofAridLandResourcesandEnvironment, 15(1) :13-17.(in Chinese)
[3]陶玲,李新荣,刘新民.中国珍稀濒危荒漠植物保护等级的定量研究[J]. 林业科学,2001,37(1):52-57.
TAO Ling,LI Xin-rong,LIU Xin-min. (2001). Quantitative Study of Conservation Grading of Rare and Endangered Desert Plants in China [J].ScientiaSilvaeSinicae, 37(1):52-57. (in Chinese)
[4]李广武,郑从义,唐兵. 低温生物学[M]. 长沙:湖南科学技术出版社, 1998.
LI Guang-wu, ZHENG Cong-yi, TANG Bing. (1998).Cryobiology[M]. Changsha: Hunan Science & Technology Press. (in Chinese)
[5]罗士韦,唐惕. 植物组织和细胞的超低温保存及种质库建立的研究概况[J]. 细胞生物学杂志, 1983,5(1) :1-7.
LUO Shi-wei, TANG Ti. (1983). Cryopreservation of plant tissues and cells and establishment of Germplasm Database [J].ChineseJournalofCellBiology, 5(1) :1-7. (in Chinese)
[6]陈晓玲,张金梅,辛霞,等. 植物种质资源超低温保存现状及其研究进展[J]. 植物遗传资源学报,2013,14(3):414-427.
CHEN Xiao-ling,ZHANG Jin-mei,XIN Xia, et al. (2013). Progress on Cryopreservation State and Research of Plant Germplasm Resources [J].JournalofPlantGeneticResources, 14(3):414-427. (in Chinese)
[7]洪森荣,尹明华,王艾平. 江西铅山红芽芋胚性愈伤组织的包埋玻璃化[J]. 植物科学学报,2014,32(1):80-87.
HONG Sen-rong,YIN Ming-hua,WANG Ai-ping. (2014). Cryopreservation of Jiangxi Yanshan Red Bud Taro Embryogenic Calli by Encapsulation-vitrification [J].PlantScienceJournal, 32(1):80-87. (in Chinese)
[8]杨新辉.胡杨种子的采集与贮藏[ J] .防护林科技,2005, 67(4):83.
YANG Xin-hui. (2005). Seed collection and storage ofPopuluseuphratica[J].ProtectionForestScienceandTechnology, 67(4):83. (in Chinese)
[9]Sakai, A., & Engelmann, F. (2007). Vitrification, encapsulation-vitrification and droplet-vitrification: a review.CryoLetters, 28(3): 151-172.
[10]Sakai, A., Hirai, D., Niino, T., & Reed, B. M. (2008).DevelopmentofPVS-basedvitrificationandencapsulation-vitrificationprotocols..PlantCryopreservation:APracticalGuide. Springer New York.
[11]吴雪梅, 汤浩茹.包埋玻璃化法超低温保存植物种质的研究进展[J].植物学通报,2005, 22 (2): 238-245.
WU Xue-mei, TANG Hao-ru. (2005). Research Advances in Cryopreservation of Plant Germplasm by Encapsulation-vitrification Method [J].ChineseBulletinofBotany, 22 (2): 238-245 (in Chinese)
[12]Shibli, R. A., & Aljuboory, K. H. (2000). Cryopreservation of 'nabali' olive (olea europea l.) somatic embryos by encapsulation-dehydration and encapsulation-vitrification.CryoLetters, 21(6): 357-366.
[13]刘艳萍,段黄金,鲁乃增,等. 包埋玻璃化法超低温保存灰杨休眠茎尖的研究[J]. 河北农业科学,2010,14(5):61-63.
LIU Yan-ping, DUAN Huang-jin, LU Nai-zeng, et al. (2010). Cryopreservation of domant shoottips of populus pruinosa by encapsulation-vitrification method [J].JournalofHebeiAgriculturalScience, 14(5):61-63. (in Chinese)
[14]Cuteu, Bǎcilǎ, Deliu, Vǎlimǎreanu, & Halmagyi. (2015). Genetic integrity assessment of cryopreserved tomato (lycopersicon esculentum mill.) genotypes.TurkishJournalofBiology, 39(4): 638-648.
[15]Zhao, X., Ping, L. I., Jiang, L., Zhu, Y., Song, Z., & Han, L., et al. (2016). Effects of preculture on cryopreservation of nodes from dioscorea opposita thunb. cv. tiegun plantlets by encapsulation-vitrification.MedicinalPlant, (Z1):22-26.
[16]陈加利,姜喜,肖巍,等. 扁桃茎尖包埋玻璃化超低温保存条件研究[J]. 塔里木大学学报,2014,26(2):110-114.
CHEN Jia-li, JIANG Xi, XIAO Wei, et al. (2014). Studies on cryopreservation of almond shoot tips by encapsulation-vitrification [J].JournalofTarimUniverstiy, 26(2):110-114. (in Chinese)
[17]李海兵,周娜,赵姣,等. 怀山药种质资源的包埋玻璃化超低温保存与植株再生[J]. 植物学报,2010,45(3):379-383.
LI Hai-bing, ZHOU Na, ZHAO Jiao, et al. (2010). Cryopreservation and plantlet regeneration of germplasm re-sources of dioscorea opposita by encapsulation-vitrification [J].ChineseBulletinofBotany, 45(3): 379-383. (in Chinese)
[18]邵丽,王子成. 植物种质超低温保存遗传稳定性的研究进展[J]. 植物生理学通讯,2010,46(11):1 109-1 113.
SHAO Li, WANG Zi-cheng. (2010). Review of genetic stability research for plant germplasm cryopreservation [J].PlantPhysiologyCommunications, 46(11):1,109-1,113. (in Chinese)
[19]丁霞,陈晓阳,李云,等. 胡杨组织培养研究概述与问题讨论[J]. 河北林果研究, 2004,19(4):381-386.
DING Xia, CHEN Xiao-yang, LI Yun, et al. (2004). A review on in vitro tissue culture of populus euphratica and the related problems [J].HebeiJournalofForestryandOrchardResearch, 19(4):381-386. (in Chinese)
[20]王大鹏,唐嘉泽,邵明成,等. 胡杨组织培养叶片及插穗毛状根发生[J]. 植物学报,2017,52(2):210-217.
WANG Da-peng, TANG Jia-ze, SHAO Ming-cheng, et al. (2017). Rooting induced on in vitro leaves and fresh cuttings ofPopuluseuphratica[J].ChineseBulletinofBotany, 52(2): 210-217. (in Chinese)
[21]Li, G., & Quiros, C. F. (2001). Sequence-related amplified polymorphism (srap), a new marker system based on a simple pcr reaction: its application to mapping and gene tagging in brassica.Theoretical&AppliedGenetics, 103(2-3): 455-461.
[22]王君晖,黄纯农.木本植物种质超低温保存的研究进展[J].世界林业研究, 1998,(5):6-11.
WANG Jun-hui, HUANG Chun-nong. (1998). Progress in the research of cryopreservation of woody plant germplasm [J].WorldForestryResearch, (5):6-11. (in Chinese)
[23]Lambardi, M., Fabbri, A., & Caccavale, A. (2000). Cryopreservation of white poplar ( populus alba, l.) by vitrification of in vitro-grown shoot tips.PlantCellReports, 19(3): 213-218.
