NaClO改性ACFs对水中铜的吸附动力学和热力学研究
2018-01-22路晏红姜雪梅
路晏红,祝 方,姜雪梅
(太原理工大学 环境科学与工程学院,太原 030024)
随着电机制造、通讯电缆、能源工业等的快速发展,有毒的重金属含铜废水逐渐被排放到水体环境中,造成水污染,从而对人体健康产生严重的威胁,如人体摄取过量的铜时,会使人产生一种被称之为威尔逊氏(Wilson)症的染色体隐性疾病[1]。处理水中铜离子的常见方法包括化学沉淀法[2]、离子交换法[3]、膜技术[4]、吸附法[5]等。在上述方法中,吸附法因操作简单,去除效果良好,能耗低,在处理污染物的过程中不引入新的污染物而受到关注。常见的吸附剂有活性炭纤维(ACFs)、沸石、膨润土等,其中ACFs因具有大的吸附容量、温和的脱附条件、容易再生等特点在水处理方面拥有广阔的应用前景。
ACFs表面的化学结构和孔隙结构是影响ACFs吸附能力的主要因素,故为了提高ACFs对水中铜离子的吸附性能,众多研究者采用物理改性和化学改性等手段来改善ACFs的表面化学结构和孔隙结构[6]。如PARK et al[7]为了在ACFs表面得到含氧官能团,分别用NH4OH和H3PO4(10%)电解质对ACFs进行电化学氧化并用处理过的ACFs和未处理的ACFs对水中Cr(Ⅵ)、Cu(Ⅱ)和Ni(Ⅱ)进行吸附。结果显示,经过电化学氧化的ACFs表面的羧基、内酯基、酚基被诱导,对水中重金属离子的吸附能力依次为NH4OH-ACFs,H3PO4-ACFs,ACFs.王秀丽等[8]用硝酸、磷酸、磷酸二氢铵和硝酸铜水溶液对ACFs进行改性,并用改性的ACFs对含铜废水进行吸附结果显示,改性后的ACFs表面含氧酸性官能团数量显著增加,且磷酸二氢铵的改性效果最佳,铜离子的吸附量提高了3.6倍。RUSOVA et al[9]通过硝酸改性ACFs进一步验证了改性后的ACFs对于Ni(Ⅱ)、Cu(Ⅱ)和Fe(Ⅱ)离子的去除效果明显优于未改性的ACFs.
HNO3,NH4OH,H2O2是改性ACFs的常用化学试剂。然而,酸性或碱性的化学试剂容易破坏ACFs表面的含氧官能团,从而降低对重金属离子的去除效率;H2O2溶液虽然呈现中性,但是氧化性比较弱,对ACFs含氧官能团的改性不彻底。故本次实验用氧化性较强的弱酸盐NaClO对ACFs进行改性,然后用改性后的ACFs对水溶液中的铜离子进行去除,并与HNO3,H2O2改性的ACFs进行了比较,探讨NaClO改性ACFs的优越性以及对铜离子的吸附行为。
1 实验部分
1.1 材料和试剂
试剂:HNO3,化学纯;H2O2,分析纯;NaClO,分析纯;CuCl2,分析纯。
吸附材料:粘胶基活性碳纤维,比表面积为700~1 200 m2/g,克重为50~250 g/m2.
1.2 ACFs的处理与改性
首先,对ACFs进行预处理:将ACFs放入沸水中加热并搅拌90 min,冷却、过滤并用蒸馏水冲洗数次直至滤液的pH值是7,这样可去除其中的可溶性气体和杂质;然后将处理过的ACFs加热烘干至恒重,存放于干燥皿中待用。
其次,不同改性剂对ACFs的改性:准确称取4份一定量的ACFs于锥形瓶中,并分别加入50 mL蒸馏水和50 mL 1 mol/L的NaClO,50 mL 1 mol/L的HNO3和50 mL 1 mol/L的H2O2溶液在恒温振荡器中振荡3 h;然后取出过滤并用蒸馏水洗涤ACFs数次直至滤液的pH值是7;干燥后置于聚乙烯瓶中保存。将ACFs的改性方法分别记做ACFs-0,ACFs-NaClO,ACFs-HNO3和ACFs-H2O2.
再次,研究NaClO浓度对ACFs表面酸性基团的影响。准确称取6份一定量的ACFs于锥形瓶中,分别加入50 mL浓度为0.5,1.0,1.5,2.0,2.5,3.0 mol/L的NaClO溶液进行振荡、过滤。采用Boehm滴定法[10]测定改性后ACFs样品表面的酸性基团。
最后,研究ACFs投加量对表面酸性基团的影响。在50 mL浓度一定的NaClO溶液中分别加入0.050,0.075,0.100,0.125,0.150,0.175 g ACFs进行振荡、过滤。用Boehm滴定法测定ACFs表面的酸性基团。
1.3 铜离子的吸附实验
为确定最佳改性剂,分别称取一定量的ACFs-0,ACFs-NaClO,ACFs-HNO3,ACFs-H2O2,并将其分别加入到一定浓度的铜离子溶液中振荡1 h,过滤。用原子吸收分光光度计测定剩余的Cu2+浓度。
为研究温度和振荡时间对去除率的影响,称取一定量改性后的ACFs于50 mL一定浓度的Cu2+溶液中,在恒温振荡器中振荡一定时间,然后取出过滤。用原子吸收分光光度计测定Cu2+浓度并按式(1)计算ACFs吸附Cu(Ⅱ)的去除率。为确保数据的可行性,每组实验在相同条件下重复实验3次,求其平均值。
(1)
式中:r为吸附去除效率,%;ρ0为吸附前溶液中Cu(Ⅱ)的浓度,mg/L;ρe为吸附后溶液中Cu(Ⅱ)的浓度,mg/L.
2 结果与讨论
2.1 ACFs的氧化改性
本实验用不同的ACFs投加量和不同的改性剂浓度来研究ACFs的氧化改性,并用能很好地展现ACFs改性效果的酸性基团——羧基和内酯基的数量变化表示ACFs氧化改性程度的强弱。其中,在酸性基团的测量中,用NaHCO3来中和ACFs表面的羧基,用Na2CO3来中和ACFs表面的羧基和内酯基,从而计算出ACFs表面的酸性基团,结果如图1和图2所示。
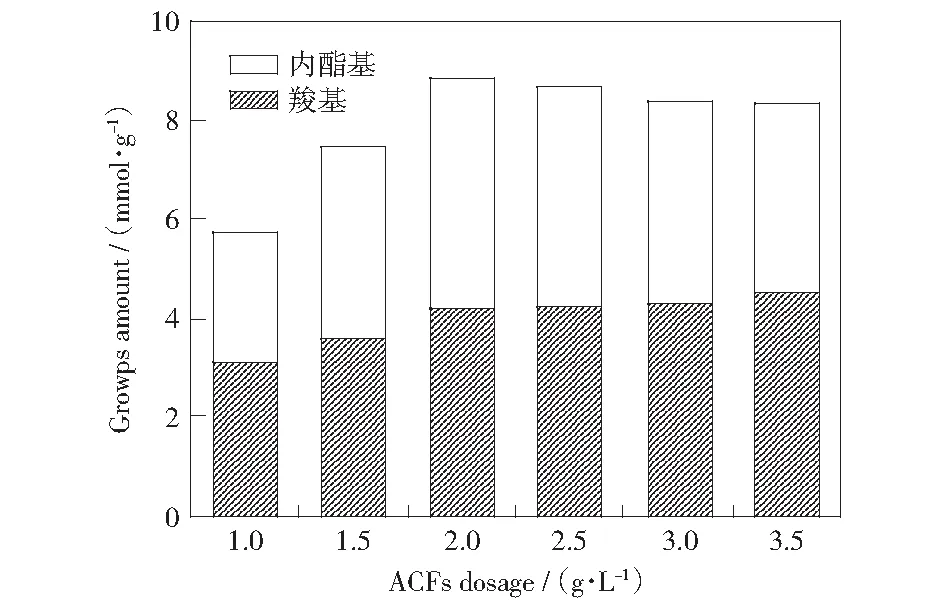
图1 ACFs投加量对羧基和内酯基数量的影响Fig.1 Influence of ACFs dosage on the amount of carboxyl and lactone groups
从图1可看出:当NaClO的浓度一定时,随着ACFs投加量的增加,ACFs表面羧基基团的数量有增加的趋势,而内酯基的数量先减少后增加,但羧基和内酯基的总和呈增加的趋势。但当ACFs的投加量达到2 g/L时,ACFs表面酸性基团的数量随着投加量的增加而减少;这是由于NaClO改性ACFs的饱和量是2 g/L,而随着ACFs的增加,由于NaClO的量未增加,从而使得ACFs表面酸性基团量有所降低,故ACFs的最佳投加量是2 g/L.

图2 NaClO浓度对羧基和内酯基数量的影响Fig.2 Effect of NaClO concentration on the amount of carboxyl and lactone groups
从图2可看出:当NaClO的投加量一定时,随着NaClO浓度的增加,ACFs表面酸性基团的数量增加。但当NaClO的浓度增加到1.0 mol/L时,ACFs表面酸性基团的数量增加得不太明显;可能是过高浓度的NaClO在对ACFs进行改性处理时,初始反应过于激烈,NaClO的氧化性破坏了ACFs的表面结构,故ACFs表面酸性基团增加的数量并不明显。因此,单纯地增加NaClO的浓度实际意义并不大,故NaClO的最佳浓度是1.0 mol/L.
综上,当ACFs与1.0 mol/L NaClO的固液比是2 g/L时,ACFs表面酸性基团的数量是最多的。
2.2 ACFs改性前后对铜离子去除率的影响
选取初始质量浓度为50.08 mg/L的铜溶液在室温下进行吸附实验。吸附条件:pH为5,吸附温度:25 ℃,ACFs的投加量:2 g/L,振荡时间:60 min.

表1 吸附后铜离子的浓度和去除率Table 1 Concentration of copper and the rate of removal after adsorption
已知铜离子的初始质量浓度是50.08 mg/L,从表1中可知,用ACFs-0进行吸附铜离子时去除率是51.32%,分别用ACFs-NaClO、ACFs-HNO3和ACFs-H2O2吸附时去除率有不同程度的增加,这是由于ACFs经过改性使其表面酸性基团增加,从而增加了更多的吸附位点,故使得铜离子的去除率增加。ACFs-NaClO对铜离子的去除率比ACFs-H2O2高,这是因为NaClO的氧化性比H2O2强;而HNO3的氧化性虽然比NaClO强,但是ACFs-HNO3对铜离子的去除率反而比ACFs-NaClO低,这可能是由于强酸性的改性剂破坏了表面的微孔,导致比表面积的减小。所以,在3种改性剂中,NaClO的改性效果是最佳的。
2.3 反应时间对铜离子去除率的影响
图3呈现了反应时间对铜离子去除率的影响。结果显示,在0~40 min内铜离子的去除率从0快速增加到91.8%,而当时间继续增加到50 min时去除率仅仅增加了2.6%,且50 min后去除率几乎不再发生变化,表明了最佳吸附平衡时间是50 min.这是由于在吸附初期,在ACFs表面有大量的孔隙,铜离子易于吸附到孔隙上;但是随着孔隙被占用,吸附速率会显著降低,吸附过程达到平衡,故铜离子的去除率达到了最大。快速的吸附平衡在实际应用中是非常有利的,因为实际中的吸附大多属于动态型吸附,为了使吸附剂的吸附能力达到最佳状态,应保证一定的吸附时间,较快的吸附速度可以在保证处理效果的基础上,缩短处理时间。所以,为了充分利用ACFs的吸附能力,应保证一定的吸附时间,故在此后的吸附实验中选择吸附时间为50 min.

图3 反应时间对去除率的影响Fig.3 Influence of reaction time on the removal rate of Cu2+
2.4 温度对铜离子去除率的影响
为了研究温度对去除率的影响,选择25,40,55 ℃来进行批量吸附实验。根据吸附原理,一般情况下化学吸附为吸热过程,而物理吸附为放热过程。
图4显示了铜离子的去除率随着温度的升高有一定程度的增加,即温度从25 ℃上升到55 ℃时,铜离子的去除率从94.05%增加到99.42%,这说明了ACFs对铜离子的吸附属于吸热过程。然而,在30 ℃的温差范围内去除率仅增加了5%左右,这表明了温度对ACFs处理含铜废水的影响效果较小,即外界温度的变化对ACFs去除效果的影响不大。因此,ACFs在实际的水体环境中具有非常广阔的应用前景。
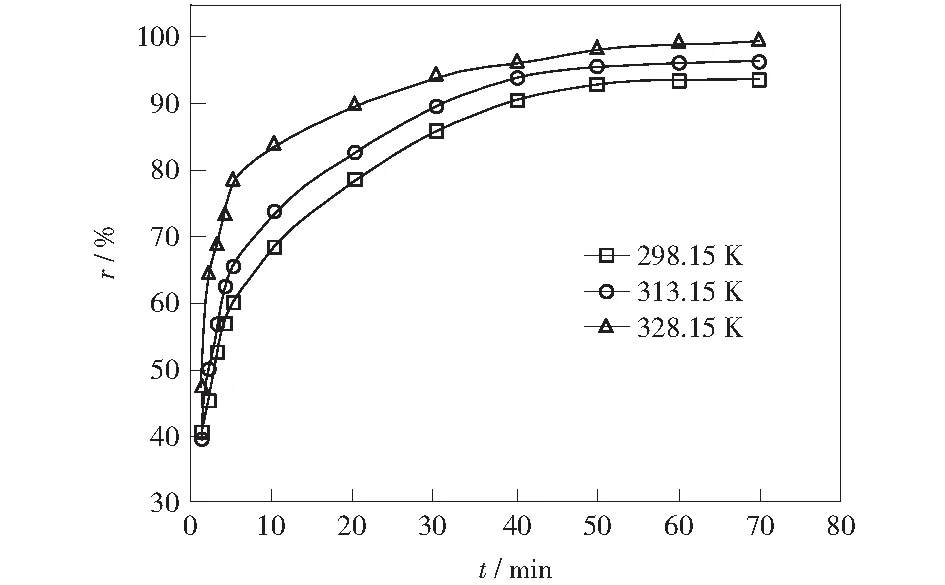
图4 温度对铜离子去除率的影响Fig.4 Influence of temperature on the removal rate of Cu2+
2.5 吸附动力学
溶液中的吸附是一个比较复杂的过程,而吸附动力学和传质过程的分析非常重要,固液吸附体系模拟分析的常用模型是Lagergren准一级动力学模型和准二级动力学模型[11],故用准一级动力学方程(见式(2))和准二级动力学方程(见式(3))对吸附动力学实验数据进行拟合,以描述和分析动力学过程。其中,准一级动力学模型是以固体的吸附量为基础来描述固液体系的吸附行为[12],而准二级动力学模型用于分析液体溶液的化学吸附[13]。
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中:qt为t时刻的吸附量,mg/g;qe为平衡时吸附量,mg/g;k1为一级吸附率常数,min-1;k2为二级速率常数,g/(mg·min).在准一级动力学拟合过程中,以时间t为横坐标,ln(qe-qt)为纵坐标进行作图可得一直线,根据直线的斜率和截距可以分别得到k1和qe;在准二级动力学拟合过程中,以时间t为横坐标,t/qt为纵坐标进行作图可得一条直线,根据直线的斜率和截距可以分别得到qe和k2.其拟合结果见表2.

表2 动力学方程和内扩散方程的拟合结果Table 2 Fitting result of kinetic equations and intraparticle diffusion equation
由表2可知,准一级动力学方程的相关系数R2的范围在0.936 5~0.965 3,数据分布较分散且都小于0.99,并且由准一级动力学方程计算得到的平衡吸附量(q1e,cal)与实验值(qe,exp)相差是较大的,故准一级动力学模型不适合描述该吸附过程。
准二级动力学方程的相关系数R2的范围在0.998 69~0.999 71,分布相对集中且大于0.99,并且由准二级动力学方程计算得到的平衡吸附量(q2e,cal)与实验值(qe,exp)比较接近,其中在55 ℃时两者的差值(q2e,cal-qe,exp)是1.01 mg/g,该值是最大的,这说明了准二级动力学模型比准一级动力学模型更适合描述铜离子在ACFs上的吸附。进一步表明了,以准一级动力学模型为基础的扩散过程限制了ACFs对铜离子的吸附速率,而准二级动力学模型显示了ACFs对铜离子的吸附行为主要受到化学作用的控制。
另外,温度从25 ℃增加到55 ℃时,ACFs的吸附量从24.45 mg/g增加到25.45 mg/g,并且准二级动力学的速率常数随着温度的升高从0.013 56增加到0.022 42。数据表明,ACFs吸附铜离子的行为是吸热反应,升高温度有利于ACFs对铜离子的吸附。这可能是由于温度的升高既加快了溶质分子的迁移速度,又使得被吸附溶液的粘度下降,从而有利于溶质分子的吸附。但是吸附量增加的幅度并不大,这说明了温度对吸附量的影响并不大,从而在环境温度下改性ACFs可以用于水中铜离子的吸附。
因为准一级动力学和准二级动力学不能够准确地描述扩散机理,故应用内扩散模型来探讨影响吸附过程的机理,其方程式如下:
qt=kidt0.5.
(4)
其中,kid是颗粒内扩散速率常数,mg·g-1·min0.5.在拟合过程中,以qt为纵坐标,t0.5为横坐标进行作图可得到一直线,根据直线的斜率可以得到与内颗粒扩散系数有关的kid.
用内扩散模型对吸附动力学的曲线进行拟合后如图5所示。从图5可知,整个吸附过程中内颗粒扩散模型的变化是非线性的,这说明了水溶液中铜离子的吸附并不是以某一种方式进行的。整个吸附过程具有3段特征,首先该直线没有经过原点,这表示了内颗粒扩散并不是控制吸附速率的唯一步骤,其次该曲线中上升的点表明了液膜扩散过程,最后平滑的点说明了内颗粒扩散过程。另外,从前两阶段的拟合的参数(如表2所示)可以看出,外扩散进行得非常快,并且升高温度有利于外扩散的进行。而颗粒内扩散主要控制扩散速率。

图5 改性ACFs对铜离子吸附的qt-t0.5曲线Fig.5 Intraparticle diffusion model for adsorption capacity of Cu2+ on modified ACFs
2.5 吸附热力学
为了确定该吸附过程能否自发进行,在不同温度下进行了吸附实验。根据公式(5)—(7)来计算吸附过程中的热力学参数,即吉布斯自由能ΔG0,标准吸附焓变ΔH0和标准吸附熵变ΔS0.
ΔG0=-RTlnKc.
(5)
(6)
(7)
其中:R为理想气体摩尔常数(8.314 J·mol-1·K-1);Kc为平衡常数(Kc=qe/ce,mL/g);T为热力学温度,K.将lnKc对1/RT进行线性拟合,根据拟合结果所得到的热力学函数ΔG0,ΔH0和ΔS0的值如表3所示。
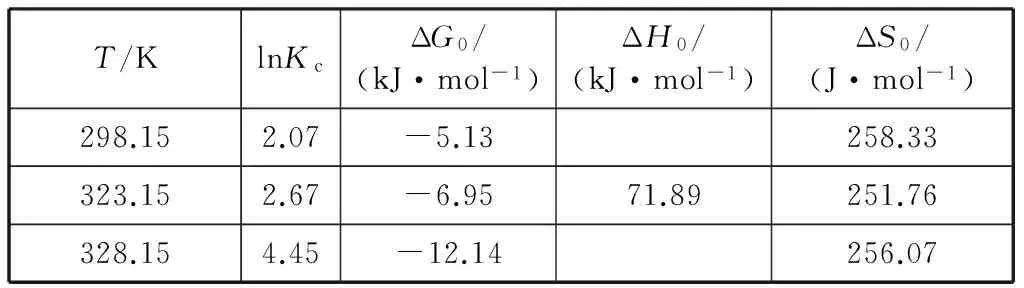
表3 不同温度下铜离子在改性ACFs上吸附的热力学函数值Table 3 Calculated thermodynamic parameters for Cu2+ adsorption onto modified ACFs
从表3中可以看出,在不同温度下,标准吸附焓变ΔH0是大于0的,这表明了该吸附过程是吸热反应。因此,升高温度有利于反应的进行,这与动力学拟合所得到的结果是相符的。另外,吉布斯自由能ΔG0为负值,这显示了该吸附过程可以自发进行。另外,标准吸附熵变ΔS0大于0,这揭示了吸附过程使得该体系的熵增加。
2.6 吸附活化状态函数
根据阿伦尼乌斯公式(8)计算活化能:
(8)
式中:Ea为活化能,kJ/mol;R为理想气体摩尔常数(8.314 J·mol-1·K-1);k为反应速率常数。以-lnk为纵坐标,1/T为横坐标进行线性拟合得到一直线,根据直线的斜率可以求得该反应的活化能。得到的-lnk-1/T,图如6所示。

图6 ACFs吸附铜离子的-lnk-1/T曲线Fig.6 Plots of -lnk-1/T for the adsorption of Cu2+ on ACFs
一般情况下,物理吸附所需要的活化能较小,吸附速度快,当活化能大约为8.37~25.10 kJ/mol时以物理吸附为主;而化学吸附所需要的活化能一般大于83.72 kJ/mol[14].根据拟合结果得到的活化能是20.48 kJ/mol,故铜离子在改性ACFs上的吸附主要以物理吸附为主,吸附速率较快。
3 结论
本工作主要采用NaClO对ACFs进行氧化改性,并研究了改性的ACFs对水中的铜离子吸附的动力学和热力学行为。
1) 用改性的ACFs去除水溶液中的铜离子时,其去除率是未改性ACFs的1.35倍。
2) 准二级动力学方程得到平衡吸附量与实测值非常接近,故铜离子在在ACFs的吸附过程符合准二级动力学方程。
3) 改性ACFs吸附铜离子的过程为自发的物理吸附过程(活化能是20.48 kJ/mol),并且是吸热过程(标准吸附焓变ΔH0>0).
[1] 朱一民,沈岩柏,魏德洲.海藻酸钠吸附铜离子的研究[J].东北大学学报(自然科学版),2003,24(6):589-592.
ZHU Y M,SHEN Y B,WEI D Z.Adsorption of sodium alginate to Cu2+in disposal water[J].Journal of Northeastern University(Natural Science),2003,24(6):589-592.
[2] 熊英禹,付忠田,黄戍生.化学沉淀法处理模拟含铜废水的研究[J].环境保护科学,2014,40(2):35-38.
XIONG Y Y,FU Z T,HUANG S S.Research on treatment of simulated wastewater containing copper by chemical sedimentation method[J].Journal of Environmental Protection Science,2014,40(2):35-38.
[3] 张惠灵,杨瑾,吴健,等.离子交换-电沉积联合工艺对电镀废水的处理研究[J].水处理技术,2013,39(12):95-98.
ZHANG H L,YANG J,WU J,et al.Study on treatment of electroplate wasterwater with copper by ion-exchange and electrodeposition[J].Journal of Water Treatment Technology,2013,39(12):95-98.
[4] 易琼.超滤膜技术处理高效实验室含铬、铜废水的研究[J].实验技术与管理,2009,26(2):43-45.
YI Q.Study on t reatment of chromium and copper waste water in laboratories of colleges and universities by ultrafilt ration membrane[J].Experimental Technology and Management,2009,26(2):43-45.
[5] GUECHI E K,HAMDAOUI O.Evaluation of potato peel as a novel adsorbent for the removal of Cu(II) from aqueous solutions:equilibrium,kinetic,and thermodynamic studies[J].Desalination and Water Treatment,2016,57(23):10677-10688.
[6] 王秀丽.ACFs对Cu2+吸附性能的研究[J].中国环境管理干部学报,2012,22(2):48-51.
WANG X L.Adsorption of Cu2+onto activated carbon fiber[J].Journal of EMCC,2012,22(2):48-51.
[7] PARK S J,KIM Y M.Adsorption behaviors of heavy metal ions onto electrochemically oxidized activated carbon fibers[J].Materials Science and Engineering A,2005(391):121-123.
[8] 王秀丽,盛义平.ACFs的改性及对Cu2+吸附性能影响的研究[J].环境科学与管理,2012,37(5):94-96.
WANG X L,SHENG Y P.Influence of activated carbon fiber modification on Cu2+adsorption[J].Environmental Science and Management,2012,37(5):94-96.
[9] RUSOVA N V,ASTASHKINA O V,LYSENKO A A.Adsorption of heavy metals by activated carbon fibers[J].Fibre Chemistry,2015,47(4):320-323.
[10] RIVERA-UTRILLA J,BAUTISTA-TOLEDO I,FERRO-GARCIA M.Bioadsorption of Pb(Ⅱ),Cd(Ⅱ),and Cr(Ⅵ) on activated carbon from aqueous solutions[J].Carbon,2003,41,323-330.
[11] 李国亭,冯艳敏,柴晓琪,等.镧改性ACFs高效吸附去除对苯醌,环境工程学报,2016,10(4):1638-1644.
LI G T,FENG Y M,CHAI X Q,et al.Efficient adsorptive removal of p-benzoquinone by lanthanum modified activated carbon fibers[J].Chinese Journal of Environmental Engineering,2016,10(4):1638-1644.
[11] CHEN J H,LIN H,LUO Z H,et al.LI,Cu(II)-imprinted porous film adsorbent Cu-PVA-SA has high uptake capacity for removal of Cu(II) ions from aqueous solution[J].Desalination,2011(277):265-273.
[12] HO Y S,MCKAY G.Pseudo-second-order model for sorption processes[J].Process Biochem,1999(34):451-465.
[13] 李颖,岳钦艳,高宝玉,等.ACFs对活性染料的吸附动力学研究.环境科学,2007,28(11):2637-2641.
LI Y,YUE Q Y,GAO B Y,et al.Adsorption kinetics of reactive dyes on activated carbon fiber[J].Environmental Science,2007,28(11):2637-2641.
