低苯丙氨酸花生肽混合物的制备
2018-01-19李志刚LIZhigang光翠娥干建平
李志刚LI Zhi-gang 光翠娥, -, 干建平 -
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 黄冈师范学院经济林木种质改良与资源综合利用湖北省重点实验室&大别山特色资源开发湖北省协同创新中心,湖北 黄冈 438000)
苯丙酮尿症(phenylketonuria,PKU)是一种由苯丙氨酸(phenylalanine,Phe)代谢过程中的辅酶四氢生物蝶呤(tetrahydrobiopterin,BH4)缺乏或苯丙氨酸羟化酶(phenylalanine hydroxylase,PAH)活性丧失或合成不足,导致Phe无法被正常代谢[1]的常见隐性遗传氨基酸代谢症。现阶段推荐通过饮食管理达到治疗的目的,即控制患者每日饮食摄入的Phe[2-3]。在采取普通严格低蛋白饮食时,患者可能会出现如不饱和脂肪酸、维生素及矿物质等营养素缺乏症[4-6],因此推荐食用低苯丙氨酸特殊医学配方食品补充患者每日所需蛋白质、维生素及矿物质等营养素。目前,此类特膳食品主要为低/无苯丙氨酸游离氨基酸配方食品[7-8]。但此类特膳食品适口性差,存在由于摄入过多游离氨基酸而致腹泻的风险[8]。通过蛋白酶水解天然蛋白,分离Phe后所得低苯丙氨酸肽混合物可用于为PKU患者制备特殊医学配方食品[9]。
目前,制备低苯丙氨酸肽混合物的原料主要以乳清蛋白[10-12]和酪蛋白[7,13]等动物性蛋白为主,而对植物蛋白的开发利用主要以不含过敏源的玉米蛋白[14]、小麦蛋白[15]及大米蛋白[16]为原料。由于花生蛋白含有大分子过敏性蛋白[9]限制了对其的开发利用,针对这一现状,本研究通过多酶分步深度降解花生蛋白,再利用活性炭吸附分离Phe制备不含过敏性蛋白的低苯丙氨酸肽混合物,一方面为花生蛋白的应用提供新方向,另一方面为将来制备适合PKU患者食用的特殊医学配方食品提供更多的原料选择。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
花生蛋白:粗蛋白含量73.69%,陕西森弗天然制品有限公司;
Alcalase2.4L:食品级,19 8761 U/mL,诺维信(中国)投资有限公司;
Flavourzyme:食品级,38 810 U/mL,诺维信(中国)投资有限公司;
木瓜蛋白酶:食品级,169 704 U/g,广西庞博生物工程有限公司;
三氯乙酸、氢氧化钠、浓盐酸、磷酸二氢钠、磷酸氢二钠等:分析纯,上海国药集团化学试剂有限公司;
粉末活性炭:食品级,200目,椰壳制,江苏森森碳业有限公司。
1.1.2 主要仪器设备
电子天平:EL204型,PL20002型,梅特勒-托利多国际贸易(上海)有限公司;
pH计:FE-20型,梅特勒-托利多国际贸易(上海)有限公司;
紫外可见光分光光度计:UV-1600型,上海美普达仪器有限公司;
电热恒温水槽:DK-8D型,上海精宏实业有限公司;
氨基酸专用高效液相色谱仪:Agilent1100型,美国安捷伦科技有限公司;
高效液相色谱仪:Waters600型,美国沃特世有限公司。
1.2 方法
1.2.1 游离Phe含量测定及氨基酸组成分析 采用OPA柱前衍生高效液相色谱—紫外检测法。
(1) 色谱条件:色谱柱:Agilent Hypersil ODS柱(5 μm,4.0 mm×250 mm);梯度洗脱程序:0 min,8%;17 min,50% B;24.0 min,0% B;流动相A(pH=7.2):27.6 mmol/L醋酸钠—三乙胺—四氢呋喃(体积比为500∶0.11∶2.5);流动相B(pH=7.2):80.9 mmol/L醋酸钠—甲醇—乙腈(体积比为1∶2∶2);流动相流速1.0 mL/min;柱温:40 ℃;紫外检测波长:330 nm,脯氨酸于263 nm处检测。
(2) 游离Phe含量测定样品处理:取一定量酶水解样品,用10 g/100 g三氯乙酸等体积稀释,静置1 h,经双层滤纸过滤后取1 mL滤液于离心管内,15 000 r/min离心20 min,取400 μL上清液于液相小瓶,待测。
(3) 氨基酸组成分析样品处理:取1 mL样品于水解管内,依次添加12 mol/L HCl 1 mL和6 mol/L HCl 6 mL,充氮封管,置于120 ℃鼓风干燥箱内水解22 h。水解完成后冷却至室温,添加10 mol/L NaOH 4.8 mL中和盐酸,转移至25 mL容量瓶内用去离子水定容,0.45 μm水系微滤膜过滤,取1 mL滤液于离心管内,于15 000 r/min离心10 min,取400 μL 上清液于液相小瓶,待测。
1.2.2 Flavourzyme水解花生蛋白释放游离Phe单因素试验
配制4 g/100 g花生蛋白溶液,于90 ℃热处理20 min。热处理完成后冷却至60 ℃,调节溶液pH至8.0,添加35 μL/g Alcalase2.4L水解110 min。水解完成后沸水浴灭酶10 min,冷却至50 ℃,调节pH至7.0,添加5 000 U/g 木瓜蛋白酶水解3 h。水解完成后沸水浴灭酶,冷却至室温后6 000 r/min离心10 min,取上清液用于Flavourzyme再水解。
(1) 温度对Flavourzyme水解花生蛋白释放游离Phe的影响:取等量水解液5份分别预热至40,45,50,55,60 ℃,调节pH至7.0,均添加2 500 U/g Flavourzyme水解2.0 h。水解完成后沸水浴灭酶10 min,待冷却至室温后测定游离Phe含量。
(2) pH对Flavourzyme水解花生蛋白释放游离Phe的影响:取等量水解液5份预热至50 ℃,调节pH至5.5,6.0,6.5,7.0,7.5,添加2 500 U/g Flavourzyme水解2.0 h。水解完成后沸水浴灭酶10 min,待冷却至室温后测定游离Phe含量。
(3) 酶浓度对Flavourzyme水解花生蛋白释放游离Phe的影响:取等量水解液6份预热至50 ℃,调节pH至6.5,分别添加1 500,2 000,2 500,3 000,3 500,4 000 U/g Flavourzyme水解2.0 h。水解完成后沸水浴灭酶10 min,待冷却至室温后测定游离Phe含量。
(4) 水解时间对Flavourzyme水解花生蛋白释放游离Phe的影响:取等量水解液6份,调节pH至6.5,均添加3 000 U/g Flavourzyme,分别水解1.0,2.0,3.0,4.0,5.0,6.0 h。水解完成后沸水浴灭酶10 min,待冷却至室温后测定游离Phe含量。
1.2.3 Flavourzyme水解正交试验 在单因素试验的基础上,固定水解时间为5 h,选择温度、pH及酶浓度为正交试验因子,以水解所得游离Phe为指标,设计三因素三水平正交试验。
1.2.4 活性炭吸附分离Phe 活性炭是一种有极大比表面的多孔疏水性极性吸附剂,能够特异性地吸附芳香族氨基酸。Phe在260 nm处有最强紫外吸收峰[17-18],而非芳香族氨基酸在210~220 nm处有紫外吸收峰,因此,以吸附前后OD260的变化计算去除率,以OD220/OD260衡量活性炭吸附效果[19]。
(1) pH对吸附效果的影响:取水解液5份预热至35 ℃,分别调节pH至2.0,2.5,3.0,3.5,4.0,4.5,均添加5 g/100 g粉末活性炭,静态吸附2.0 h。吸附完成后过滤,滤液稀释10,20倍后分别测定OD260、OD220,计算去除率及OD220/OD260。
(2) 温度对吸附效果的影响:取水解液5份分别预热至25,30,35,40,45 ℃,均调整pH至3.5,添加5 g/100 g粉末活性炭,静态吸附2.0 h。吸附完成后过滤,滤液稀释10,20倍后分别测定OD260、OD220,计算去除率及OD220/OD260。
(3) 活性炭用量对吸附效果的影响:取水解液4份预热至35 ℃,调整pH至3.5,分别添加3,5,7,9 g/100 g粉末活性炭,静态吸附2.0 h。吸附完成后过滤,滤液稀释10,20倍后分别测定OD260、OD220,计算去除率及OD220/OD260。
(4) 时间对吸附效果的影响:取水解液5份预热至35 ℃,均调整pH至3.5,添加7 g/100 g粉末活性炭,分别静态吸附0.5,1.0,1.5,2.0,2.5,3.0 h。吸附完成后过滤,滤液稀释10,20倍后分别测定OD260、OD220,计算去除率及OD220/OD260。
1.2.5 活性炭吸附正交试验 在单因素试验的基础上,固定吸附时间为2.5 h,选择OD220/OD260为指标,以温度、pH及活性炭用量为正交试验因子,设计三因素三水平正交试验。
1.2.6 分子量分布分析
(1) 色谱条件:色谱柱:TSK gel 2000 SWXL (7.8 mm×300 mm);紫外检测器检测波长:330 nm;流动相:乙腈—水—三氟乙酸(体积比为40∶60∶0.05);流速:0.5 mL/min;柱温:30 ℃;进样量:10 μL;混合标准品:细胞色素C(MW12500)、杆菌酶(MW1450)、乙氨酸—酪氨酸—精氨酸(MW451)、乙氨酸—乙氨酸—乙氨酸(MW189)。
(2) 样品处理:样品经0.45 μm水系微滤膜过滤。
1.2.7 数据处理 试验重复3次,采用Origin 9.0及SPSS 20进行数据处理与分析。
2 结果与分析
2.1 Flavourzyme水解花生蛋白释放游离Phe
2.1.1 温度对Flavourzyme水解花生蛋白释放游离Phe的影响 温度对蛋白酶的水解反应有两方面的影响:① 通过影响分子热运动而影响水解速率;② 影响蛋白酶的活性[20]202。由图1可知,随温度的上升,分子热运动加强,水解速率增快,游离Phe含量随之上升。当温度升至50 ℃时,所得游离Phe含量达到了最高。当温度超过50 ℃后,游离Phe含量下降,可能是高温致使蛋白酶变性导致活性下降。因此,Flavourzyme水解花生蛋白释放游离Phe的最适温度在50 ℃左右。
2.1.2 pH对Flavourzyme水解花生蛋白释放游离Phe的影响 pH通过影响蛋白酶氨基酸侧链基团的解离状态,改变空间构型,从而对酶的活性造成影响[20]202-203。由图2可知,在选定的pH下,随着pH的上升,水解活性增强,游离Phe含量也随之上升。当pH升至6.5时游离Phe含量达到了最高,继续升高pH,其含量随之下降,可能是过高的pH导致酶的空间构型发生变化,活性下降。因此,Flavourzyme水解花生蛋白释放游离Phe的最适pH在6.5左右。
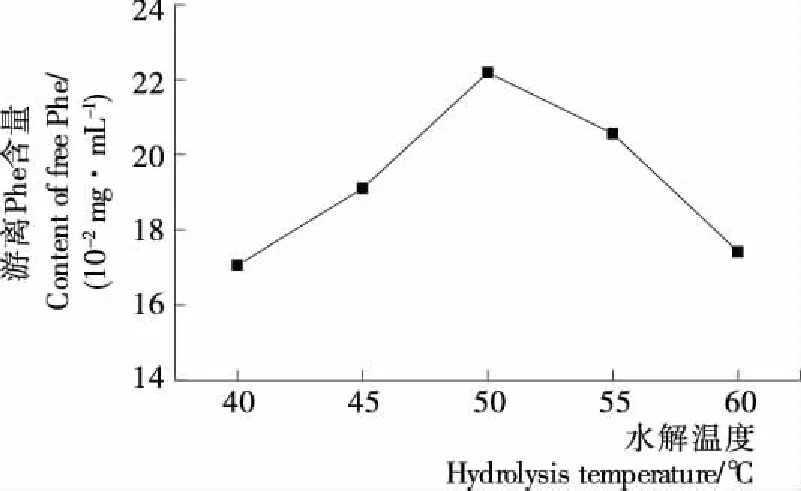
图1 水解温度对游离Phe含量的影响

图2 水解pH对游离Phe含量的影响
2.1.3 酶浓度对Flavourzyme水解花生蛋白释放游离Phe的影响 蛋白酶催化水解反应时,当底物浓度一定时,酶浓度的上升能加速水解过程[20]205。由图3可知,随着酶浓度的上升,游离Phe含量随之上升。当浓度升至3 000 U/g时,游离Phe含量增幅减缓,因此选择3 000 U/g为Flavourzyme水解花生蛋白释放游离Phe的最适酶浓度。

图3 酶浓度对游离Phe的影响
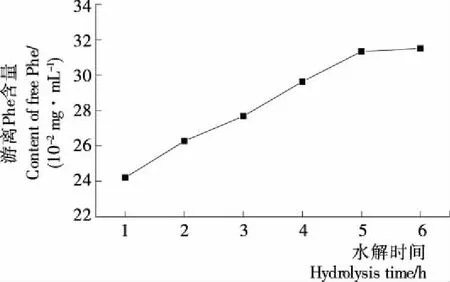
图4 水解时间对游离Phe含量的影响
2.1.4 水解时间对Flavourzyme水解花生蛋白释放游离Phe的影响 当其他水解条件一定时,水解时间同产物成正比[20]209-210。由图4可知,随着水解时间的增加,游离Phe含量随之上升,但水解5 h后所得游离Phe趋于稳定。这是由于蛋白酶的水解作用具有位点特异性,随着水解程度的加深,可供酶水解的位点逐渐减少,水解产物趋于平衡[21]。因此水解时间为5 h为宜,后续试验固定水解时间为5 h。
2.2 Flavourzyme水解正交试验
正交试验设计及结果见表1、2。

表1 水解正交试验因素水平表
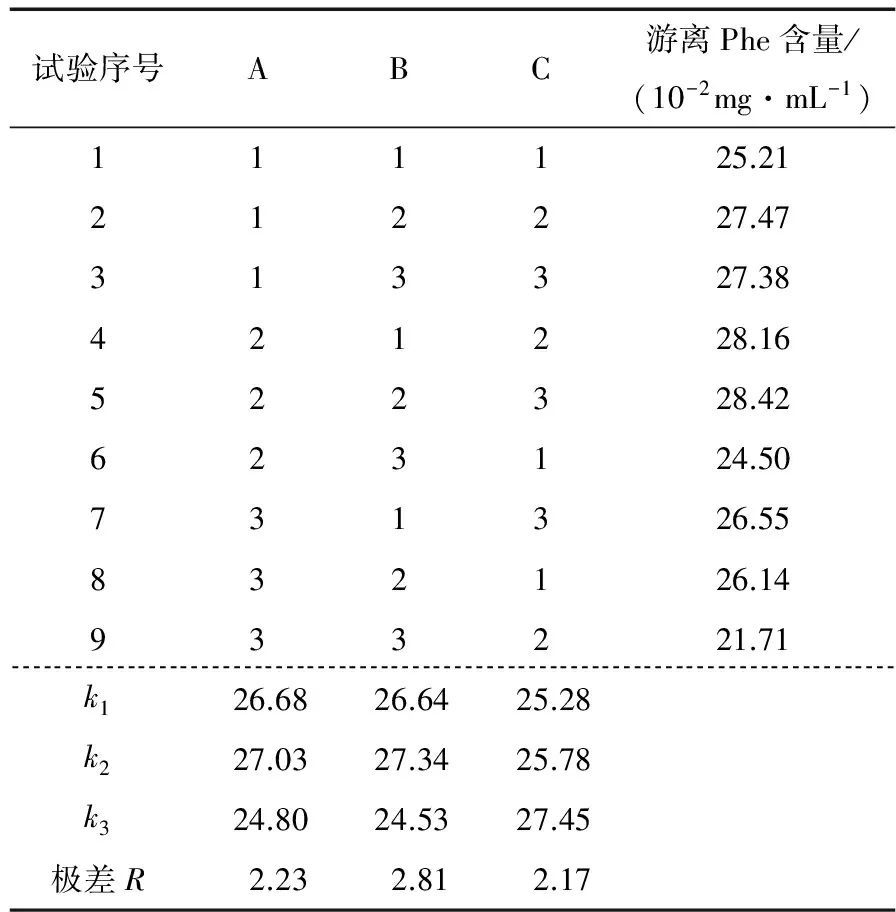
表2 水解正交试验结果
由表2可知,影响Flavourzyme水解花生蛋白释放游离Phe的因素主次为RB>RA>RC,最佳水解工艺为50 ℃,酶浓度3 500 U/g,pH 6.5,水解5 h。经次重复实验验证,在此工艺条件下水解所得游离Phe可达28.65 mg/100 mL。
2.3 活性炭分离Phe
2.3.1 温度对吸附效果的影响 由图5可知,温度的上升有利于Phe的吸附。超过35 ℃时,Phe去除率下降,活性炭对其他氨基酸的吸附增加导致吸收示差下降。因此,活性炭吸附Phe的合适温度在35 ℃左右。
2.3.2 pH对吸附效果的影响 pH一方面影响氨基酸在体系中的存在形式,另一方面通过影响活性炭分子表面的带电情况而改变吸附能力[22-23]。由图6可知,pH的上升有利于Phe的去除,pH超过3.0时,活性炭对Phe的吸附能力下降,对其他氨基酸的吸附能力增加导致吸收示差下降。因此,活性炭吸附去除Phe的最适pH在3.0左右。
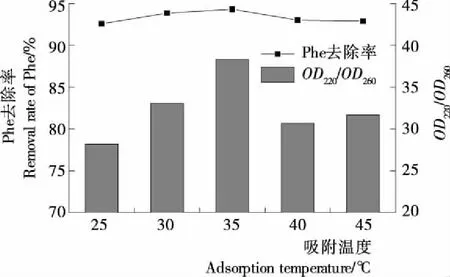
图5 吸附温度对OD220/OD260及Phe吸附率的影响
Figure 5 Effect of adsorption temperature on the value ofOD220/OD260and the removal rate of Phe

图6 吸附pH对OD220/OD260及Phe去除率的影响
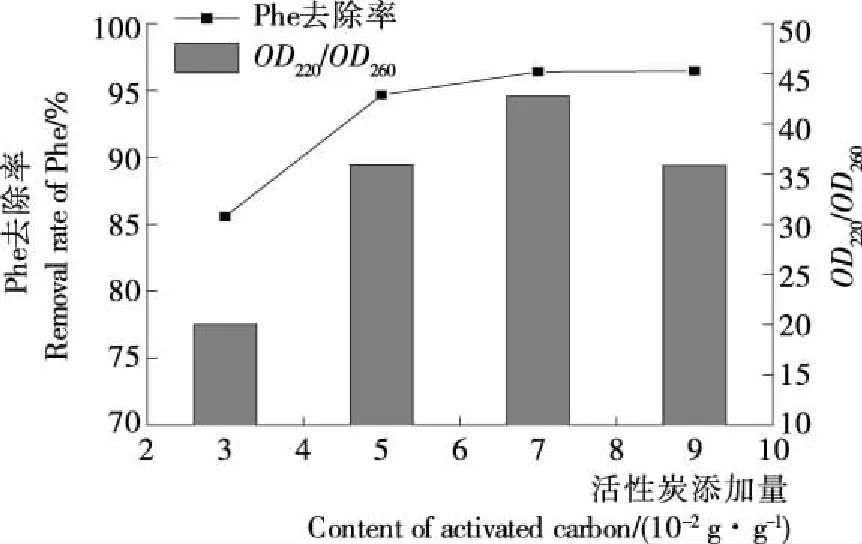
图7 活性炭添加量对OD220/OD260及Phe去除率的影响
Figure 7 Effect of the content of activated carbon on the value ofOD220/OD260and the removal rate of Phe
2.3.3 活性炭用量对吸附效果的影响 由图7可知,随着活性炭用量的增加Phe去除率及吸收示差均出现上升现象。当添加量增至7 g/100 g时,Phe去除率趋于平缓,继续增加用量对Phe去除率的贡献有限,吸收示差的下降说明活性炭对其他氨基酸的吸附逐渐增强。因此,活性炭适宜添加量在7 g/100 g 左右。
2.3.4 吸附时间对吸附效果的影响 在活性炭吸附过程中,其不仅特异性地吸附Phe,对非芳香族氨基酸也有一定的吸附能力[22-23]。由图8可知,吸附时间的延长有利于Phe的去除,但长时间的吸附会导致其他氨基酸大量损失,从而导致吸收示差大幅下降。因此,活性炭吸附Phe的时间应在2.5 h 左右为宜,后续正交试验固定水解时间为2.5 h。

图8 吸附时间对OD220/OD260及Phe去除率的影响
2.4 活性炭吸附正交试验
吸附正交试验设计及结果见表3、4。

表3 吸附正交试验因素水平表

表4 吸附正交试验结果
由表4可知,影响活性炭吸附效果的主次因素为RB>RA>RC,最佳工艺为吸附温度35 ℃,pH 3.0,活性炭用量7 g/100 g。经3次平行实验验证,在此工艺条件下吸附2.5 h,OD220/OD260可达49.95,Phe去除率达到98.64%。
2.5 氨基酸组成分析

图9 低苯丙氨酸肽混合物氨基酸图谱

表5 低苯丙氨酸肽混合物氨基酸组成†
† “-”表示未检测。
花生蛋白经蛋白酶水解及活性炭吸附处理后,所得产物氨基酸组成见表5,氨基酸图谱见图9。由表5可知,经活性炭吸附后Phe仅占17种总氨基酸含量的0.09%,符合GB 29922—2013中关于PKU患者专用特膳食品中Phe含量不得高于1.5 mg/g蛋白等同物的要求,因此,通过本工艺获得的低苯丙氨酸肽混合物适合将来为PKU患者制备特膳食品。
2.6 分子量分布分析
花生蛋白虽然是一种具有较高营养价值的植物蛋白,但由于含有分子量在10~70 kDa的过敏性蛋白[24],限制了其在食品行业的应用。由图10可知,经蛋白酶水解及活性炭吸附,产物分子量主要为600 Da以下的低聚肽和游离氨基酸,过敏性蛋白被去除。人体对蛋白质的吸收主要以低聚肽的形式为主[25],因此,通过本工艺获得的低苯丙氨酸肽混合物是一种不含过敏蛋白的可用于制备低苯丙氨酸特殊医学配方食品的原料。

图10 低苯丙氨酸肽混合物分子量分布图谱
3 结论
通过试验发现,Flavourzyme水解花生蛋白释放游离Phe的最佳工艺条件为:温度50 ℃,pH 6.5,酶添加量为3 500 U/g,水解5 h,在此工艺条件下游离Phe含量可达28.65 mg/100 mL。所得水解液添加7 g/100 g活性炭,于35 ℃,pH 3.0,吸附2.5 h,Phe去除率可达98.64%,OD220/OD260达到49.95。所得产物中Phe仅占总氨基酸的0.09%,且主要为600 Da以下的低聚肽及游离氨基酸,不含过敏性蛋白,完全满足GB 29922—2013中,关于PKU患者特膳食品中Phe限量(≤0.15 mg/g蛋白质等同物)的要求,适合将来为此类患者制备不同品类的特膳食品。
[1] CLEARY M A. Phenylketonuria[J]. Pediatrics & Child Health, 2011, 21(2): 61-64.
[2] 侯岚, 高媛, 宋利. 苯丙酮尿症的研究进展[J]. 中国实用医药, 2007, 2(24): 116-118.
[3] STRISCIUGLIO P, CONCOLINO D. New strategies for the treatment of phenylketonuria (PKU)[J]. Metabolites, 2014, 4(4): 1 007-1 017.
[4] ZANNINI E, KINGSTON W, ARENDT E K, et al. Technological challenges and strategies for developing low-protein/protein-free cereal foods for specific dietary management[J]. Food Research International, 2013, 54(1): 935-950.
[5] FEILLET F, AGOSTONI C. Nutritional issues in treating phenylketonuria[J]. Journal of Inherited Metabolic Disease, 2010, 33(6): 659-664.
[6] GIOVANNINI M, VERDUCI E, SALVATICI E, et al. Phenylketonuria: nutritional advances and challenges[J]. Nutrition & Metabolism, 2012, 9(1): 1-7.
[7] 吴乐斌, 刘汉民, 胡晨旭, 等. 一种用于苯丙酮尿症儿童的配方粉及其制备方法: 中国, CN10298604.9[P]. 2014-06-26.
[8] 周志伟, 张嘉芷, 许永红, 等. 低苯丙肽配方食品的研制[J]. 食品工业科技, 1999(S1): 96-100.
[9] 盛晓静, 王强, 石爱民, 等. 制备低苯丙氨酸特膳食品的研究进展[J]. 食品科学, 2016, 37(21): 285-290.
[10] CÉLIAMA G, GILSONA P, CHARLESDF J, et al. Producing a phenylalanine-free pool of peptides after tailored enzymatic hydrolyses of cheese whey[J]. Journal of Food Engineering, 2009, 91(1): 109-117.
[11] LARA G M, IZUMI M, GREENE L J, et al. Preparation and scaling up of a low phenylalanine enzymatic hydrolysate of bovine whey proteins[J]. Brazilian Journal of Pharmaceutical Sciences, 2005, 41(4): 459-466.
[12] LOPES D C F, DELVIVO F M, JANUARIO J N, et al. Phenylalanine removal from whey hydrolysates[J]. Journal of Food Technology, 2013(2): 191-197.
[13] VASCONCELLOS A M, OLIVEIRA C P, GRASSIANO D M, et al. Adsorption of phenylalanine from casein hydrolysates[J]. Applied Biochemistry & Biotechnology, 1992, 37(1): 69-80.
[14] CAPOBIANGO M, LOPES D C F, CARREIRA R L, et al. Optimization of enzyme assisted processes for extracting and hydrolysing corn proteins aiming phenylalanine removal[J]. International Journal of Food Engineering, 2007, 3(6): 1-19.
[15] CARREIRA R L, SILVA M R, STARLING A L P, et al. Association of two enzymes for obtaining low phenylalanine protein hydrolysates from wheat flour[J]. International Journal of Food Engineering, 2008, 4(7): 99-107.
[16] SILVESTRE M P C, VIEIRA C R, SILVA M R, et al. Use of an enzymatic process for extracting and hydrolyzing rice proteins aiming at phenylalanine removal[J]. International Journal of Food Engineering, 2009, 5(1): 64-67.
[17] 董欣, 王丽燕. 氨基酸紫外光谱的再测定[J]. 德州学院院报, 2015(2): 44-46.
[18] 陈瑞锋, 陈璐, 陈延登. 用活性炭分离纯化苯丙氨酸与酪氨酸的研究[J]. 浙江工业大学学报, 2006, 34(4): 373-376.
[19] 王梅, 谷文英, 沈蓓英. 活性炭色谱法分离制备高F值寡肽混合物[J]. 食品与生物技术学报, 1998, 17(4): 41-45.
[20] 王璋, 许时婴, 汤坚. 食品化学[M]. 北京: 中国轻工业出版社, 2007.
[21] 胡学智, 王俊. 蛋白酶生产和应用的进展[J]. 工业微生物, 2008, 38(4): 49-61.
[22] 赵振国, 金明钟. 氨基酸在固/水界面的吸附作用[J]. 离子交换与吸附, 2001, 17(5): 289-295.
[23] 高强, 徐耀, 吴东, 等. 氨基酸在固体表面的吸附[J]. 化学进展, 2007, 19(6): 1 016-1 025.
[24] 丛艳君, 程永强, 薛文通. 花生致敏蛋白的研究进展[J]. 食品科学, 2005, 26(S1): 176-178.
[25] 程云辉, 文新华. 生物活性肽制备的研究进展[J]. 食品与机械, 2001(4): 4-5.
