高粱醇溶蛋白提取工艺及其功能特性研究
2018-01-19Dan刘剑利曹向宇
刘 丹 Dan 刘剑利 - 王 帅 曹向宇 -
(辽宁大学生命科学院,辽宁 沈阳 110036)
高粱(Sorghum)又称乌禾、芦,属于禾本科高粱属,一年生的草本植物,与玉米、水稻和小麦称为四大粮食作物[1],也是一种主要的酿造原料,具有重要的经济价值[2]。高粱含有较多的多酚和高粱蜡[3],还含有大量的原花青素[4],具有良好的抗氧化、抗肿瘤、延缓衰老等多种功能,现已在医学和化工领域得到广泛应用。随着高粱中一些有益于健康的功能成分不断被发掘,高粱的研究与开发越来越受到人们的关注[3]。
醇溶蛋白是谷物主要的储存蛋白,在一些工业生产的副产物中,醇溶蛋白和谷蛋白的蛋白质含量约是全籽粒含量的3倍[5],但是这类副产物加工利用率很低。对其进行深加工,制备醇溶蛋白,既有利于资源的循环利用,又能产生良好的经济收益[6]。醇溶蛋白含丰富的谷氨酰胺和脯氨酸,缺乏带电氨基酸残基[7],这些性质使其具有良好的弹性、成形性、高韧性、生物降解能力和生物相容性[8]。醇溶蛋白约占高粱总蛋白的70%~90%,是主要的贮藏蛋白[9],对高粱蛋白质的生化和营养水平有着至关重要的影响[10]。
目前,高粱醇溶蛋白提取比较常用的方法包括有机溶剂提取法[11]、临界CO2萃取技术[12]、超声波溶剂提取法[13]等,但普遍存在蛋白质提取率偏低的问题,而且溶剂提取法使用的溶剂大多有毒、用量较大、回收麻烦,临界CO2萃取技术设备比较昂贵、生产成本较高[14]。因此寻求生产成本较低的、蛋白提取率高的方法,对于高粱醇溶蛋白开发具有重要意义。超声波法利用超声波动形式破坏组织,促进溶剂的穿透作用,提高有效成分的提取率[15-16]。碱性蛋白酶水解能力较优,蛋白质经水解后品质得到改善,溶解性明显提高,提取率显著上升[17]。本试验拟利用超声辅助酶法制备高粱醇溶蛋白,探索蛋白提取率相对较高的制备工艺,并对蛋白的功能特性进行研究,以期为高粱的综合利用与开发提供一定的试验基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
高粱:辽杂18号,市售;
碱性蛋白酶:酶活力20 000 U/g,国药集团化学试剂有限公司;
牛血清白蛋白:纯度>96%,北京奥博星生物技术有限公司;
其他试剂均为分析纯。
1.1.2 主要仪器设备
紫外分光光度计:UV-2700型,岛津企业管理(中国)有限公司;
超声波细胞粉碎机:SCIENTZ-IID型,冠森生物上海公司。
1.2 方法
1.2.1 高粱醇溶蛋白的提取 高粱粉碎,过120目筛备用;采用超声辅助酶法提取高粱醇溶蛋白[18]。
1.2.2 标准蛋白质曲线测定 参照文献[19]。595 nm处测定蛋白溶液吸光值(OD值),以标准蛋白浓度(μg/mL)为横坐标,吸光度值为纵坐标,制作蛋白标准曲线。
1.2.3 单因素试验方案 通过对影响蛋白提取的多个单因素进行预试验,选定对提取率影响较大的4个因素,以高粱醇溶蛋白的提取率为评价指标,进行试验。
(1) 乙醇浓度的选择:固定料液比1∶10 (g/mL),加酶量1%,pH 12,水浴温度55 ℃,酶作用时间3 h,超声功率200 W,超声时间20 min,分别考察乙醇浓度为50%,60%,70%,80%,90%时的高粱醇溶蛋白提取率。
(2) 酶作用时间的选择:固定料液比1∶10 (g/mL),加酶量1%,pH 12,乙醇浓度60%,水浴温度55 ℃,超声功率200 W,超声时间20 min,分别考察酶作用时间为1.5,2.0,2.5,3.0,3.5 h时的高粱醇溶蛋白提取率。
(3) 加酶量的选择:固定料液比1∶10 (g/mL),pH 12,水浴温度55 ℃,乙醇浓度60%,酶作用时间3 h,超声功率200 W,超声时间20 min,分别考察加酶量为0.5%,1%,2%,3%,4%时的高粱醇溶蛋白提取率。
(4) 超声时间的选择:固定料液比1∶10 (g/mL),加酶量1%,pH 12,乙醇浓度60%,水浴温度55 ℃,酶作用时间3 h,超声功率200 W,分别考察超声时间为5,10,20,30,40 min 时的高粱醇溶蛋白提取率。
1.2.4 响应面试验 采用Box-Behnken设计,在单因素的基础上,选取对高粱醇溶蛋白影响显著的4个因素,采用四因素三水平的组合设计,以高粱醇溶蛋白提取率为指标优化提取工艺参数[20]。
1.2.5 静置温度和时间对高梁醇溶蛋白持油性与持水性的影响 称取1 g高粱醇溶蛋白,加入5 mL色拉油(蒸馏水)充分混匀,静置温度分别为15,25,35,45,55,65 ℃,静置时间分别为10,20,30,40,50,60 min,静置结束后5 000 r/min离心15 min,分别考察静置温度和时间对持油性与持水性的影响。醇溶蛋白持油性(持水性)按式(1)计算:
(1)
式中:
R——持油性(持水性),g/g;
m1——样品蛋白质量,g;
m2——离心后沉淀质量,g。
1.2.6 数据分析 试验重复3次,结果取平均值,数据采用SPSS 19.0进行统计分析。
2 结果与分析
2.1 标准曲线的绘制
如图1所示,蛋白质含量与其在595 nm处的吸光度值呈良好的相关性,其中R2=0.991 5,符合测定标准,根据公式y=0.009 1x+0.054可计算出提取液中蛋白质含量。
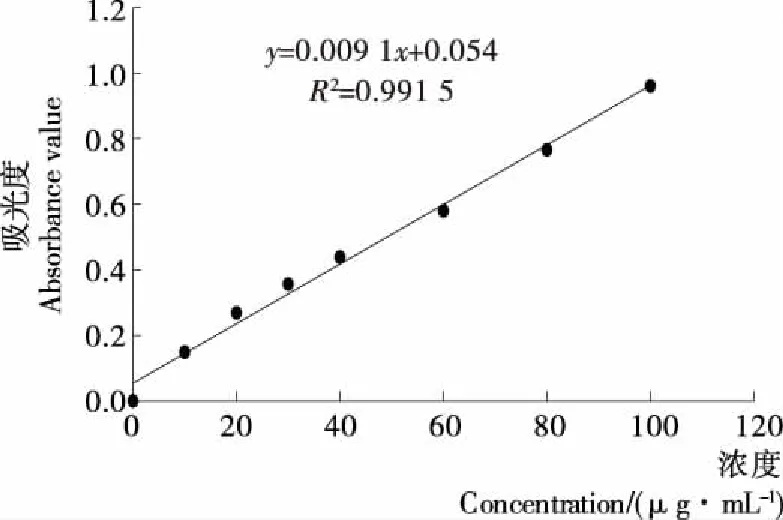
图1 标准蛋白质曲线
2.2 单因素试验结果
2.2.1 乙醇浓度对提取率的影响 由图2可知,当乙醇浓度为60%时高粱醇溶蛋白的得率达到峰值,之后得率逐渐减小。可能是乙醇浓度较高引起部分蛋白变性,导致蛋白粒子聚集从而使部分蛋白以聚集粒子的形式被离心分离,降低了蛋白提取率[21]。故确定乙醇浓度单因素最佳条件为60%。
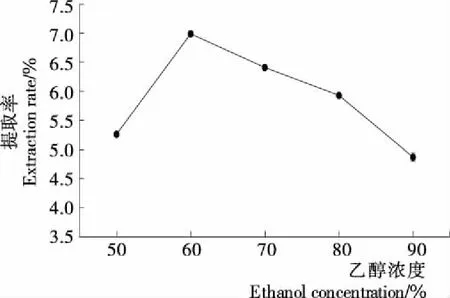
图2 乙醇浓度对提取率的影响
2.2.2 酶作用时间对提取率的影响 由图3可知,3 h时高粱醇溶蛋白提取率最大,之后提取率呈下降趋势。这是因为反应前期底物浓度、酶活性较高,提取率上升较快;但随着酶解时间延长,反应产物的积累抑制了酶的活力,同时部分溶出蛋白质被水解,导致蛋白提取率下降[22]。因此选取3 h作为酶最佳作用时间。
2.2.3 加酶量对提取率的影响 由图4可知,加酶量为0.5%~1.0%时,高粱醇溶蛋白提取率明显增大,并在1%时达到最大值,之后提高酶的添加量,得率逐渐降低。

图3 酶作用时间对提取率的影响
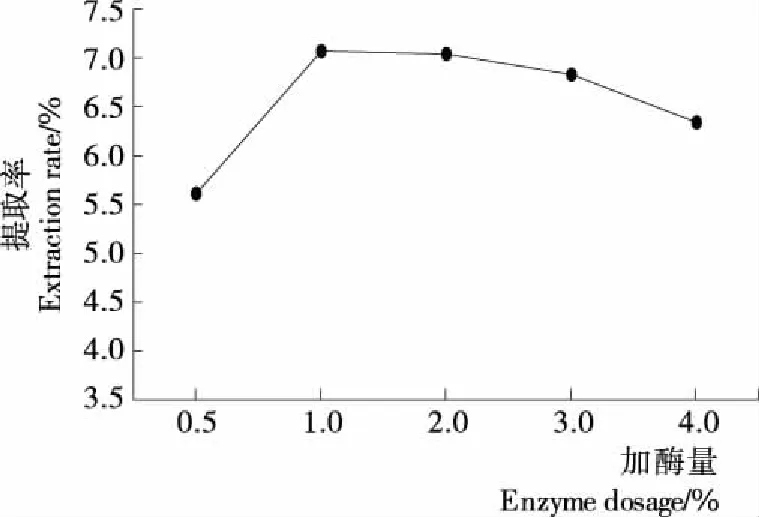
图4 加酶量对提取率的影响
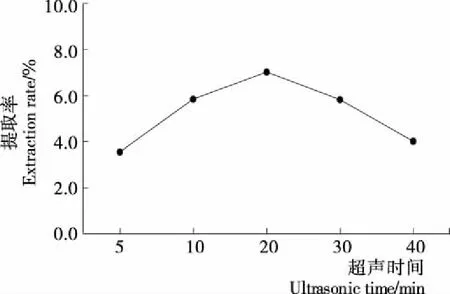
图5 超声时间对提取率的影响
2.2.4 超声时间对提取率的影响 由图5可知,超声时间为5~20 min时,提取率逐渐上升,20 min时达到最大值。在董红敏等[23]的试验中也得到相似的结果,原因是随着超声时间延长,蛋白提取率逐渐增加,但超声时间过长会影响蛋白质的活性,导致蛋白的提取率下降。
2.3 响应面试验
以得到的单因素试验结果为依据,根据Box-Behnken试验设计,得到高粱醇溶蛋白提取的响应面因素设计水平,见表1。
通过响应面试验得到数据,具体见表2。
2.4 回归模型方差分析
用软件设计Design-Expert 8.0.6.1对数据进行多元回归拟合,获得各因素的二元多项回归方程:
Y=7.29-0.035×A+0.048×B+0.032×C-0.024×D+0.027×AB+0.055×AC-0.023×AD-0.002 088×BC-0.035×BD-0.006 675×CD-0.17×A2-0.15×B2-0.19×C2-0.17×D2。
(2)
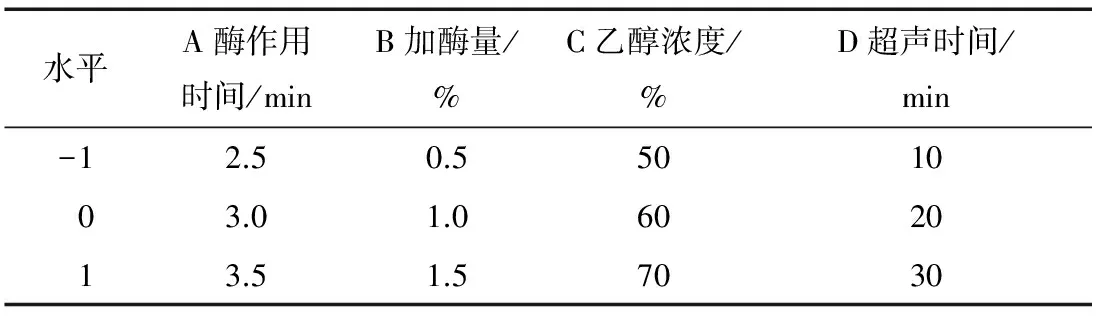
表1 Box-Benhnken试验设计水平
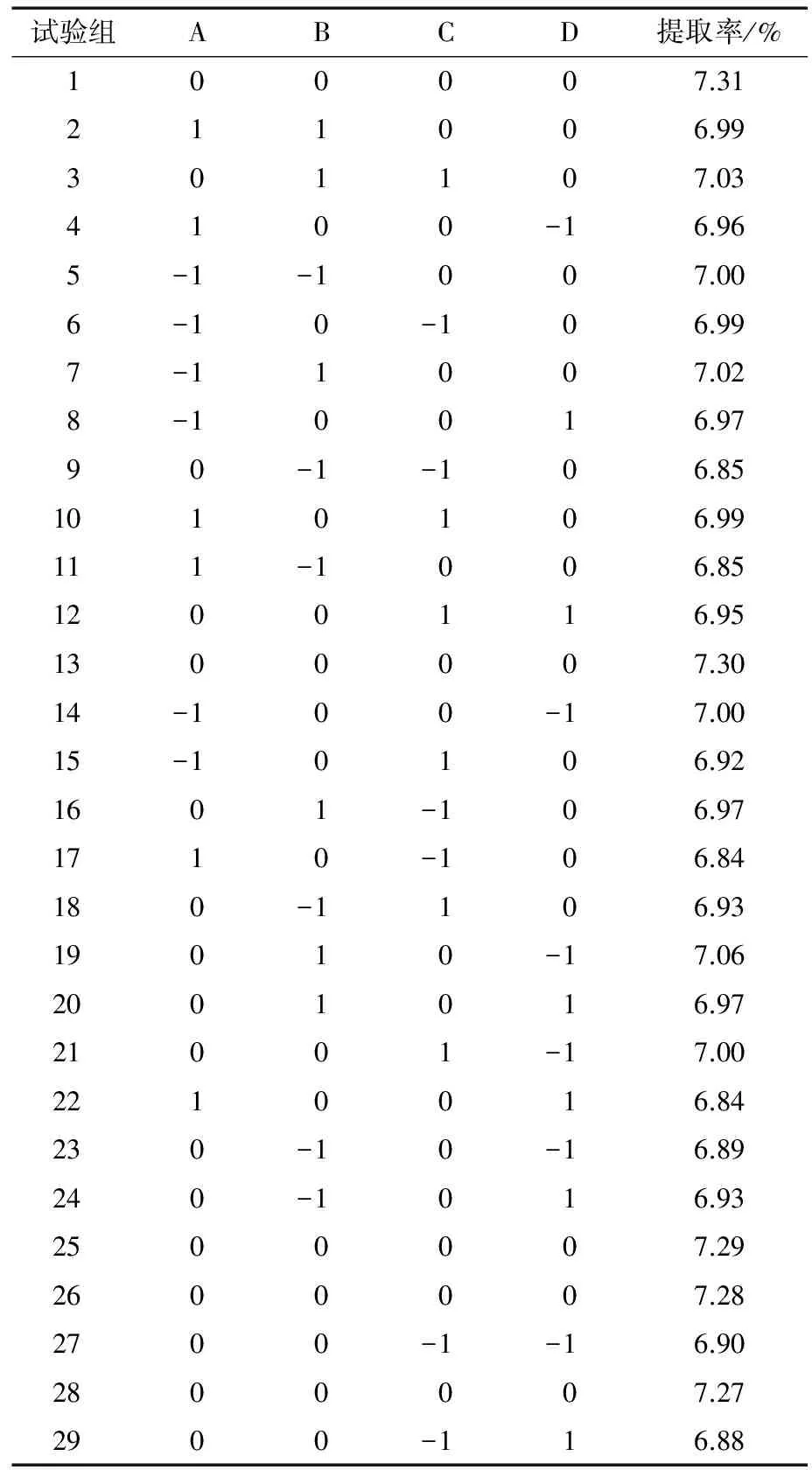
表2 Box-Benhnken试验设计结果
2.5 双因素交互作用分析
各因素交互作用对得率的影响见图6。曲线越陡峭,说明该因素对蛋白得率影响越大[24]。从等高线的形状也能看出交互效应的大小,等高线呈圆形,表示两因素交互作用不显著;呈椭圆型或者马鞍形表示交互作用显著[25]。根据三维曲面图可看出,加酶量在0.9%~1.3%的范围内对蛋白提取率最优;当酶作用时间在2.7~3.1 h时提取率最佳;最适的乙醇浓度为59%~63%;最适的超声时间为18~22 min,与单因素结果相符。同时也可看出对醇溶蛋白提取率影响最大的因素为加酶量,其他因素次之,表3回归分析结果也与此相吻合,且各项单因素对应的P值<0.01,皆达到极显著水平。
2.6 验证实验
利用Design-Expert 8.0.6.1软件得到高粱醇溶蛋白的最佳提取条件为:加酶量1.08%、酶作用时间2.96 h、乙醇浓度60.76%和超声波作用时间19.17 min,在此条件下醇溶蛋白的理论提取率为7.29%。考虑到实际操作中遇到问题,将此工艺修整为:加酶量1%、酶作用时间3 h、乙醇浓度60%和超声波作用时间19 min,经多次试验后,得出蛋白得率为(7.19±0.36)%,理论值与试验值基本吻合,证实试验设计可靠。
2.7 静置温度和时间对高粱醇溶蛋白持油性与持水性的影响
2.7.1 静置温度对持油性与持水性的影响 由图7所示,温度变化范围为15~65 ℃时,持油性呈现出先上升后下降的变化趋势。在35 ℃得到峰值,之后随着温度继续上升,持油性下降。这是由于温度的升高,加强了油的流动性,导致蛋白质变性,降低了蛋白质与油之间的相互作用[26]。持水性在15~35 ℃时迅速增大,在温度为35 ℃时,醇溶蛋白持水性达到顶峰,当温度在35~65 ℃时,持水性呈现下降趋势。这是因为低温环境下,蛋白质构象发生变化较松散,温度上升后加速蛋白质分子运动,增强了蛋白质分子与水分子的之间相互作用[27];但是当温度过高时,蛋白质分子内部的许多非极性基团显露出来,削弱了蛋白质与水之间的相互作用。
2.7.2 静置时间对持油性与持水性的影响 由图8可知,高粱醇溶蛋白持油性随着静置时间的延长呈现先上升后平稳的趋势,在40 min时持油性达到最大值。因为当时间达到40~50 min时,高粱醇溶蛋白因为不同的理化与结构特性导致蛋白质的持油性达到了饱和状态,当时间继续延长时,蛋白质的持油性不再增加[28]。高粱醇溶蛋白持水性随着静置时间的延长而逐步加大,持水性在静置40 min时达到顶峰,可能是随着时间的延长,水在蛋白中能够更加均衡分布,因此持水性上升[29]。超过40 min后,持水性上升趋势减弱,达到饱和状态,趋于稳定。
3 结论
本试验通过对加酶量、酶作用时间、乙醇浓度和超声波时间4个因素的探究,建立了影响高粱醇溶蛋白提取率的二次多项数学模型,优化得出高粱醇溶蛋白超声辅助酶法提取的最佳工艺条件为:加酶量1%、酶作用时间3 h、乙醇浓度60%、超声波作用时间19 min。该条件下蛋白得率为(7.19±0.36)%。通过对高粱醇溶蛋白功能特性的检测得出,在静置时间40 min和温度为35 ℃条件下时,其持油性最大值为(2.84±0.15) g/g,持水性最大值为(2.78±0.09) g/g。超声辅助酶法制备高粱醇溶蛋白是一种较优的方法,增加了醇溶蛋白的提取率,本试验提取率比刘振春[3]超声波协同微波提取法高5.89%。今后将对高粱醇溶蛋白的功能特性进行全面研究,使其更适应大规模工业化生产,为高粱深加工及其新产品的开发与利用提供试验依据。
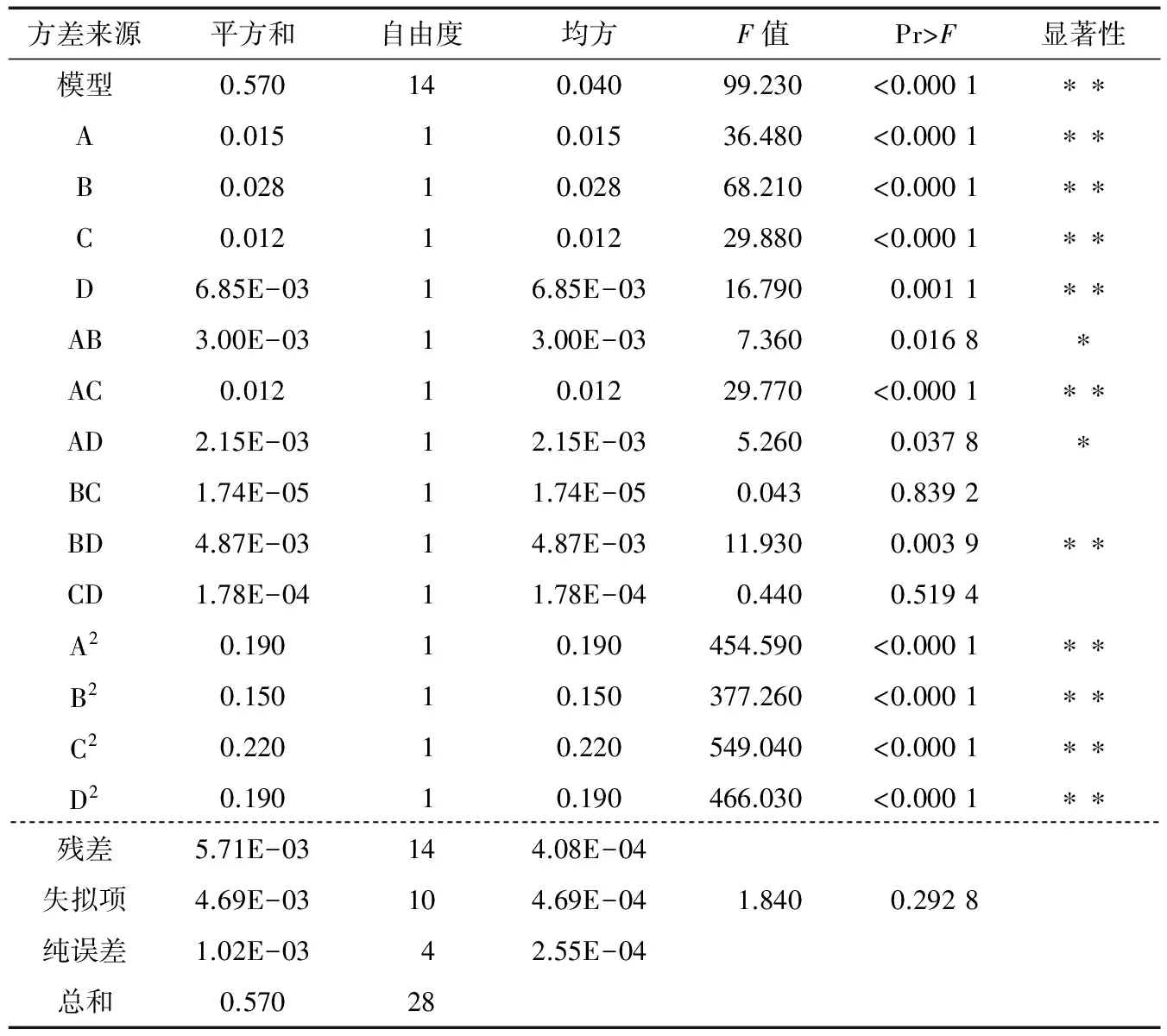
表3 响应面试验回归模型方差分析†
† **表示差异极显著(P<0.01);*表示差异显著(P<0.05)。
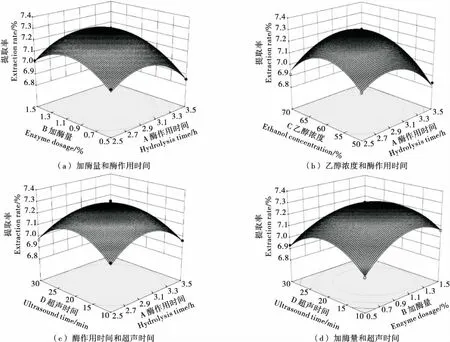
图6 加酶量和酶作用时间、乙醇浓度和酶作用时间、酶作用时间和超声时间、加酶量和超声时间相互作用
Figure 6 Response surface and contour plots for the effects of interaction between Enzyme dosage and Hydrolysis time, Ethanol concentration and enzyme action time, Enzyme action time and ultrasound time, Enzyme dose and ultrasound time

图7 静置温度对持油性和持水性的影响
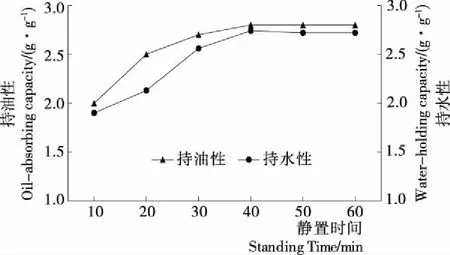
图8 静置时间对持油性和持水性的影响
[1] 王红育, 李颖. 高粱营养价值及资源的开发利用[J]. 食品研究与开发, 2006, 27(2): 91-93.
[2] 马涛, 周佳, 张良晨. 膨化高粱粉在面包中的应用[J]. 食品与机械, 2011, 27(5): 165-167.
[3] 刘振春, 耿存花, 孙慧娟, 等. 响应面优化超声波-微波协同提取高粱醇溶蛋白工艺[J]. 食品科学, 2014, 35(4): 21-25.
[4] 黄朝晖, 陆平, 孟宪军, 等. 不同产地高粱的原花青素含量测定及其抗氧化活性分析[J]. 食品工业科技, 2008, 29(9): 140-144.
[5] WANG Cheng, TIAN Zhi-gang, CHEN Ling-yun, et al. Functionality of barley proteins extracted and fractionated by alkaline and alcohol methods[J]. Cereal Chemistry, 2010, 87(6): 597-606.
[6] 曹威. 大麦醇溶蛋白的提取、性质及成膜研究[D]. 武汉: 武汉轻工大学, 2015: 1-2.
[7] SHEWRY P R, TATHAM A S. The prolamin storage proteins of cereal seeds: structure and evolution[J]. Biochemical Journal, 1990, 267(1): 1.
[8] BIETZ J A. Cereal prolamin evolution and homology revealed by sequence analysis[J]. Biochemical Genetics, 1982, 20(11): 1 039-1 053.
[9] BELTON P S, DELGADILLO I, HALFORD N G, et al. Kafirin structure and Functionality[J]. Journal of Cereal Science, 2006, 44(3): 272-286.
[10] 郭海峰. 高粱种质资源种子醇溶谷蛋白的SDS-PAGE表型多样性[D]. 太原: 山西大学, 2009: 1-2.
[11] 熊皖扬, 陈劲春. 响应面法优化玉米黄粉中玉米黄素和玉米醇溶蛋白的提取工艺[J]. 食品科技, 2011, 36(7): 148-152.
[12] 王大为, 邵信儒, 张艳荣. 超临界CO2萃取对玉米醇溶蛋白提取率及水解度影响的研究[J]. 食品科学, 2005, 26(8): 166-170.
[13] 李娜, 刘冬, 徐怀德, 等. 响应面法优化超声波提取玉米醇溶蛋白工艺[J]. 食品科技, 2012, 37(2): 183-187.
[14] 耿存花. 高粱醇溶蛋白的提取及应用研究[D]. 长春: 吉林农业大学, 2014: 4-5.
[15] 于慧, 刘美佳, 曹向宇, 等. 玉米黄色素提取工艺优化及其抗癌活性研究[J]. 食品与机械, 2017, 33(3): 141-146.
[16] 杨昱, 白靖文, 俞志刚. 超声辅助提取技术在天然产物提取中的应用[J]. 食品与机械, 2011, 27(1): 170-174.
[17] 吕飞, 许宙, 程云辉. 米糠蛋白提取及其应用研究进展[J]. 食品与机械, 2014, 30(3): 234-238.
[18] 何义萍, 韩小贤, 赵亚娟, 等. 碱法和超声辅助酶法分离燕麦淀粉的比较研究[J]. 食品与机械, 2011, 27(6): 95-97.
[19] 程皓. 米糠蛋白的提取、酶解及其功能特性的研究[D]. 大庆: 黑龙江八一农垦大学, 2014: 13-14.
[20] 单斌, 张卫国, 谢建华, 等. 响应面法优化超声辅助提取苦瓜多糖工艺的研究[J]. 食品与机械, 2009, 25(1): 76-80.
[21] 岳喜庆, 徐明, 王澜儒. 响应曲面法优化鹿茸蛋白提取条件[J]. 食品研究与开发, 2011, 32(9): 59-62.
[22] JEBRAIL M J, WHEELER A R. Digital microfluidic method for protein extraction by precipitation[J]. Analytical Chemistry, 2009, 81(1): 330-335.
[23] 董红敏, 牛小勇, 沈丽雯, 等. 响应面设计优化川明参蛋白提取工艺[J]. 食品工业科技, 2015, 36(2): 276-281.
[24] 吴晖, 赖富饶, 胡筱波. 响应面分析法优化油菜花粉多糖提取工艺的研究[J]. 食品与机械, 2007, 23(5): 66-70.
[25] MURALIDHAR R V, CHIRUMAMILA R R, MARCHANT R, et al. A response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon sources[J]. Biochemical Engineering Journal, 2001, 9(1): 17-23.
[26] 孙小斐, 乔玉辉. 不同因素对白果蛋白持油性、持水性和起泡性的影响[J]. 食品与机械, 2012, 28(3): 17-20.
[27] 陶蔚孙, 李惟, 蒋涌明. 蛋白质分子基础[M]. 北京: 高等教育出版社, 1995: 33-36.
[28] 姜欢, 缪铭, 江波. 不同品种白果淀粉的理化性质研究[J]. 食品工业科技, 2011, 32(6): 182-184.
[29] 石晓, 浮吟梅. 花生蛋白持水性研究[J]. 粮油加工, 2006(9): 56-60.
