反相高效液相色谱法-蒸发光散射检测器测定普瑞巴林原料药中普瑞巴林R- 对映异构体的含量
2018-01-19明叶
, , , , , 明叶
(1. 迪沙药业集团国家认定企业技术中心, 威海 264200; 2. 烟台万润药业有限公司, 烟台 264000)
普瑞巴林是一种新型抗癫痫药,它的化学结构上具有γ-氨基丁酸,具有抗痉挛作用,由辉瑞公司研发,用于治疗外周神经痛,或辅助治疗部分性癫痫发作。2008年12月,美国食品药品管理局(FDA)批准普瑞巴林(商品名“乐瑞卡”)用于治疗糖尿病性外周神经痛(DPN)和疱疹后遗神经痛(PHN)这两种最常见的神经性疼痛[1-3]。
普瑞巴林化学名为(S)-3-(氨甲基)-5-甲基己酸,该化合物结构中有1个手性中心,存在一个光学异构体,即普瑞巴林R-对映异构体。普瑞巴林及普瑞巴林R-对映异构体对该药物的作用受体具有不同的亲和力,表现出不同的药代动力学特征和药理作用,其中普瑞巴林为药物有效成分[4-5]。根据国家食品药品监督管理局药物审评中心颁布的《化学药物杂质研究的技术指导原则》[6]中要求,普瑞巴林R-对映异构体作为普瑞巴林的杂质进行研究控制。随着色谱分离检测技术的发展,气相色谱法、液相色谱法及毛细管电泳色谱法等均已应用到光学异构体的检测,特别是手性固定相高效液相色谱法已广泛应用到光学异构体的检测[7-12]。由于普瑞巴林的紫外响应低,检测灵敏度差,故开发了反相高效液相色谱串联蒸发光散射检测法用于检测普瑞巴林R-对映异构体。
已报道有两种手性高效液相色谱法测定普瑞巴林中光学异构体的含量,一种方法是以Chiralcel OD-H手性柱为分离柱,流动相为正己烷-异丙醇-三氟乙酸(965+32+3)混合液,采用蒸发光散射检测器(ELSD)[13];另一种方法以柱前衍生化高效液相色谱法测定普瑞巴林中的光学异构体[14-15],采用Na-(5-氟-2,4-二硝基苯基)-L-丙胺酰胺(FDNPAA)作为柱前衍生化试剂,该试剂与普瑞巴林的物质的量之比在2.96以上可定量反应,生成的化合物可用普通色谱柱分离以紫外检测器测定。
第一种方法运用正相色谱,正相色谱的酸碱调节剂比较单一,对方法开发存在局限性,且所用溶剂挥发性强,极不环保;且很多药品为水溶性药物,在异丙醇中溶解性不好,这样的供试品溶液进入体系后极易堵塞色谱柱,同时由于进入正相体系后分散程度不好导致峰形变差;第二种方法为衍生化法,操作复杂,且衍生化程度受每次衍生化反应限制。
鉴于以上原因,本工作开发反相两性手性色谱柱串联蒸发光散射检测器法用于测定普瑞巴林原料药中普瑞巴林R-对映异构体的含量,采用甲醇、水等经济易得、环保实用的常用溶剂,用缓冲溶液调节酸度以实现最佳分离。
1 试验部分
1.1 仪器与试剂
Agilent 1260型高效液相色谱仪,配Aglient色谱工作站和ELSD 2000ES型蒸发光散射检测器;DL-1000D型智能超声仪。
对照品储备溶液:称取普瑞巴林R-对映异构体适量,加水溶解后配成质量浓度约30.0 mg·L-1的溶液。使用时用水稀释成所需质量浓度。
甲醇、乙腈为色谱纯;二乙胺、甲酸为分析纯;消旋体(普瑞巴林与普瑞巴林R-对映异构体的物质的量比为1∶1)纯度不小于99.0%;普瑞巴林R-对映异构体纯度不小于99.0%。
1.2 色谱条件
CHIRALPAK ZWIX(+)手性色谱柱(4.0 mm×150 mm,3 μm);以甲醇-乙腈-水-甲酸-二乙胺(450+450+100+2.0+2.5)为流动相,流量为0.5 mL·min-1;柱温为25 ℃;蒸发光散射检测器漂移管温度为70 ℃,载气流量为2.0 L·min-1。
1.3 试验方法
1.3.1 方法开发溶液
称取消旋体适量,加水溶解后配成各异构体质量浓度约为2 g·L-1的溶液,作为方法开发溶液。
1.3.2 系统适用性溶液
称取普瑞巴林与普瑞巴林R-对映异构体对照品各适量,用流动相溶解并定量稀释制成每1 mL中约含普瑞巴林2.0 mg,普瑞巴林R-对映异构体3.0 μg的混合溶液,作为系统适用性试验溶液。
1.3.3 供试品溶液
称取样品适量,用水溶解并适当稀释,作为供试品溶液。
2 结果与讨论
2.1 色谱条件优化
2.1.1 流动相体系
分别选用甲醇-水(900+100)、甲醇-水-甲酸(900+100+2.0)、甲醇-水-甲酸-二乙胺(900+100+2.0+2.5)、甲醇-乙腈-水-甲酸-二乙胺(700+200+100+2.0+2.5)、甲醇-乙腈-水-甲酸-二乙胺(450+450+100+2.0+2.5)等5种流动相体系,在仪器工作条件下进样方法开发溶液,所得色谱图见图1。
由图1可知:以甲醇-水(900+100)为流动相,异构体与普瑞巴林色谱峰拖尾,峰展宽较大,峰形差,分离度差;以甲醇-水-甲酸(900+100+2.0)为流动相,异构体与普瑞巴林色谱峰的峰形得到改善,但两峰重合;以甲醇-水-甲酸-二乙胺(900+100+2.0+2.5)为流动相,异构体与普瑞巴林色谱峰的峰形佳,不拖尾,但不能达到基线分离;以甲醇-乙腈-水-甲酸-二乙胺(700+200+100+2.0+2.5)为流动相,异构体与普瑞巴林色谱峰的峰形佳,不拖尾,仍不能达到基线分离;以甲醇-乙腈-水-甲酸-二乙胺(450+450+100+2.0+2.5)为流动相,异构体与普瑞巴林之间色谱峰的分离度好,峰形尖锐,分析周期合理。因此,试验选择甲醇-乙腈-水-甲酸-二乙胺(450+450+100+2.0+2.5)作为流动相体系。
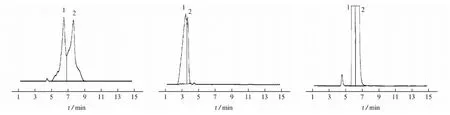
(a) 甲醇-水(900+100) (b) 甲醇-水-甲酸(900+100+2.0) (c) 甲醇-水-甲酸-二乙胺(900+100+2.0+2.5)
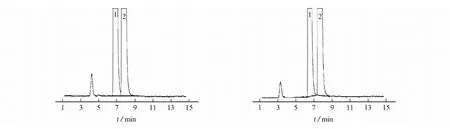
(d) 甲醇-乙腈-水-甲酸-二乙胺(700+200+100+2.0+2.5) (e) 甲醇-乙腈-水-甲酸-二乙胺(450+450+100+2.0+2.5) 1-普瑞巴林R-对映异构体;2-普瑞巴林图1 不同流动相条件下的色谱图Fig. 1 Chromatograms with different mobile phases
2.1.2 柱温
以甲醇-乙腈-水-甲酸-二乙胺(450+450+100+2.0+2.5)为流动相,在仪器工作条件下分别在25,30,40 ℃的柱温下进样方法开发溶液。结果表明:随着柱温的升高,异构体与普瑞巴林之间分离度无明显变化,25 ℃较30 ℃和40 ℃更利于色谱柱使用寿命的延长,因此试验选择柱温为25 ℃。
2.2 蒸发光散射检测器条件的选择
试验对ELSD的漂移管温度及载气的流量进行了考察。当用乙腈(1 mL·min-1)为溶剂时,对应漂移管温度为70 ℃,气体流量为1.7 L·min-1;当用甲醇(1 mL·min-1)为溶剂时,对应漂移管温度为60 ℃,气体流量为1.6 L·min-1;当用水(1 mL·min-1)为溶剂时,对应漂移管温度为115 ℃,气体流量为3.2 L·min-1。根据ELSD使用手册,按流动相中混合溶剂的比率,计算混合流动相所需的初始温度和气体流量。对于甲醇-乙腈-水-甲酸-二乙胺(450+450+100+2.0+2.5)流动相体系,计算得初始温度为70 ℃,气体流量为1.8 L·min-1。
2.2.1 漂移管温度
试验考察了漂移管温度为60,70,80 ℃时对测定结果的影响。结果发现:在较低温度下噪声稍大,基线不稳;当温度为70,80 ℃时,噪声较小,基线较平稳。由于较高的温度对被测样品的稳定性会有影响,试验选择70 ℃作为漂移管温度。
2.2.2 载气流量
试验考察了载气流量分别为1.6,2.0,2.5 L·min-1时对测定结果的影响。结果发现:载气流量越小,检测灵敏度越低;随着流量增大,检测灵敏度升高,但是到达2.5 L·min-1以后,载气流量的升高对检测灵敏度无影响。综合考虑,试验选择载气流量为2.0 L·min-1。
2.3 分析方法验证
2.3.1 专属性
在仪器工作条件下进样系统适用性溶液,色谱图见图2。
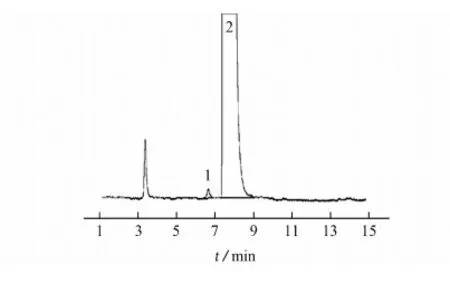
1-普瑞巴林R-对映异构体;2-普瑞巴林图2 系统适用性溶液的色谱图Fig. 2 Chromatogram of the system suitability solution
由图2可知:普瑞巴林R-对映异构体和普瑞巴林能有效分离(分离度均大于2.0),空白溶剂峰不干扰测定。说明色谱条件专属性较好。
2.3.2 标准曲线、检出限和测定下限
移取对照品储备溶液适量,逐步稀释配制成6份溶液,在仪器工作条件下进样分析,记录色谱图。以峰面积y对质量浓度x作回归处理,结果表明:普瑞巴林R-对映异构体的质量浓度在0.80~4.5 mg·L-1内呈线性,线性回归方程为y=0.189 4x-0.058 1,相关系数为0.995 3。
取对照品溶液,用水逐步定量稀释,在仪器工作条件下进样分析,当信噪比(S/N)为3~5时,普瑞巴林R-对映异构体的质量浓度为0.30 mg·L-1;当信噪比(S/N)为10时,普瑞巴林R-对映异构体的质量浓度为0.80 mg·L-1。因此,检出限和测定下限分别为0.30,0.80 mg·L-1。
2.3.3 精密度
按照1.3.2节中系统适用性溶液配制方法,制备6份系统适用性溶液,在仪器工作条件下进样分析,测定普瑞巴林R-对映异构体的含量,计算得6次测定结果的相对标准偏差(RSD)为1.9%,说明方法的重复性良好。
按照1.3.2节中系统适用性溶液配制方法,制备6份系统适用性溶液,由不同试验人员在不同试验日期在仪器工作条件下进样分析,测定普瑞巴林R-对映异构体的含量,计算得RSD为2.4%,说明方法的精密度较高。
2.3.4 回收试验
称取普瑞巴林样品约20 mg至10 mL容量瓶中,分别加入30.0 mg·L-1普瑞巴林R-对映异构体储备溶液0.80 mL,用水溶解后定容,摇匀,即为加标80%溶液,平行配制3份。同法配制加标100%、加标120%溶液。在仪器工作条件下进样分析,计算得加标回收率在93.8%~94.5%之间,能够满足普瑞巴林原料药中普瑞巴林R-对映异构体检测的需要。
2.3.5 溶液稳定性
配制系统适用性溶液,分别在0,1,2,4,8,24 h后进行测定,结果表明:室温条件下放置24 h内溶液稳定,6次测定结果的RSD为2.2%。
2.4 样品分析
采用建立的方法测定4批普瑞巴林原料药中普瑞巴林R-对映异构体的含量,均未检出普瑞巴林R-对映异构体。
本工作建立了测定普瑞巴林原料药中普瑞巴林R-对映异构体含量的两性反相高效液相色谱法,与已有的方法相比,该方法快速、有效、灵敏,能够满足生产中对普瑞巴林原料药中普瑞巴林R-对映异构体含量测定的要求。
[1] BELLIOTTI T R, CAPIRIS T, VICTOR E I, et al. Structure-activity relationships of pregabalin and analogues that target the alpha (2)-delta protein[J]. Med Chem, 2005,48(7):2294-2307.
[2] KAWALEC P, CIERNIAK A, PILC A, et al. Pregabalin for the treatment of social anxiety disorder[J]. Drugs, 2015,24(4):585-587.
[3] KOSTIC N, DOTSIKAS Y, JOVIC N, et al. Quantitation of pregabalin in dried blood spots and dried plasma spots by validated LC-MS/MS methods[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015,109:79-84.
[4] LAURIA-HORNER B A, POHL R B. Pregabalin:a new anxiolytic[J]. Expert Opin Invest Drugs, 2003,12(4):663-672.
[5] LEE C H, LIOU H H. Pregabalin activates ROMK1 channels via cAMP-dependent protein kinase and protein kinase C[J]. European Journal of Pharmacology, 2014,740:35-36.
[6] 国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社, 2015.
[7] 姚彤炜.手性药物分析[M].6版.北京:人民卫生出版社, 2008.
[8] 李发美.分析化学[M].6版.北京:人民卫生出版社, 2010.
[9] 潘城,郑小严,黄红霞,等.高效液相色谱/蒸发光散射检测法同时测定饲料中12种甜味剂[J].分析测试学报, 2015,34(10):1107-1112.
[10] 王东武,王西宁,丰梅君,等.手性固定相高效液相色谱法同时测定琥珀酸索利那新原料药中对映异构体和非对映异构体[J].分析测试学报, 2014,33(10):1123-1128.
[11] 罗立梅,陈朝银,李时琪,等.高效液相色谱-蒸发光散射法测定皂荚壳多糖的单糖组分及其含量[J].理化检验-化学分册, 2013,49(3):270-273.
[12] 沈少林,陆文琪,张惠雄.高效液相色谱-蒸发光散射法同时测定蜂蜜中果糖、葡萄糖、蔗糖和麦芽糖[J].理化检验-化学分册, 2015,51(9):1330-1332.
[13] 陈亮,王国海,陈建征,等.HPLC-ELSD法测定普瑞巴林的光学纯度[J].福建分析测试, 2009,18(3):14-18.
[14] 张道林,邓杰,陈晓晖,等.柱前衍生化高效液相色谱法测定普瑞巴林中的光学异构体[J].药物分析杂志, 2007,27(12):1884-1886.
[15] CHEN X H, ZHANG D L, DENG J, et al. Determination of optical impurity of pregabalin by HPLC with pre-column chiral derivatization[J]. Journal of Chromatographic Science, 2008,46(1):42-44.
