利用核-壳亚3微米填料色谱技术快速测定镇痛类健康产品中25种非法添加药物
2018-01-19,,,
, , ,
(1. 广东省药品检验所, 广州 510180; 2. 广东药学院 药科学院, 广州 510006; 3. 广州中医药大学, 广州 510006; 4. 广东省食品检验所, 广州 510165)
近年来,中成药、保健食品及医疗器械等健康产品中非法添加现象层出不穷,其中,镇痛类健康产品已成为非法添加的重灾区,一直是药物分析领域的研究热点[1-3]。由于解热镇痛抗炎及糖皮质激素类药物具有抗炎、抗风湿和解热镇痛等作用,具有起效迅速、疗效显著的特点,该类药物已成为镇痛类健康产品中非法添加的主要成分[4-9]。目前,保健品或中成药中非法添加有关解热镇痛类化学成分的检测标准为国家食品药品监督管理局颁布的补充检验方法200925。该方法仅包含13种药物成分,未能覆盖目前文献报道的已发现的非法添加成分[10-14]。另外,该补充检验方法使用3个液相色谱体系对13种成分进行分离,工作效率较低。因此,建立一套分析对象覆盖面广、通用性好的检测方法,对镇痛类健康产品开展非法添加筛查工作有着现实意义。
自高效液相色谱技术问世以来,追求更高效、更快速的色谱分离一直是液相色谱技术的发展方向。色谱柱的填料技术已经历了数十年的发展,从最初的薄膜大颗粒,演变成粒径较小的全多孔形颗粒,最后发展为粒径小于2微米的全多孔球形颗粒[15]。虽然粒径极小的亚2微米填料的色谱柱大大提高了分析效率和分离柱效,但如此小的粒径却带来了极高的系统压力,只能应用于超高效液相色谱仪,同时存在筛板容易堵塞的问题。直到21世纪初,KIRKLAND将实心硅胶微球引入到聚合诱导胶体凝聚体系中,发明了一种核-壳型亚3微米硅胶微球的色谱柱填料[16]。与传统全多孔填料相比,这种填料最大优势在于其实心的硅核减小了颗粒内部扩散路径与传质阻抗,因此可以使用更短的色谱柱和较高的流量达到快速分离及较小的峰展宽,从而实现高通量分析,大大提高了分析效率。更重要的是,核-壳型亚3微米填料的色谱柱还能维持相对较低的压力状态,柱压仅相当于亚2微米全多孔填料色谱柱的一半[17-19],能在常规高效液相色谱仪上实现超高效液相色谱仪的分析效果,成为色谱技术发展史上里程碑式的突破。然而,对核-壳亚3微米填料色谱柱的方法学研究报道较多,国内在实际应用的报道相对较少[8,20-21]。本工作以补充检验方法200925包含的13种成分及其他文献报道的12种成分为研究对象,采用核-壳亚3微米填料的色谱柱,建立了镇痛类健康产品中25种非法添加药物的高效液相色谱快速检测方法。
1 试验部分
1.1 仪器与试剂
Agilent 1260 Infinity型高液相色谱仪,配自动进样器;G1315D型二极管阵列检测器;PB-10型pH计。
标准溶液:分别称取26种药物成分(包括阿司匹林水解产物水杨酸)的标准物质20 mg,置于20 mL容量瓶中,用甲醇溶解并配制成质量浓度约为1 000 mg·L-1标准储备溶液(吡罗昔康溶液中加1滴氨水促溶)。临用时,取上述储备溶液用初始比例流动相稀释配制成不同浓度标准溶液。
对乙酰氨基酚、阿司匹林、龙胆苦苷、甲氧苄啶、氨基比林、非那西丁、氢化可的松、酮洛芬、芬布芬、醋酸泼尼松、水杨酸、地塞米松、萘普生双氯芬酸钠、吲哚美辛、醋酸地塞米松、布洛芬、磺胺甲噁唑、吡罗昔康、萘丁美酮、保泰松、泼尼松、舒林酸、异丙安替比林、奥沙普秦、甲基泼尼松龙标准物质。
甲醇、乙腈、乙酸铵为色谱纯。
1.2 色谱条件
Phenomenex Kinetex XB-C18色谱柱(100 mm×4.6 mm,2.6 μm),柱温35 ℃;进样量10 μL;检测波长254 nm(除布洛芬外25种成分),220 nm(布洛芬);流动相A为乙腈-甲醇(2+1)溶液,B为0.02 mol·L-1乙酸铵溶液(用乙酸调节pH 4.2);流量1.0 mL·min-1。梯度洗脱程序:0~4 min时,A由10%升至20%;4~6 min时,A由20%升至42%;6~11 min时,A由42%升至45%;11~14 min时,A由45%升至50%;14~17 min时,A由50%升至70%;17~17.5 min时,A由70%降至10%,保持2.5 min。
1.3 试验方法
称取固体样品(丸剂与片剂需研细,胶囊剂取内容物) 0.300 0 g置于25 mL容量瓶中,加入甲醇15 mL,超声15 min,冷却至室温,用甲醇稀释至刻度,摇匀。移取液体样品5.00 mL置于25 mL容量瓶中,加入甲醇15 mL,超声15 min,冷却至室温,用甲醇稀释至刻度,摇匀。以5 000 r·min-1转速离心5 min后,移取上清液5.00 mL于10 mL容量瓶中,用初始流动相定容至刻度,摇匀,用0.45 μm微孔滤膜过滤,取续滤液。在仪器工作条件下进行测定。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 色谱柱
26种药物极性差异较大,补充检验方法及文献采用的以5微米全多孔硅胶颗粒为填料的色谱柱难以在短时间内对多种成分同时快速分离,分离时间一般在40 min以上[10]。在相同的流动相体系下,试验分别采用Phenomenex Kinetex XB-C18(100 mm×4.6 mm,2.6 μm)和ACE C18(250 mm×4.6 mm,5.0 μm)色谱柱对26种药物的混合标准溶液进行分析,色谱图见图1。

(a) Phenomenex Kinetex XB-C18色谱柱

(b) ACE C18色谱柱 峰号1~26所对应的化合物同表1图1 26种药物混合标准溶液在不同色谱柱上的色谱图Fig. 1 Chromatograms of the mixed standard solutions of 26 drugs on different columns
由图1可知:采用Phenomenex Kinetex XB-C18色谱柱(100 mm×4.6 mm,2.6 μm),26种成分在20 min内完全分离,分离度均大于1.5;而使用分析性能优秀的传统5微米填料的色谱柱ACE C18色谱柱(250 mm×4.6 mm,5.0 μm),26种成分在40 min内未能完全分离。
核-壳亚3微米填料的色谱柱由于实心的硅核减小了传质阻力和流路扩散,明显改善了色谱峰形及分离度,可实现高通量快速分离。试验分别考察了Phenomenex Kinetex XB-C18(100 mm×4.6 mm,2.6 μm)、Thermo Accucore C18(100 mm×4.6 mm,2.8 μm)、Agilent Poroshell 120 EC C18(100 mm×4.6 mm,2.7 μm)、Agilent Poroshell 120 SB C18(100 mm×4.6 mm,2.7 μm)等4种核-壳亚3微米填料色谱柱对26种药物的分离效果,发现Phenomenex Kinetex XB-C18色谱柱的分离效果最好。因此,试验选择Phenomenex Kinetex XB-C18色谱柱进行分离。
2.1.2 流动相
为了减少监督检验中使用的流动相种类,提高工作效率,仍采用补充检验方法2009025的“乙酸铵溶液-甲醇-乙腈”流动相体系,并通过调节流动相比例和乙酸铵溶液的酸度实现26种药物的分离。试验结果表明乙酸铵溶液的酸度对4种成分的分离效果影响较大。当乙酸铵溶液的pH为4.1时,奥沙普秦与萘丁美酮的分离度小于1.5;当乙酸铵溶液的pH为4.3时,氢化可的松与吡罗昔康、地塞米松与舒林酸、醋酸地塞米松与奥沙普秦的分离度小于1.5。只有当乙酸铵溶液的pH为4.2±0.05时,26种药物能在最短时间内实现完全分离。最佳分离条件见1.2节,色谱图见图1。
2.1.3 柱温
分别考察了30,35,40 ℃柱温条件下的分离效果。结果发现:当柱温为40 ℃时,氢化可的松与吡罗昔康分离度下降,分离度不足1.5;当柱温为30 ℃时,双氯芬酸钠与保泰松分离度下降,分离度不足1.5;当柱温为35 ℃时,26种药物能实现完全分离,峰形理想。因此,试验选择柱温为35 ℃。
2.2 线性关系和检出限
将标准储备溶液用初始比例流动相稀释配制成质量浓度为1.0,5.0,10,20,50,100 mg·L-1的混合标准溶液系列,按仪器工作条件进样,以峰面积y对质量浓度x进行线性回归,26种药物的质量浓度在1.0~100 mg·L-1内呈线性,线性回归方程和相关系数见表1。
取阴性样品提取液5 mL,置于10 mL容量瓶中,加入26种药物混合标准溶液适量,用初始比例流动相逐级稀释,以3倍信噪比计算检出限,结果见表1。

表1 线性参数与检出限Tab. 1 Linearity parameters and detection limits
2.3 精密度与回收试验
选择阴性胶囊制剂0.300 0 g作为基质,分别做高、中、低浓度水平的加标试验,平行配制6份,按试验方法进行测定,结果见表2。

表2 精密度与回收试验结果(n=6)Tab. 2 Results of tests for precision and recovery(n=6)
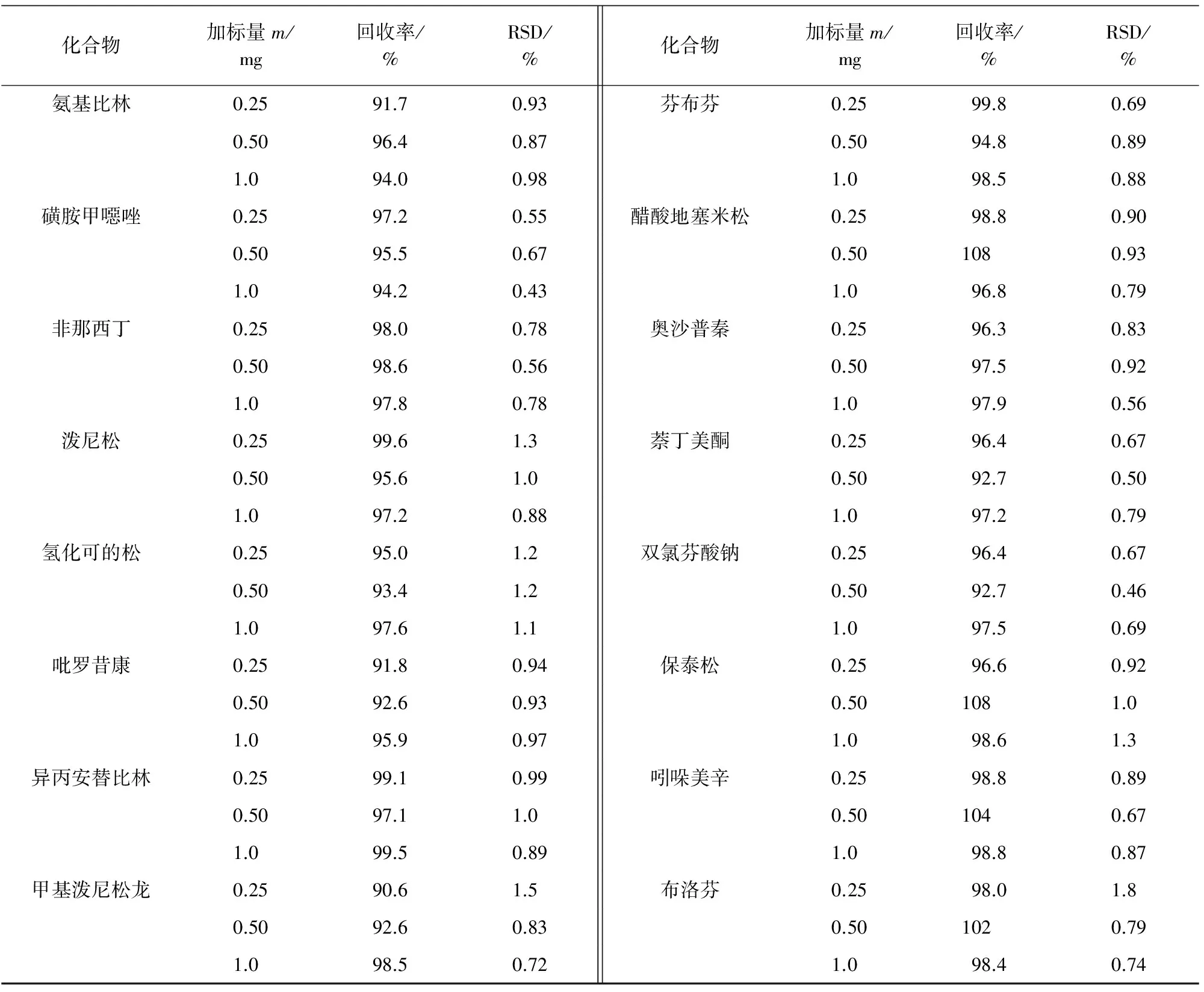
表2(续)
由表2可知:3个浓度水平的加标回收率为90.6%~110%,相对标准偏差(RSD)为0.42%~2.5%。
2.4 样品分析
从互联网、自制凉茶店搜集镇痛类健康产品共66批次,包括胶囊剂、颗粒剂、片剂、丸剂、软胶囊剂、水剂等基质的中成药、保健食品和食品。按试验方法进行测定,发现24批样品非法添加解热镇痛抗炎类药物及糖皮质激素类药物,不合格率为36%;检出8种阳性成分,分别为吡罗昔康、醋酸泼尼松、双氯芬酸钠、对乙酰氨基酚、吲哚美辛、布洛芬、萘普生、非那西丁。
典型阳性样品的测定结果见表3,色谱图见图2。
在不合格样品中,最常检出的成分为吡罗昔康、双氯芬酸钠、醋酸泼尼松和对乙酰氨基酚。其中,混合添加占非法添加样品的75%,“吡罗昔康+醋酸泼尼松+双氯芬酸钠”为最常见的混合添加形式,同时混合添加多种药物存在较高的安全隐患,可能引发的不良反应值得关注。

表3 典型阳性样品的测定结果Tab. 3 Determination results of typical positive samples
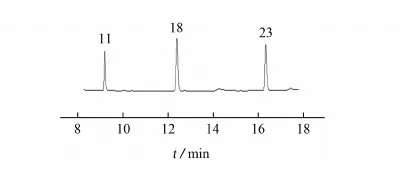
峰号11,18,23所对应的化合物同表1图2 典型阳性样品的色谱图Fig. 2 Chromatogram of a typical positive sample
本工作针对目前国内文献报道的镇痛类健康产品中非法添加的所有阳性检出成分进行研究,采用核-壳亚3微米填料色谱柱建立了该类健康产品中25种非法添加解热镇痛抗炎类药物及糖皮质激素类药物的液相色谱分析方法。与传统方法相比,该方法具有分析时间短、分析容量大等优点,能有效提高检验效率,可为镇痛类健康产品中非法添加化学药物的监督检验提供有力技术支撑。
[1] 吴晓敏,史大军,王明娟,等.止痛止痒类中成药中非法添加化学药物的快速鉴定方法[J].中成药, 2014,36(10):2095-2100.
[2] 王震红,杨永刚,刘东辉,等.2011年辽宁省中成药及保健食品中非法添加化学药品检验结果分析[J].中国药事, 2012,26(9):929-930.
[3] 蔡霞,雷毅.我国膏贴类医疗器械产品监管工作存在的问题及对策[J].中国药房, 2013,24(44):4222-4224.
[4] 巩丽萍,田晨颖,郭常川,等.超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速筛查及定量分析中成药或保健品中非法添加的24种消炎止痛类化学成分[J].中国药学杂志, 2015,50(24):2154-2159.
[5] 吴小红,李焕德,吴高芬,等.HPLC-DAD法同时测定部分中成药及保健品中添加的9种解热镇痛药物[J].药物分析杂志, 2010,30(10):1865-1868.
[6] 汪元符.抗炎抗风湿功效中成药中非法添加非甾体抗炎药及激素类成分的检测[J].中国执业药师, 2015,12(11):19-26.
[7] 李欣荣,陈安珍,杨钊.UPLC-MS/MS检测消肿止痛类中成药中违禁添加的双氯芬酸钠和氨基比林[J].药物分析杂志, 2010,30(7):1294-1297.
[8] 温家欣,陈林,赖宇红,等.高效液相色谱法同时快速测定凉茶中11种非法添加化学药物[J].分析测试学报, 2016,35(3):285-291.
[9] 吴西梅,朱炳辉,钟志雄,等.镇痛平喘类中成药中违禁添加的6种糖皮质激素的液相色谱-质谱检测[J].分析测试学报, 2009,28(1):55-58.
[10] 黎雪清,谭渺,蒋创杰,等.HPLC法快速筛查抗风湿类中成药和保健食品中24种非法添加化学成分[J].中成药, 2014,36(9):1891-1894.
[11] 潘炜,顾鑫荣,刘志璋,等.LC-MS/MS法测定中成药制剂中23个非甾体抗炎药[J].药物分析杂志, 2012,32(2):261-266.
[12] 郭杰标,肖仔君,郝卿辰,等.保健酒中舒林酸免疫学检测方法的建立[J].现代食品科技, 2013,29(7):1691-1695.
[13] 郭杰标,李杏娉,郝卿辰,等.保健酒违法添加奥沙普嗪免疫学检测方法建立[J].食品研究与开发, 2013,34(11):48-50.
[14] 郭杰标,李杏娉,郝卿辰,等.保健酒违法添加双氯芬酸免疫检测方法的建立[J].食品与机械, 2013,29(4):59-62.
[15] 赵贝贝,张艳,唐涛,等.硅胶基质高效液相色谱填料研究进展[J].化学进展, 2012,24(1):122-130.
[16] KIRKLAND J J, TRUSZKOWSKI F A, RICKER R D. Atypical silica-based column packings for high-performance liquid chromatography[J]. Journal of Chromatography A, 2002,965(1/2):25-34.
[17] ABRAHIM A, MOHAMMAD A S, SKRDLA P, et al. Practical comparison of 2.7μm fused-core silica particles and porous sub-2μm particles for fast separations in pharmaceutical process development[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009,51(1):131-137.
[18] KIRKLAND J J, SCHUSTER S A, JOHNSON W L, et al. Fused-core particle technology in high-performance liquid chromatography: an overview[J]. Journal of Pharmaceutical Analysis, 2013,3(5):303-312.
[19] HSIEH Y S, DUNCAN C J G, BRISSON J M. Fused-core silica column high-performance liquid chromatography/tandem mass spectrometric determination of rimonabant in mouse plasma[J]. Analytical Chemistry, 2007,79(15):5668-5673.
[20] 雷毅,黄艳婷,陈林,等.高效液相色谱法同时快速测定壮阳类保健品中的18种非法添加物[J].理化检验-化学分册, 2016,52(3):249-254.
[21] 陈林,温家欣,雷毅,等.高效液相色谱法同时快速检测腌腊肉制品中20种非法添加合成色素[J].分析测试学报, 2015,34(9):1008-1013.
